PPAR-γ2单核苷酸多态性与糖化血红蛋白水平的交互作用和糖尿病性牙周炎易感性的关系
刘钦赞,庞真贞,刘莉芳
慢性牙周炎(chronic periodontitis,CP)是局部致病菌感染与宿主反应失衡所致的牙周组织慢性炎症,最终可导致患者牙齿松动脱落[1];中国约有80%~97%成年人患有不同程度的牙周疾病[2]。研究表明[3,4],CP是糖尿病的第六大并发症,糖尿病对牙周炎的易感性增强,临床上约有60%患者同时患有糖尿病和CP。近年来有研究发现,遗传因素是CP和2型糖尿病(type 2 diabetes mellitus,T2DM)共有的危险因素之一[5]。因此,对易感人群做出预测,对T2DM患者做到早发现、早诊治是避免患者发生糖尿病性牙周炎(diabetic periodontitis,DP)的重要措施[6]。
过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptor,PPAR)-γ是由配体激活的核转录子[7],包含PPAR-γ1、PPAR-γ2和PPAR-γ3 3种亚型,其中PPAR-γ2主要表达于脂肪组织,Pro12Ala是PPAR-γ2常见的单核苷酸多态性(single nucleotide polymorphism,SNP),与脂肪细胞分化、肥胖、胰岛素抵抗密切相关,在调节内脂质代谢和能量平衡中具有重要作用[8]。Deeb SS等[9]早期研究表明,PPAR-γ2的Pro12Ala变异与T2DM相关,Pro12纯合子是日本人群发生T2DM的危险因素,而Ala等位基因可能是T2DM的保护因子。随后Altshuler D等[10]对北欧人群进行的研究证实,与T2DM相关的16个基因多态位点中仅Pro12Ala与T2DM有关,提示PPAR-γ及其SNP有可能成为疾病潜在的诊断和治疗靶标。近年来的研究表明,血糖控制情况与牙周病的进展密切相关,血糖控制欠佳的糖尿病患者发生中重度CP者居多。糖化血红蛋白(glycohemoglobin,HbA1c)可反映近2~3个月血糖平均水平,是评价糖尿病患者血糖控制水平的金标准[11]。笔者拟探讨PPAR-γ2 Pro12Ala SNP与HbA1c水平的交互作用及两者在DP易感性的关系,为筛选DP的高危人群提供遗传学依据。
1 材料与方法
1.1 实验材料
1.1.1 临床材料
选择2017年8月至2020年4月于保定市第一中心医院就诊的DP患者259例(DP组),其中男性138例,女性121例;年龄28~55岁,平均年龄42.98岁(标准差8.97岁);体质量指数 (body mass index,BMI)22.42~32.13 kg/m2,平均BMI 27.25 kg/m2(标准差4.03 kg/m2);吸烟64例,高血压史78例。T2DM患者257例(T2DM组),其中男性124例,女性133例;年龄31~59岁,平均年龄43.31岁(标准差8.82岁);BMI 22.74~29.88 kg/m2,平均BMI 25.87 kg/m2(标准差3.01 kg/m2);吸烟56例,高血压史85例。选择同期接受健康体检者180例作为对照组,其中男性94例,女性86例;年龄28~60岁,平均年龄43.30岁(标准差8.65岁);BMI 21.13~27.03 kg/m2,平均BMI 22.57 kg/m2(标准差2.67 kg/m2);吸烟30例,高血压史69例。
DP组选择标准:患者被确诊为CP并伴有T2DM,慢性牙周炎诊断标准参照Armitage 1999年牙周病分类标准[12]:中重度牙周炎定义为全口至少有10颗可进行牙周评价的牙齿,其中至少有4颗磨牙(不包括第三磨牙);至少有3个象限内有一个或多个探诊深度(porching depth,PD)≥4 mm、临面附着丧失(clinical attachment loss,CAL)≥3~4 mm,牙齿松动>Ⅰ,X射线片示牙槽骨吸收>Ⅰ°。
T2DM组选择标准:参照《糖尿病诊疗标准》[13],将空腹血糖(fastingplasmaglucose,FPG)水平≥7.0mmol/L,或口服葡萄糖耐量实验 (oral glucose tolerance test,OGTT)2 h血糖≥11.1 mmol/L,或正在用口服降糖药物或胰岛素治疗定义为T2DM,同时患者未患CP。
对照组选择标准:经诊断未患T2DM及CP;牙周健康。其中牙周健康标准[14]:口腔卫生状况良好,全口牙齿平均附着丧失(attachment loss,AL)≤0.5 mm、CAL≥3 mm的位点数为0,失牙数不超过2颗,X射线片显示无明显牙槽骨吸收。
排除标准:患者患有其他PPAR-γ2 SNP相关的疾病;患者患有感染性、染色体疾病;患者患有严重心、肝、肾、肺部疾病及凝血功能异常。
3组患者年龄、性别比例、吸烟情况、BMI差异无统计学意义(P>0.05)。
1.1.2 主要试剂与仪器
琼脂糖(Promega,美国);1×TE缓冲溶液(Sangon,美国);全血基因组DNA提取试剂盒、DNA Maker、2Taq PCR Mix(北京天根生物科技有限公司,中国);无水乙醇(天津富宇精细化工有限公司,中国);Taq DNA聚合酶(Qiagen,德国)。
ABI 7300型聚合酶链式反应(polymerase chain reaction,PCR)仪(ABI公司,美国);GL 16G型高速台式离心机(上海医用分析仪器厂,中国);DYY-Ⅲ型电泳仪(北京六一仪器厂,中国);Du640型紫外分光光度计(Beckman,美国);JS-780A全自动凝胶成像分析仪(上海培清科技有限公司,中国);微量移液器(Eppendorf公司,德国)。
1.2 方法
1.2.1 临床检查
所有患者进行牙周临床指标检查,以6颗指数牙(16、11、26、31、36、46)代表上下颌6个区段。每颗牙检查6个位点(颊侧近中、颊侧中央、颊侧远中、腭侧近中、腭侧中央、腭侧远中)的牙周PD、CAL,简化口腔卫生指数(simplified oral hygiene index,OHI-S)。对于龈沟出血指数(sulcus bleeding index,SBI),只记录颊、舌2个牙面。所有牙面的PD、CAL、SBI、OHI-S取其平均值。同时记录全口缺失牙齿数目,以28颗牙为标准。对参加牙周检查的3名牙周医生进行标准一致性检验,以证实重复性良好(K>0.78)。
1.2.2 样本采集
收集患者入院次日清晨空腹(禁食8~12 h)静脉血标本5 mL,采用高速冷冻离心机(3 000 r/min,15 min)对患者血液进行离心分离血清;采用全自动生化分析仪检测总胆固醇(total cholesterol,TC)、甘油三酯(triacylglycerol,TG);采用Sysmex系列CA-1500全自动生化仪检测T2DM患者血清HbA1c和FPG[15]。根据患者HbA1c水平分为HbA1c<6.0%、6.0%≤HbA1c<8.0%和HbA1c≥8.0%。
1.2.3 全血DNA提取
使用乙二胺四乙酸二钾 (ethylene diamine tetraacetic acid dipotassium salt,EDTA-K2)抗凝采血管采集患者血液样本,使用DNA提取试剂盒提取其全血基因组DNA,采用紫外分光光度仪检测提取DNA浓度。
1.2.4 PPAR-γ2 Pro12Ala多态性检测
采用双脱氧末端终止法对所有样本的全血基因组DNA进行测序,检测PPAR-γ2 Pro12Ala多态性(rs1801282)的等位基因。由上海生物工程股份有限公司设计并合成引物,引物序列:F为5′-GGAACTGATGTCTTGACTCATG-3′,R为5′-TTATCAGAGAGAGAGG-3′。采用实时荧光PCR仪进行PPAR-γ2 Pro12Ala基因分型,基因分型分为纯合子Pro/Pro(P/P)、杂合突变Pro/Ala(P/A)和纯合突变Ala/Ala(A/A)。对PCR产物进行1%琼脂糖凝胶电泳,再用凝胶成像系统检测条带情况。
PCR反应体系为:模板DNA 2μL,上下游引物各1μL(10μmol/L),2×PCR Mix 25μL,并用无菌去离子水补足至总体积50μL。PCR反应条件为:95℃预变性4 min,94℃变性30 s,55℃退火30 s,72℃延伸40 s,共35个循环;最后72℃修复延伸10 min。PCR产物纯化:每50μL PCR产物中加入4μL 3 mol/L NaAc和80μL 95%乙醇溶液,离心去上清液,待乙醇挥发后加入20μL TE溶解。
PCR产物测序反应体系:纯化后PCR产物2μL,引物1.5 p 2μL,灭菌水2μL,Big Dye Seq 5*Buffer 1.2μL,Big Dye0.4μL。PCR产物测序体系:95℃1 min,95℃20 s,55℃20 s,60℃3 min,共30个循环。采用自动SNP分型软件对SNP进行数据分析。
1.3 统计学方法
采用Excel计算病例对照研究中各组样本是否符合Hardy-Weinberg遗传平衡定律(P>0.05为符合);采用SPSS 22.0统计软件对数据进行统计分析。计数资料用频数或百分数表示,比较采用卡方检验;计量资料采用均数±标准差表示,组间比较采用t检验;使用单因素方差分析或Mann-Whitney U比较对照组与T2DM组、DP组间临床资料、牙周临床指标及基因型分布的差异;采用二分类或多分类的Logistic回归分析计算比值比(odds ratio,OR)和95%可信区 间(confidence interval,95%CI)评 价PPAR-γ2 Pro12Ala SNP与DP的相关性,P<0.05为差异具有统计学意义。根据Khoury和Wagener提出的交互作用模型和交互系数(γ=βeg/βe)[16]判断基因-环境交互作用模型及交互作用类型。判定依据如下:γ>1为正向交互作用;γ<1为负向交互作用;γ=1表示无交互作用。在病例对照研究中,γ为两变量lgOR的比值。判定依据2:e、g两因素的比值比为OReg,e因素的比值比为ORe,g因素的比值比为ORg。OReg=ORe×ORg为相乘模型;OReg>ORe×ORg为超相乘模型;OReg<ORe×ORg为次相乘模型;OReg=ORe+ORg-1为相加模型。
2 结果
2.1 3组牙周临床指标及全身指标比较
3组TC、性别、年龄、吸烟史及高血压史差异无统计学意义(P>0.05)。与对照组比较,T2DM组、DP组BMI、PD、CAL、SBI、OHI-S、缺失牙数、FPG、TG及HbAlc均显著增加;与T2DM组比较,DP组PD、CAL、SBI、OHI-S、缺失牙数、FPG均显著增加,差异具有统计学意义(P<0.05)。见表1。

表1 3组临床材料、牙周临床指标及全身指标比较Tab.1 Comparison of clinical data,periodontal clinical indexes and systemic indexes in 3 groups
2.2 PPAR-γ2 Pro12Ala单核苷酸多态性分析
基因分型后可得纯合子Pro/Pro(P/P)型片段为224 bp、43 bp,杂合突变Pro/Ala(P/A)型片段为276 bp、224 bp、43 bp,纯合突变Ala/Ala(A/A)型片段为267 bp。从图1中可以看出第1、2、3、4、5、7、8、9、10、11、12、13、14、15、17、18为纯合子P/P型,6为杂合突变P/A型,16为纯合突变A/A型。
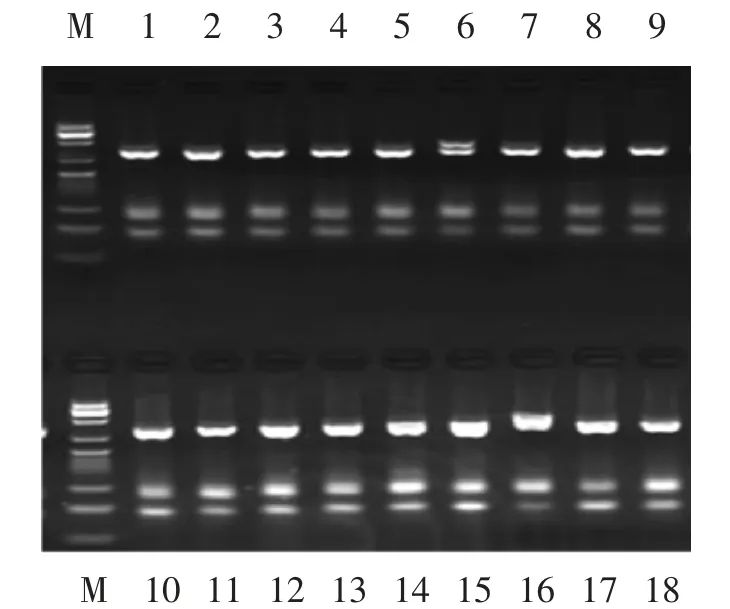
图1 Pro12Ala SNP的基因型电泳图Fig.1 Electrophoreis of Pro12Ala SNPgenotype
DNA测序结果显示,PPAR-γ2 Pro12Ala基因一致性为100%(图2)。

图2 PPAR-γ2 Pro12Ala DNA测序结果Fig.2 Diagrams of PPAR-γ2 Pro12Ala DNA sequencing results
2.3 糖尿病性牙周炎易感性与HbA1c水平的风险分析
6.0 %≤HbA1c<8.0%、HbA1c≥8.0%的患者分布在T2DM组分别为31.13%、36.96%,在DP组分别为33.59%、51.35%,在对照组分别为15.00%、11.67%;3组间的分布差异具有显著统计学意义(χ2=16.727,P<0.001)。6.0%≤HbA1c<8.0%、HbA1c≥8.0%患者患DP的风险明显高于HbA1c<6.0%的患者(ORT2DM=2.046、3.105、1.000,ORDP=4.458、8.204、1.000),并且HbA1c≥8.0%患者患DP的风险高于6.0%≤HbA1c<8.0%患者(χ2=6.087,P<0.01)。见表2。

表2 3组不同HbA1c水平的DP发生率比较Tab.2 Comparison of DP incidence in 3 groups with different levels of HbA1c
2.4 糖尿病性牙周炎易感性与PPAR-γ2 Pro12Ala突变的风险分析
纳入的患者均检测出PPAR-γ2 Pro12Ala,检出率为100%,经Hardy-Weinberg平衡检验,PPAR-γ2 Pro12Ala各基因型在对照组中分布符合Hardy-Weinberg定律(均P>0.05),表明研究样本群体具有良好的代表性。DP组基因型PP、PA、AA基因频率与对照组与T2DM组不同HbA1c水平的DP发生率比较,χ2=25.157,P<0.001;对照组与DP组不同HbA1c水平的DP发生率比较,χ2=29.982,P<0.001;T2DM组与DP组不同HbA1c水平的DP发生率比较,χ2=37.670,P<0.001 T2DM组及对照组比较,差异具有显著统计学意义(χ2=24.835,P<0.001),OR值大于1(DP组:1.000、6.183、6.403;T2DM组:1.000、2.529、2.594);等位基因P、A在DP组与对照组间分布比较,差异具有显著统计学意义(χ2=15.987,P<0.001),且OR值均大于1(1.000、4.203)。说明含等位基因P、A的个体发生DP的风险较高。两位点的不同基因型在T2DM组与对照组间的分布差异均具有显著统计学意义(χ2=16.813,P<0.001)。提示PPAR-γ2 Pro12Ala(CCA→GCA突变)可能增加T2DM患者患DP的风险。等位基因P、A在DP组与T2DM组间分布比较,差异具有显著统计学意义(χ2=13.181,P<0.001),提示DP易感性与T2DM患者PPAR-γ2 Pro12Ala突变有关。见表3。

表3 3组PPAR-γ2 Pro12Ala基因型和等位基因频率比较Tab.3 Comparison of Pro12Ala genotype and allele frequency of PPAR-γ2 in 3 groups
2.5 糖尿病性牙周炎多元回归模型分析
将HbA1c水平和Pro12Ala基因型作为自变量,以DP是否发生为因变量(0:未患DP;1:患DP),即T2DM、DP组患者,采用逐步后退法进行非条件Logistic回归分析。结果显示,HbA1c水平越高和Pro12Ala基因型(PA/AA)是DP的危险因素。见表4。

表4 DP危险因素的非条件Logistic回归分析Tab.4 Unconditional Logistic regression analysis of DPrisk factors
2.6 PPAR-γ2 Pro12Ala单核苷酸多态性在糖尿病性牙周炎发病中的交互分析
单纯6.0%≤HbA1c<8.0%的ORe1在T2DM组为2.417,在DP组为5.827。单独携带Pro12Ala基因型PA的ORg1在T2DM组为2.275,在DP组为7.913;两者同时存在时,交互作用ORe1g1在T2DM组为5.897,在DP组为35.029。交互系数γ=βe1×g1/βe1>1,ORe1g1>ORe1×ORg1为超相乘模型;此外,6.0%≤HbA1c<8.0%与Pro12Ala基因型AA之间、HbA1c≥8.0%与Pro12Ala基因型PA之间及HbA1c≥8.0%与Pro12Ala基因型AA之间均存在正向交互作用(γ>1)。见表5。
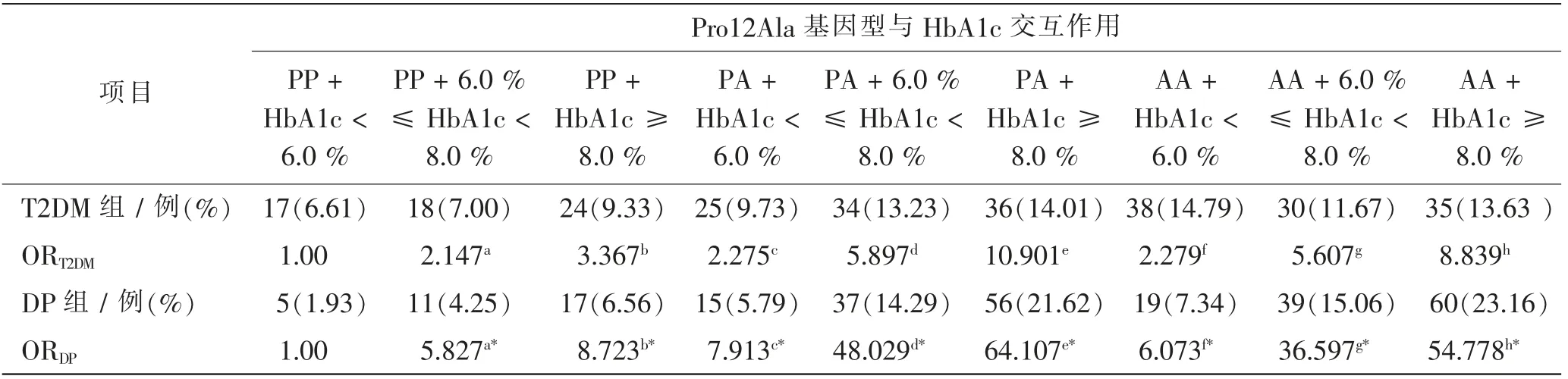
表5 PPAR-γ2 Pro12Ala基因型及HbA1c在DP发病中的交互作用Tab.5 Interaction of PPAR-γ2 Pro12Ala genotype and HbA1c in pathogenesis of DP
3 讨论
PPAR-γ2属PPAR家族成员,为配体诱导的核转录因子,位于第3号染色体短臂2区5带(3p25)位上,有多种突变形式,其中以外显子2的第34位核苷酸C/G突变最为常见,此突变造成蛋白质12位点Pro替换为Ala,即Pro12Ala SNP。该SNP影响胰岛素β细胞功能,导致胰岛素分泌及外周组织对胰岛素敏感性的改变,调节体内多个脂肪细胞特异性基因的转录,同时影响细胞的分化、糖脂质代谢的调节,在胰岛素抵抗相关性疾病发病发生机制中起重要作用。PPAR-γ2 Pro12Ala SNP包 含Pro12Ala(PP)、Pro12Ala(PA)和Pro12Ala(AA)3种基因型。近年来的研究表明[17],PPAR-γ2 Pro12Ala SNP与糖尿病相关,但PPAR-γ2的表达受基因和环境因素的影响,其表达和诱导表达表现出地域和个体差异。此外,DP是常见的糖尿病慢性并发症之一,影响糖尿病患者生存质量。DP的发生、发展除了与控制血糖水平有关外,也可能与患者本身的遗传因素有关,因此笔者研究与糖尿病有关的易感基因PPAR-γ2与HbA1c的交互作用及与DP易感性的关系。
Hirano E等[18]研究了PPAR-γ2 Pro12Ala与牙周炎的相关性。结果显示,日本妇女在妊娠期中该基因型与牙周附着水平、牙周PD、牙龈指数及出血指数具有显著相关性。而Folwaczny M等[19]研究了PPARγ的5个基因SNP位点,在校正性别、年龄及吸烟因素后,5个单倍体都与CP无显著关联。进一步研究发现,PPAR-γPro12Ala基因型的绝经期女性患者,牙周炎症指标、骨密度及维生素D之间具有相关性[20];当BMI>25 kg/m2时,β肾上腺素受体和PPAR-γ两者基因SNP与牙周炎症呈明显正相关[21]。笔者研究发现,Pro12Ala(PA)和Pro12Ala(AA)基因型与DP的发生、发展有关,携带Pro12Ala(PA)和Pro12Ala(AA)基因的T2DM患者患DP的风险高于携带Pro12Ala(PP)的个体。
王祥芸等[22]研究发现,HbA1c≥7.0%的T2DM伴CP患者PD、AL显著高于HbA1c<7.0%。苏哲君等[23]研究同样表明,血糖控制不佳的老年T2DM伴CP患者牙周炎症损害程度较高,HbA1c≥8.0%老年T2DM伴CP患者所占比例高于HbA1c<8.0%患者。笔者研究结果显示,6.0%≤HbA1c<8.0%和HbA1c≥8.0%患者患DP的风险明显高于HbA1c<6.0%患 者 (ORT2DM=2.046、3.105,ORDP=4.458、8.204),并且HbA1c≥8.0%患者患DP的风险高于6.0%≤HbA1c<8.0%患者。进一步分析HbA1c与PPAR-γ2 Pro12Ala基因型的交互作用发现,HbA1c水平与Pro12Ala(PA)、Pro12Ala(AA)均存在正向交互作用(γ>1),携带Pro12Ala(PA)、Pro12Ala(AA)基因型者高的HbA1c水平危害效应越大,Pro12Ala(PA)、Pro12Ala(AA)与HbA1c水平交互作用OReg均大于ORe×ORg,显示Pro12Ala(PA)、Pro12Ala(AA)与HbA1c水平交互作用机制在DP发生中为超相乘模型。
综上所述,笔者研究发现PPAR-γ2 Pro12Ala SNP与DP易感性相关,PPAR-γ2 Pro12Ala突变基因型的个体属DP高危人群,牙周临床医师应在防治方案中加以重视。通过PPAR-γ2 Pro12Ala SNP检测,预测个体发生DP的风险,采取相应的控制措施如控制患者HbA1c水平以达到有效预防DP的目的。

