超微血管成像联合CMR-FT在ACS患者微血管功能障碍评估中的应用
许保刚,魏 刚,贺 朝,黄瑞瑜,刘 辉,郭长义,李 斌,张 瑜,张 婉
急性冠状动脉综合征(acute coronary syndrome,ACS)主要包括不稳定性心绞痛、无ST段抬高的心肌梗死、ST段抬高的心肌梗死及猝死。有研究报道指出[1],ACS的病理基础主要是不稳定性的冠状动脉粥样硬化斑块和血小板的聚集,进一步刺激机体血栓的形成,严重影响患者的生命安全。一般情况下,稳定性斑块主要特点为炎性细胞较少、纤维量含量较多[2]。不稳定性斑块的纤维帽较薄,肩部的炎性细胞含量较多,多由于肩部的内膜撕裂或者破损,进一步促进血小板的聚集,进而形成血小板血栓[3]。微血管的功能障碍是临床ACS疾病进展的重要危险因素。心血管MRI特征追踪技术(cardiovascular magnetic resonance feature tracking technology,CMR-FT)通过对急性期左心室心肌应变及心功能的量化分析[4],进而对患者的疾病进展进行综合分析。超微血管成像(superb microvasular imaging,SMI)可通过对病灶部位的斑块稳定性进行分析,对于疾病的稳定性进行预测。笔者通过SMI联合CMR-FT在ACS患者微血管功能障碍评估中的应用分析,为临床诊断提供科学依据。
1 资料与方法
1.1 临床资料
采用前瞻性分析,选择2017年8月至2020年11月在陕西中医药大学第二附属医院诊治的120例ACS患者(观察组),其中男性57例,女性63例;年龄51~84岁,平均年龄66.57岁(标准差5.04岁);体质量指数24.11~25.09 kg/m2,平均体质量指数24.59 kg/m2(标准差2.69 kg/m2);稳定心绞痛(stable angina pectoris,SAP)49例,不稳定心绞痛(unstable angina pectoris,UAP)43例,急性心肌梗死(acute myocardial infarction,AMI)28例。另选取同期进行体检的健康人群120例(对照组),其中男性55例,女性65例;年龄50~82岁,平均年龄66.14岁(标准差3.11岁);体质量指数24.09~25.11 kg/m2,平均体质量指数24.19 kg/m2(标准差2.78 kg/m2)。所有患者均签署知情同意书,并经伦理委员会论证通过。
选择标准:①均符合ACS诊断标准[5];②所有患者均知情同意。
排除标准:①急性心功能不全、先天性心脏病、原发性心肌病等非冠状动脉狭窄所致的心脏病;②脑血管病;③肝肾功能障碍;④自身免疫性疾病;⑤急性感染、慢性感染急性发作;⑥Ⅱ型糖尿病;⑦活动性肺结核或恶性肿瘤;⑧已发生心力衰竭;⑨年龄不足18岁;⑩严重精神疾病。
两组一般资料比较,差异无统计学意义(t/χ2=0.072、0.795、1.133,P=0.796、0.427、0.258)。
1.2 方法
1.2.1 心血管MRI特征追踪技术
采用德国西门子3.0 T MRI扫描仪对患者的心脏进行扫描。扫描过程中采用18通道心脏相控线圈,在稳态模式下,对患者采取快速电影序列采集标准左心室短轴及左心室各腔的心电影像学图像进行分析。扫描参数:重复时间(repetition time,TR)=3.8 ms,回波时间(echo time,TE)=1.4 ms,分数各向异性(fractional anisotropy,FA)=80°,视野扫描(field of view,FOV)=340 mm×340 mm,矩阵=139×208,层厚=8 mm,层间距=1.6 mm,采集时间=15~18 s。使用对比剂轧喷酸葡胺对患者进行肘静脉注射后,使用反转恢复梯度回波序列延迟强化技术对患者进行技术采集局部病灶部位的图像;使用心血管后期处理软件对获得的图像进行分析,对患者的左心室整体峰值径向应变值(global peak radial strain,GPRS)、整体峰值纵向应变值(global peak longitudinal strain,GPLS)、整体峰值周向应变值(global peak circumferential strain,GPCS)、节段峰值径向应变值 (peak radial strain,PRS)、节段峰值纵向应变值(peak longitudinal strain,PLS)、节段峰值周向应变值 (peak circumferential strain,PCS)进行分析;同时通过对患者心功能指标,主要包括左心室舒张末期容积指数(1eft ventricular end-diastolic volume index,LVEDVi)、心脏指数(cardiac index,CI)、左心室收缩末期容积指数(1eft ventricular endsystolic volume index,LVESVi)进行分析。
1.2.2 超微血管成像
采用日本东芝彩色超声仪对患者进行检测。所有患者采取仰卧位,向后仰头;首先进行常规超声检测,对病灶部位的冠状动脉进行横切面和纵切面扫描,对于病灶部位的斑块情况进行扫描;随后进行SMI检查,从斑块的近心端到远心端进行横断面扫描,同时通过纵向扫描,对斑块的顶部、基底部和近心端、远心端肩部的血流信号进行分析。
1.2.3 观察指标
两组左心室的心肌应变力比较。分别对观察组、对照组GPRS、GPCS、GPLS、PRS、PCS、PLS进行比较。
两组心功能比较。分别对观察组、对照组LVESVi、LVEDVi和CI进行比较。
两组冠状动脉斑块的影像学特点分析。分别对两组患者的动脉中层厚度、斑块面积和斑块数量进行比较。
联合诊断效能分析。采用CMR-FT和SMI联合诊断对ACS患者微血管功能障碍的诊断效能进行分析。
受试者工作特性(receiver operating characteristic,ROC)曲线。采用ROC曲线分析CMR-FT和SMI联合诊断对ACS患者微血管功能障碍的诊断效能。
1.3 统计学方法
采用SPSS 20.0软件进行统计分析。其中计量资料以均数±标准表示,采用独立样本t检验分析;计数资料采用卡方检验。P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
2 结果
2.1 两组患者的左心室的心肌应变力比较
观察组左心室GPRS[(24.89±8.24)%vs(44.26±9.19)%](t=17.191,P=0.000)、GPCS[(18.59±5.97)%vs(24.49±5.00)%](t=8.300,P=0.000)、GPLS[(10.73±2.26)%vs(14.27±2.62)%](t=11.208,P=0.000)、PRS[(26.58±5.61)%vs(40.55±3.99)%](t=22.230,P=0.000)、PCS[(17.00±4.11)%vs(24.22±4.23)%](t=13.410,P=0.000)、PLS[(10.54±0.64)vs(15.36±0.97)%](t=45.435,P=0.000)显著低于对照组。
2.2 两组患者的心功能比较
观察组患者LVESVi、LVEDVi显著低于对照组,差异有统计学意义(t=63.072、91.922,P=0.000、0.000)。见表1。

表1 两组患者的心功能比较Tab.1 Comparison of cardiac function between 2 groups
2.3 两组患者的冠状动脉斑块情况比较
观察组患者的动脉中层厚度、斑块面积和斑块数量显著高于对照组,差异有显著统计学意义(t=6.981、53.118、15.613,P=0.000、0.000、0.000)。见表2、图1。
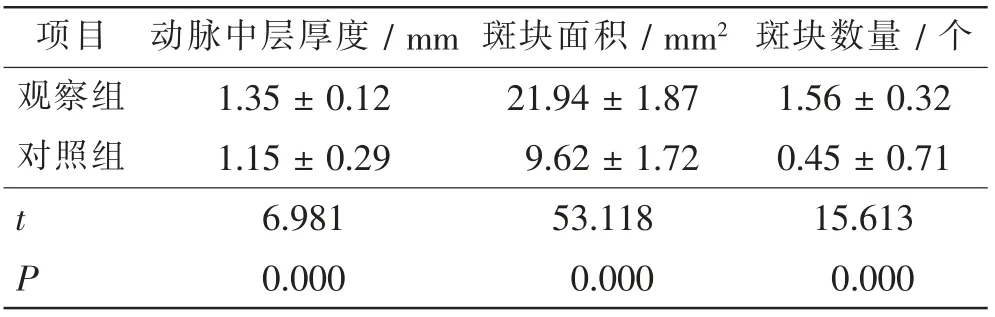
表2 两组患者的冠状动脉斑块情况比较Tab.2 Comparison of coronary plaque between 2 groups
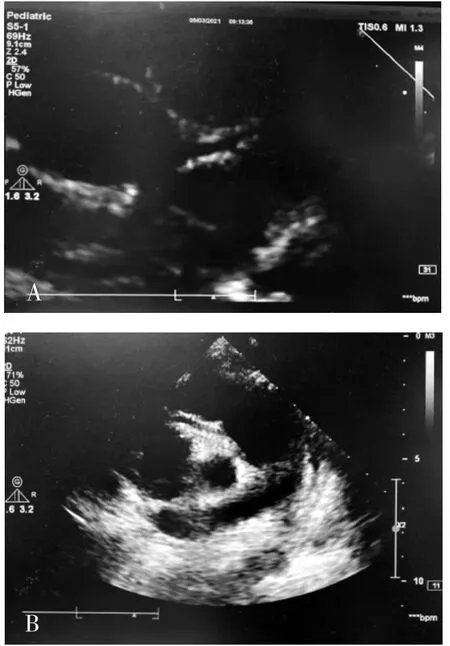
图1 左冠状动脉斑块(A)和右冠状动脉斑块(B)SMI图Fig.1 SMIimagesof left coronary artery plaque(A)and right coronary artery plaque(B)
2.4 联合诊断效能分析
CMR-FT与SMI联合诊断对于冠状动脉微血管功能障碍诊断的真阳性例数102例,假阳性例数5例,真阴性例数115例,假阴性例数18例;CMR-FT分别为108例、48例、72例、12例;SMI分别为110例、52例、68例、10例。CMR-FT与SMI联合诊断的准确度、特异度明显高于CMR-FT、SMI单独诊断,而灵敏度略有下降。见表3。

表3 联合诊断效能分析 %Tab.3 Effectiveness analysis of combined detection %
2.5 受试者工作特性曲线分析
通过ROC曲线分析,联合诊断的曲线下面积(area under curve,AUC)为0.950,显著高于CMR-FT、SMI单独诊断。见表4。
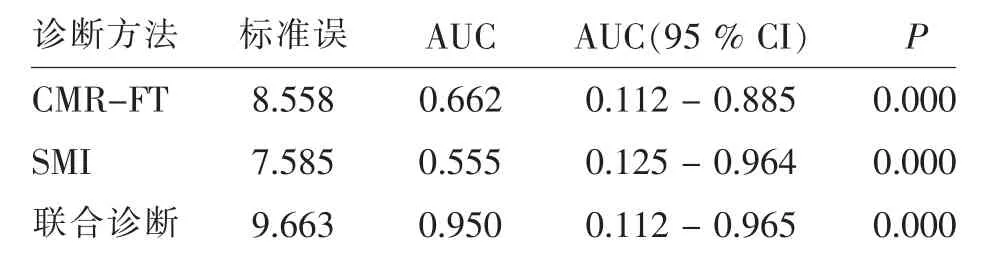
表4 3种诊断方法的ROC曲线分析Tab.4 ROCcurve analysis of 3 diagnosis methods
3 讨论
在冠状动脉疾病的进展过程中,微血管功能障碍是临床再灌注后常见的并发症之一[6]。有研究报道显示[7],50%ACS患者在经过手术治疗后,均会发生微血管功能障碍。同时微血管功能障碍还是临床造成不良心血管事件及左心室重构的重要预测因素,所以在临床治疗中,通过对患者的微血管功能障碍早期识别,对于ACS患者的风险分层及预后评估,及早开展干预,对于患者的预后具有积极的意义[8]。心肌应变力主要是指患者的心脏在收缩、舒张过程中,由于心脏变形造成的心肌力量的改变,通过对患者的心肌应变力的分析,对于患者左心室的结构、功能的改变具有显著的意义[9]。
在笔者研究中采用CMR-FT是基于电影的序列,通过后期软件的处理,对于心肌应变力的改变可以达到量化的分析,对于能够无创便捷的定量分析。以往的研究中已经证实,通过对患者的CMR-FT的分析,对于患者心肌应变力的组内、组间的重复性较差[7]。随着软件的进一步发展,目前对于心肌阶段应力改变的一致性在逐步提高,但是在临床的应用中其可重复性仍然处于较差的状态,所以单独通过对患者的CMR-FT检查对于临床诊断冠状动脉的微血管障碍具有一定的局限性[10]。而在笔者研究中相比健康人群而言,冠状动脉微血管功能障碍患者GPRS、GPCS、GPLS、PRS、PCS、PLS显著低于对照组。分析认为,在疾病的进展过程中,由于局部冠状动脉的缺血、缺氧,可能会造成心肌细胞的分布、心肌纤维的走行发生显著的改变,而在疾病的进展过程中心内膜下肌层最先受到累及,随后随着疾病的进一步进展,心内膜下肌层对应的纵向应变发生不同程度的损伤[11],所以在笔者研究中可以发现从近心端到远心端患者的GPRS、GPCS、GPLS、PRS、PCS、PLS发生显著的改变。
在临床疾病的进展过程中,30%冠状动脉微血管障碍均是由于颈动脉粥样硬化造成[12]。而动脉的粥样硬化形成的斑块结构及成分是导致心脑血管事件的重要事项。不稳定性的斑块易发生破溃脱落及诱发患者的血管动脉堵塞的重要风险因素。不稳定的斑块一般呈现不规则性或者甚至有溃疡斑、纤维帽薄弱和斑块内可见出血及炎性因子的进一步浸润[13],斑块内部的出血主要是由血管破裂所导致斑块内部新生血管及外膜的浸润、血管芽生与非芽生造成的单纯内皮细胞活跃增生造成。但是这种新生血管在形成过程中基底膜和结缔组织的支撑较少,血管的脆性较大,所以在临床发生破裂出血的风险也较高。研究表明斑块内部新生血管的数量、密度与其破溃的风险呈现显著的相关性[14],同时新生的血管在斑块的纤维帽的裂隙处聚集,也在一定程度上造成了患者不良风险的升高。
通过两种方法的联合诊断,对于冠状动脉的微血管障碍的诊断效能显著提升。提示,在对患者的诊断中,超声的诊断的灵敏度较高,可以在一定程度上弥补CMR-FT的可重复性较差的缺点;而采用CMRFT又在一定程度上弥补了超声诊断准确度较低,对于患者的斑块的成分具有显著的诊断意义。两种诊断互补,对于患者的冠状动脉微血管的障碍具有显著的诊断优势。
综上所述,SMI联合CMR-FT在ACS患者微血管功能障碍评估具有显著的意义,建议临床推广。

