68Ga标记的磁性铁氧体纳米颗粒PET/MRI双模态显像探针的制备及研究
李宛如,陈光锋,杨 婷,胡司琦,杨 远,马晓莉,张 勇
(1.中山大学附属第三医院核医学科,广东广州 510630;2.华南农业大学实验动物中心,广东广州 510640)
前列腺癌为2020 年男性第二大高发癌症和第四大癌症死亡原因[1]。随着疾病进展,有一部分病人会发展为侵袭性变体前列腺癌(aggressive variant prostate cancer,AVPC)和神经内分泌分化的前列腺癌,这种类型的前列腺肿瘤表面不表达前列腺特异性膜抗原(prostate-specific membrane antigen,PSMA)[2]。由于缺乏针对此类PSMA 表达阴性前列腺癌的可靶向抗原,现有的影像方法对AVPC 及其转移灶的诊断缺乏准确性和敏感性。新兴的PET/MRI双模态成像,其所得图像可同时具备高空间分辨率和高组织对比度的特点[3],PET/MRI 双模态成像联合靶向纳米探针可以对病变部位进行靶向成像[4]。有研究表明,肿瘤反应性间质中的癌症相关成纤维细胞(cancer associated fibroblasts,CAFs)表达的成纤维细胞激活蛋白(fibroblast activation protein,FAP)可成为肿瘤的成像靶点,故其特异性蛋白抑制剂成纤维细胞激活蛋白抑制剂(fibroblast activation protein inhibitor,FAPI)可用于修饰在纳米探针表面来引导探针向肿瘤部位聚集[5-6]。本研究通过在纳米表面修饰靶向分子FAPI和螯合剂羟基琥珀酰亚胺-四氮杂环十二烷四乙酸(DOTANHS ester,DOTA)并标记核素68Ga,制备一种PET/MRI 双模态探针68Ga-DOTA-UMFNPs-FAPI-04,并考察其弛豫率、进行MRI 显像研究和放化纯实验,为PSMA 表达阴性的前列腺肿瘤显像提供新思路。
1 材料与方法
1.1 试剂和仪器
1.1.1 主要试剂 1-乙基-(3-二甲基氨基丙基)碳酰二亚胺[1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC],N-羟基硫代琥珀酰亚胺(N-Hydroxysulfosuccinimide sodium salt,Sulfo-NHS),上海源叶生物科技有限公司;成纤维激活蛋白抑制剂(fibroblast activated protein inhibitor,FAPI-04),南昌探真生物技术有限公司;羟基琥珀酰亚胺-四氮杂环十二烷四乙酸(1,4,7,10-Tetraazacyclododecane-1,4,7,10-tetraacetic acid mono-N-hydroxysuccinimide ester,DOTA-NHS ester),广州大宇新创生物;3,4-二羟基苯基丙酸修饰的超小锰铁氧体纳米颗粒(UMFNPs-DHCA),西北大学材料学院。68GaCl3,广州市原子高科同位素医药有限公司。
1.1.2 主要仪器 透射电子显微镜,美国FEI 公司;傅里叶红外光谱仪,美国BioTek公司;动态光散射仪,英国Malvern公司;全谱直读等离子体发射质谱仪,美国PerkinElmer 公司;临床3 T 磁共振成像扫描仪,美国GE 公司;M3 1.0 T 小动物磁共振成像仪,Aspect Imaging 公司;γ-放射免疫计数器,科大创新股份有限公司。
1.1.3 实验动物 Balb/c 小鼠,雄性,体质量约20 g,SPF 级,北京维通利华生物科技有限公司。于小鼠右前肢腋下接种106个前列腺癌PC3 细胞,待肿瘤平均直接达到10 mm 时用于成像实验。本研究通过华南农业大学医学伦理委员会审批,伦理批号为2021d079。
1.2 靶向纳米粒子的合成和表征
经两步反应合成DOTA-UMFNPs-FAPI-04,其反应路线示于图1。

图1 DOTA-UMFNPs-FAPI-04的合成路线示意图Fig.1 Synthesis of DOTA-UMFNPs-FAPI-04
1.2.1 靶向纳米粒子DOTA-UMFNPs-FAPI-04 的制备 将10 mg UMFNPs-DHCA 溶于20 mL磷酸盐缓冲溶液(PBS,0.1 mol/L,pH=7.2)中,加入40 mg EDC 超声分散30 s 后室温摇床10 min。反应结束后加入110 mg Sulfo-NHS,超声分散30 min 后室温摇床10 min,然后加入10 µL EDA(10 mmol/L),室温摇床4 h。反应结束后,采用超滤浓缩离心管离心方式洗涤反应物。将反应物移至超滤浓缩离心管上层,在6 000 r/min的条件下离心8 min(离心机半径r=8.5 cm),弃去下层液体,上层残余物加入去离子水洗涤后再次离心,重复5 次。将最后一次洗涤产物溶于去离子水中,得到UMFNPs-FAPI-04。将10 mg DOTA-NHS ester 加入至UMFNPs-FAPI-04溶液中,超声分散30 s后室温摇床24 h。反应结束后,重复上述洗涤方法后收集产物并溶于去离子水中于4 ℃保存。
1.2.2 纳米粒子的表征 使用傅里叶红外光谱仪(FTIR)测量纳米粒子的红外光谱。采用动态光散射(DLS)测量纳米粒子的水合动力学直径分布。使用透射电子显微镜(TEM)观察纳米粒子的样貌。通过电感耦合等离子体发射质谱仪(ICP-MS)测量Fe 和Mn 的浓度。用临床3T 核磁共振成像仪扫描不同浓度的纳米制品,并根据样品浓度及信号强度拟合出DOTA-UMFNPs-FAPI-04的弛豫率。
1.2.3 纳米粒子的细胞毒性检测 取1×105的PC3细胞悬液,接种于96 孔板,每孔100µL 培养液,每孔约5 000 个细胞。培养板放入培养箱24 h 后,移去原培养液,分为空白组、实验组和对照组。实验组分别加入含锰铁总浓度为(0、6.25、12.5、25、50、75)µg/mL 的探针培养液100µL,每组3个重复,于37 ℃培养箱培养24 h 后弃去培养液,每孔加入含10% CCK-8 的无血清培养液,培养箱培养1.5 h 后用酶联免疫检测仪检测各孔450 nm 的吸光度值。细胞活力=实验组吸光度值-空白组吸光度值/对照组吸光度值-空白组吸光度值×100%。
1.3 68Ga的标记反应
1.3.168Ga 的标记反应及纯化反应 取1 mL 的DOTA-UMFNPs-FAPI-04 溶液(0.1 mol/L),加入约70 MBq 的68GaCl3,用醋酸铵缓冲溶液(pH=6.5)调pH 至3 到4,在100 ℃下反应10 min。使用PD-10柱纯化反应物,将PD-10 柱用约25 mL 磷酸盐缓冲溶液(PBS,0.1 mol/L,pH=7.2)平衡后,加入反应混合物,使用PBS 淋洗并用ep 管收集洗脱液。利用薄层纸层析法(TLC)测定放化纯度。
1.3.2 标记物的放化纯测定 标记物的放化纯(RCP)采用薄层纸层析法(TLC)测定。将层析滤纸剪为长10 cm、宽1.5 cm 的长条形,取2 µL 反应液在层析滤纸的末端进行点样,使用柠檬酸钠(1.0 mol/L)作为展开体系,待上行展开距离为6 cm 后自然晾干,进行放射化学纯度测定。
1.3.3 标记物的体外稳定性 取标记物68Ga-DOTA-UMFNPs-FAPI-04 约5 MBq,置于0.4 mL 磷酸盐缓冲液中(pH=7.2)和0.4 mL胎牛血清中,于室温下放置0.5 h、1 h、2 h 后分别采用薄层纸层析法测定放化纯,观察其体外稳定性。
1.3.4 标记物脂水分配系数的测定 取约5 MBq的68Ga-DOTA-UMFNPs-FAPI-04,加入含0.5 mL的正辛醇和0.5 mL 磷酸盐缓冲溶液的碘化管中。分别取有机相和水相各100µL于碘化管中,用γ计数器测量其放射性计数,使用放射性计数比值来计算脂水分配系数LogP。
1.4 正常鼠体内分布
取活度约为3.7 MBq 的标记物68Ga-DOTAUMFNPs-FAPI-04,经尾静脉注射至9 只balb/c 正常小鼠体内,在注射后0.5 h、1 h、2 h 眼球取血,处死并进行解剖,取心、肝、脾、肺、肾、胃、大肠、小肠、脑、肌肉、股骨在γ计数器上测量其计数,并进行组织称重。经衰减校正后计算每克组织的百分注射剂量(%ID/g)。
1.5 荷瘤小鼠MRI显像
经荷瘤鼠尾静脉注射DOTA-UMFNPs-FAPI-04,注射剂量为5 mg(Fe+Mn)/kg,于给药后0.5 h 进行MRI显像。
1.6 统计学方法
采用SPSS 25.0 统计软件进行统计分析。计量资料服从正态分布且方差齐,以表示。两组之间比较采用两独立样本t检验,检验水准α=0.05。
2 结果
2.1 纳米粒子的表征
UMFNPs-DHCA 和DOTA-UMFNPs-FAPI-04的FTIR 谱如图2所示。曲线a在585 cm-1的吸收峰为Fe-O 的振动;曲线在1 037 cm-1和1 630 cm-1出现新的吸收峰,分别由于C-N 和C=O 的伸缩振动,可提示FAPI-04和DOTA的成功修饰。

图2 FTIR光谱图Fig.2 FTIR spectra
DOTA-UMFNPs-FAPI-04 的TEM 图像如图3所示。由图3 可知,DOTA-UMFNPs-FAPI-04 纳米粒子大小均匀,呈圆形或椭圆形,分散性良好。

图3 DOTA-UMFNPs-FAPI-04的TEM图Fig.3 TEM image of DOTA-UMFNPs-FAPI-04
UMFNPs-DHCA 和DOTA-UMFNPs-FAPI-04的DLS 测定结果如图4 所示。UMFNPs-DHCA 的平均水合动力学粒径约为12.2 nm,DOTA-UMFNPs-FAPI-04的平均水合粒径约为20.5 nm。

图4 UMFNPs-DHCA 和DOTA-UMFNPs-FAPI-04的水合动力学直径分布Fig.4 Hydrodynamic size distribution of UMFNPs-DHCA and DOTA-UMFNPs-FAPI-04
纳米粒子DOTA-UMFNPs-FAPI-04 的弛豫率测定结果如图5-6 所示。由图可知,当锰铁总浓度增加时,MRI 图像逐渐变暗,同时T2 值也随之下降。经拟合得到锰铁离子浓度与T2 信号强度(1/T2)之间的关系式为ŷ,ŷ=39.02x-4.256。另外,锰铁离子浓度与T1 信号强度(1/T1)之间的关系式为ŷ=2.704x+0.2080。关系式的斜率即为弛豫率,因此DOTA-UMFNPs-FAPI-04 的 T1弛豫率为2.704 mmol-1·s-1,T2 弛豫率为39.02 mmol-1·s-1,r2/r1比值为14.43。

图5 DOTA-UMFNPs-FAPI-04在不同锰铁浓度时T2权重MR的显像效果Fig.5 T2-weighted MRI scan of DOTA-UMFNPs-FAPI-04 at different ferromanganese concentrations
2.2 标记物的放化纯和体外稳定性
经纯化后,68Ga-DOTA-UMFNPs-FAPI-04 的放化纯度大于94%,可用于后续动物体内生物分布实验。
68Ga-DOTA-UMFNPs-FAPI-04 在PBS 和FBS的稳定性如图7所示。由图7可知,在室温孵育2 h后,放化纯大于80%,标记物的体外稳定性良好。

图7 68Ga-DOTA-UMFNPs-FAPI-04在PBS和FPS中的稳定性Fig.7 Stability of68Ga-DOTA-UMFNPs-FAPI-04 in PBS and FPS
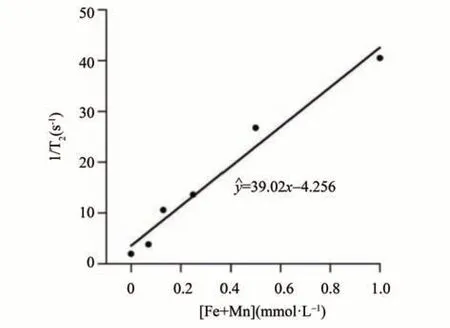
图6 MR图像获得的1/T2与锰铁浓度关系Fig.6 The relationship between 1/T2 and ferromanganese concentrations
2.3 纳米粒子的细胞毒性
经(0、6.25、12.5、25、50、75)µg/L的纳米颗粒处理后的细胞存活率分别为:(100±2.6)%,(96.75±2.26)%,(96.69±1.64)%,(94.24±1.67)%,(87.91±0.20)%,(87.68±2.38)%(n=3)。与对照组相比,经6.25µg/L的纳米颗粒处理后细胞存活率差异无统计学意义(t=2.855,P>0.05)。经12.5、25、50、75 µg/L 处理后的细胞存活率降低(P<0.05),但仍高于80%,故纳米颗粒对细胞无显著毒性。
2.4 脂水分配系数的测定
68Ga-DOTA-UMFNPs-FAPI-04 的脂水分配系数LogP值为-2.33,药物表现出较高的水溶性。
2.5 小鼠体内生物分布
68Ga-DOTA-UMFNPs-FAPI-04 在正常小鼠体内的生物分布结果如表1 所示。由表1 可知:在2 h,放射性标记物主要集中在肝脏(16.58±3.83)%ID/g、脾脏(10.7±2.57)%ID/g,其他器官对药物的摄取相对较低,表明该药主要分布于肝脏、脾脏,通过肝脾代谢;且三个时间点肾脏的放射性摄取均较低,说明此探针较少经肾脏代谢。另外探针在肺脏和骨骼的摄取值也较高,分别为(3.61±3.13)%ID/g和(4.46±0.18)%ID/g。
表1 68Ga-DOTA-UMFNPs-FAPI-04在正常小鼠的体内分布Table 1 Biodistribution of68Ga-DOTA-UMFNPs-FAPI-04 in normal mice [n=3,()]

表1 68Ga-DOTA-UMFNPs-FAPI-04在正常小鼠的体内分布Table 1 Biodistribution of68Ga-DOTA-UMFNPs-FAPI-04 in normal mice [n=3,()]
2.6 荷瘤鼠的MRI显像
荷PC3裸鼠给药0.5 h后的MRI T2加权图像示于图8。与注射前相比,注射DOTA-UMFNPs-FAPI-04 后,肿瘤部位信号减弱,信号降低约12.4%,图像变黑。说明DOTA-UMFNPs-FAPI-04 具有MRI成像能力。

图8 DOTA-UMFNPs-FAPI-04在小鼠的MRI T2加权图Fig.8 Imaging of MRI with DOTA-UMFNPs-FAPI-04
3 讨论
分子影像技术可以对肿瘤内特定分子进行特征性显像从而提高对肿瘤的诊断效能。目前已有多种分子影像技术(如分子超声、PET、MRI 等)用于肿瘤的诊断。多模态成像可以实现几种单一成像模式的优势互补,是分子影像的发展趋势[7]。磁性纳米探针为目前常用的分子探针之一,由于其可修饰其他模态显像小分子及相关靶向分子,已被用于进行多模态显像研究。
成纤维细胞激活蛋白(fibroblast activation protein,FAP)是一种跨膜的II 型丝氨酸蛋白酶,由癌症相关成纤维细胞(cancer associated fibroblasts,CAFs)表达,而癌症相关成纤维细胞(cancer associated fibroblasts,CAFs)是肿瘤反应性间质中主要的细胞类型,它在肿瘤生长、侵袭和迁移中起着重要的作用[8]。FAP 在90%的上皮肿瘤中过度表达,在正常组织中几乎不表达,因此核素标记的FAP抑制剂—成纤维细胞激活蛋白抑制剂(fibroblast activation protein inhibitor,FAPI)在多种肿瘤中均有不错的显像效果[9]。但FAPI-PET 对于前列腺癌,尤其是PSMA 表达阴性的前列腺癌显像研究尚显不足[10]。故本研究合成一种基于FAPI 的PET/MRI 双模态分子探针,为PSMA 表达阴性的前列腺肿瘤提供新的影像监测手段
本研究用螯合剂DOTA 和靶向分子FAPI 修饰MRI 对比剂锰铁氧体纳米颗粒,并用正电子核素68Ga 标记颗粒,制成双模态分子探针68Ga-DOTA-UMFNPs-FAPI-04。UMFNPs-DHCA 和DOTA-UMFNPs-FAPI-04 的水合粒径分别为(12.23±4.41)nm 和(20.52±2.28)nm,表明了DOTA 和FAPI的偶联成功,红外光谱也证实DOTA 和FAPI 的成功修饰。DOTA-UMFNPs-FAPI-04 的弛豫率测试结果显示其T1 弛豫率为2.704 mmol-1·s-1,T2 弛豫率为39.02 mmol-1·s-1,r2/r1比值为14.43,具有T2弛豫效能。铁氧体纳米颗粒由于具有超顺磁性,一般为T2 造影剂,而锰的掺杂会提高纳米颗粒的T1 弛豫率[11]。另外,氧化铁纳米颗粒的尺寸会影响纳米颗粒的磁性。铁氧体纳米颗粒尺寸小于5 nm 时,T1 对比效应会增强[12]。当纳米尺寸增大,T1 对比效应会减弱而T2 对比效应会增强。本研究中锰掺杂的铁氧体纳米颗粒表现出不错的T1 性能和较好的T2 性能,考虑到颗粒经过表面修饰后,颗粒尺寸变大,同时颗粒有部分团聚,减弱了锰掺杂对T1 的增强作用,因此纳米探针表现MRI T2 造影剂性能。体外毒性实验显示DOTA-UMFNPs-FAPI-04 在75µg/mL 的浓度下对细胞无明显毒性,证明了其具有良好的生物安全性。随后对DOTA-UMFNPs-FAPI-04进行核素68Ga标记,并检测其水脂溶性、放射化学纯度和体外稳定性。结果显示标记产物68Ga-DOTA-UMFNPs-FAPI-04 具有较高的放化纯度和较好的体外稳定性,标记物呈水溶性,可延长其在体内的循环,有利于标记物与靶点的结合。正常小鼠体内分布结果显示纳米探针大部分由肝脏和脾脏摄取,同时肺脏和骨骼也有一定程度的摄取。纳米颗粒主要由网状内皮系统吞噬,体内的网状内皮系统包括肝脏、脾脏、肺、骨骼等。当纳米直径在10~100 nm 时,主要由肝脾摄取[13]。以上结果均表明68Ga-DOTA-UMFNPs-FAPI-04 具有PET 成像潜力。实验细胞选用PSMA 低表达的前列腺癌PC3细胞并制作荷瘤鼠模型。经荷瘤鼠尾静脉注射DOTA-UMFNPs-FAPI-04后,可以观察到肿瘤信号降低,负对比增强,表明DOTA-UMFNPs-FAPI-04具有MRI成像能力。作为PET/MRI双模态显像剂,68Ga-DOTA-UMFNPs-FAPI-04 在本研究中还存在不足,如进一步提高标记物放射化学纯度,改善其稳定性,缺少荷瘤鼠PET成像研究等。后续工作将围绕这些问题展开。

