降解核苷作用乳酸菌的筛选及其潜在降尿酸功能
王家彬,潘 力
(华南理工大学生物科学与工程学院,广东省发酵与酶工程重点实验室,广东 广州 510006)
肠道微生物主要指定植于肠道内的微生物菌群,其数量与人类细胞的数量相似。利用人类粪便样品的微生物测序和动物模型中的肠道微生物移植,肠道微生物群与人类健康和疾病的关系开始被众人所知。乳酸菌是一类可将糖类发酵转化成乳酸的革兰氏阳性菌,作为人体肠道内的正常菌群一员,可以很容易地作为天然功能性食品纳入基本饮食,因此也被越来越多地用于食品及医药领域的产品开发,而且它们已被证明能够有效地改善胃肠健康和某些代谢综合征,包括糖尿病和精神类疾病等。
高尿酸血症是临床上最常见也是危害最大的慢性疾病之一,其典型特征是尿酸形成增加或尿酸排泄减少。血液中尿酸含量的升高会增加患痛风和心血管疾病、糖尿病、肥胖和慢性肾脏病的风险。此外,高尿酸血症也可能影响肠道微生物体内平衡和肠道上皮完整性。治疗高尿酸血症的关键是降低尿酸浓度。现行治疗手段除以药物治疗之外,一般都要辅以严格的饮食控制,尽可能减少外源性嘌呤类物质摄入。在临床常用的治疗高尿酸血症药物主要包括别嘌呤醇(黄嘌呤氧化酶抑制剂)和苯溴马隆(抑制肾尿酸盐的重吸收)。由于本病发病机制复杂,并且服药的同时还需严格控制饮食,患者治疗依从性不髙。因此,如何利用乳酸菌参与高尿酸血症的预防和治疗成为当前的热点之一。已有研究表明,某些乳酸菌可以通过降解或者吸收核苷竞争性减少肠道上皮对核苷的吸收,从而减少尿酸的生成。金方等研究发现干酪乳杆菌ZM15能够在体外降解核苷酸与核苷,同时在体内可能通过与肠道上皮细胞竞争吸收相应核苷酸与核苷,使模型大鼠的血尿酸水平显著降低。由于尿酸在产生过程中,其前体物质依次为黄嘌呤、次黄嘌呤、肌苷/鸟苷、核苷酸等,其含量均与最终血液中的尿酸含量有关。有研究表明,乳酸菌无法降解尿酸和嘌呤类物质(黄嘌呤、鸟嘌呤和次黄嘌呤),而核苷摄取是嘌呤和嘧啶进入肠上皮细胞的主要途径,因而提前降解核苷便是乳酸菌调节血尿酸的主要作用方式。目前有一些研究人员通过这种原理筛选降尿酸的菌株,本研究选用相同的原理筛选潜在降尿酸的菌株。有研究表明乳杆菌DM9218可以治疗高果糖诱导的肠道失调的小鼠,检测到DM9218能够降低果糖喂养小鼠的血清尿酸水平和黄嘌呤氧化酶活性,起到了治疗作用。然而,目前关于乳酸菌调节尿酸的研究还相对较少,乳酸菌在高尿酸血症中的应用前景还没有得到广泛探索。因此,寻找高效的天然降尿酸乳酸菌,丰富国内降尿酸乳酸菌的菌种库,成为当前重要的任务。
本研究首先以国内外的特色食源性物质为来源,通过传统分离方法和分子生物学鉴定方法(16S rDNA序列分析法)相结合,分离筛选乳酸菌株。之后采用高效液相色谱(high performance liquid chromatography,HPLC)法体外评价收集得到的乳酸菌株对肌苷和鸟苷的降解作用,从而筛选具有潜在降尿酸能力的菌株。然后,通过在体外建立黄嘌呤氧化酶筛选模型评价菌株的黄嘌呤氧化酶抑制能力,最终筛选到1 株同时具有高效核苷降解和黄嘌呤氧化酶抑制能力的菌株。本实验旨在丰富我国在降血尿酸乳酸菌的菌种库,为乳酸菌制剂及其功能性产品的研究提供基础数据,同时也为开发预防和治疗高尿酸血症药物提供理论基础和菌种资源。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
样品为采集自国内外不同地区的特色食源性物质,包括菌种类产品(喜他康、SWASON)、自制泡菜、贵州白酸汤和国内酸奶(简爱、香满楼)。
1.1.2 试剂
革兰氏染色试剂 广州环凯生物科技有限公司;DreamGreen PCR Master Mix 诺唯赞生物科技有限公司;细菌基因组DNA提取试剂盒 上海捷瑞生物工程有限公司;引物由天一辉远(广州)基因科技有限公司合成;肌苷、鸟苷、别嘌呤醇、别嘌呤醇、NaClO、HPO、KPO、HClO(HPLC级) 上海阿拉丁生化科技股份有限公司;黄嘌呤、黄嘌呤氧化酶 上海源叶生物科技有限公司;其他试剂均为国产或进口分析纯。
1.1.3 培养基与溶液
MRS(Man Rogosa Sharpe)培养基:葡萄糖20 g/L、吐温80 1.08 g/L、MnSO·4HO 0.05 g/L、MgSO·7HO 0.2 g/L、无水乙酸钠5 g/L、柠檬酸三铵2 g/L、酪蛋白10 g/L、牛肉提取物10 g/L、酵母提取物4 g/L、KHPO2 g/L(pH 5.7±0.2)。固体培养基含1.5%琼脂。所有材料在使用前121 ℃灭菌20 min。
HPLC流动相:称取0.122 5 g NaClO,加入1 000 mL容量瓶中并以超纯水定容,振荡混匀。吸取100 μL高氯酸钠溶液,加入预先盛有200 mL超纯水的HPLC流动相储存瓶中,另取10 mL HPO(色谱级),缓缓加入HPLC流动相储存瓶中,充分振荡,补足至1 000 mL,在摇床内以180 r/min振荡混匀10 min。最终流动相组成为0.1 μmol/L NaClO-0.187 mol/L HPO-dd HO。
黄嘌呤氧化酶液的制备:将黄嘌呤氧化酶(100 U)用0.2 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.5)溶解为0.5 U/mL,置于4 ℃保存。
黄嘌呤底物的制备:底物黄嘌呤先用少量0.1 mol/L NaOH溶液超声溶解,再用0.2 mol/L PBS(pH 7.5)定容成2 mmol/L黄嘌呤底物溶液。
1.2 仪器与设备
Veriti 96-Well Thermal Cycler梯度聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Applied Biosystems公司;光学显微镜 德国ZEISS公司;移液枪、高速离心机 德国Eppendorf公司;浸入式水平电泳系统 美国Bio-Rad公司;NanoDrop 1000紫外-可见分光光度计 美国Thermo Fisher Scientific公司;M200多功能酶标仪 德国Tecan公司;1220 Infinity HPLC装置 美国Agilent公司;Athena C-WP色谱柱(250 mm×4.6 mm,5 μm) 德国CNW公司。
1.3 方法
1.3.1 乳酸菌株的分离纯化
1.3.1.1 乳酸菌株的初筛
取出之前保存在4 ℃冰箱中的样品,在超净台中加入0.1 g菌粉类样品到含有1 mL无菌生理盐水的EP管中,使其完全溶解,其他含有溶液的样品(如泡菜)则直接用移液器吸取1 mL样品于干净的EP管中,用0.85%生理盐水进行梯度稀释(10~10),每个梯度做3 次平行实验。待不同浓度梯度的稀释液中样品完全溶解均匀后,按稀释浓度从低到高的顺序各取300 μL稀释液分别接入MRS固体培养基中,并用无菌涂布器均匀涂开。待其吸收后放置到37 ℃恒温培养箱中进行厌氧培养,时间为2 d。取培养后平板上的单一菌落进行划线分离,一般重复此分离纯化步骤2~3 次,即可获得形态一致的纯化单一菌落。
1.3.1.2 乳酸菌株的复筛
挑取上一步具有典型乳酸菌细胞形态的单菌落进行革兰氏染色实验,并在光学显微镜的油镜下观察其颜色变化及形态特征,进一步判断是否为乳酸菌株(乳酸菌均为革兰氏阳性菌株)。
1.3.2 乳酸菌株的鉴定
1.3.2.1 细菌基因组DNA提取
将保藏菌株分别接种于MRS肉汤培养基中,在厌氧环境中37 ℃培养18 h得到菌液。对其中的细菌按试剂盒法进行DNA的提取。之后每个样品取2 μL用超微量分光光度计NanoDrop1000测定浓度,测定后将DNA保存在4 ℃,以备后用。
1.3.2.2 PCR扩增及16S rDNA测序
PCR扩增模板及引物依次为实验获得乳酸菌基因组DNA及通用引物模板,如表1所示。

表1 引物序列Table 1 List of primers used in this study
配制总体积为50 μL的PCR扩增体系。分别加入25 μL DreamGreen Mix、各0.5μL的引物27F和1492R、2 μL的DNA模板和22 μL ddHO。每个片段按上述体系扩增两管。PCR结束之后,将最终得到的PCR扩增产物送至天一辉远(广州)基因科技有限公司进行测序,通过测定16S rDNA的序列进行菌种鉴定。测序完成后将获得的序列结果在NCBI进行BLAST比对,从而确定菌株种属。
1.3.3 乳酸菌株对核苷体外同化能力的评价
1.3.3.1 核苷标准曲线的制作
采用HPLC系统同时检测肌苷和鸟苷。将33.7 mg肌苷和35.7 mg鸟苷溶解在100 mL 100 mmol/L KPO溶液(以HPO调至pH 7.0)中制成肌苷-鸟苷溶液。0.22 μm水系滤膜过滤后,将5、8、11、14、17 μL和20 μL肌苷-鸟苷溶液分别注入配有紫外波长检测器和色谱柱的HPLC装置。流速1 mL/min,设定时间40 min。在254 nm波长处测定肌苷和鸟苷的含量,并用标准曲线插值法进行定量。
1.3.3.2 乳酸菌株对核苷降解能力的测定
为了评价乳酸菌株对肌苷和鸟苷的降解能力,将保藏菌株按照3%的量接种到MRS肉汤培养基中,在37 ℃厌氧条件下活化2 代进行后续实验。之后取乳酸菌培养液2 mL,4 ℃、6 000 r/min离心10 min。然后用1 mL 0.85% NaCl溶液洗涤2 次,调整菌悬液浓度为1×10CFU/mL。再用750 μL肌苷-鸟苷溶液悬浮,37 ℃、120 r/min孵育60 min。之后将溶液4 000×、4 ℃离心10 min。取上清液270 μL。在上清液中加入30 μL 0.1 mol/L HClO溶液,充分混合以防止进一步降解。过滤后将20 μL的混合物注入HPLC装置,设定时间40 min。按上述得到的核苷标准曲线计算剩余肌苷和鸟苷含量。根据下式计算不同菌株对肌苷或鸟苷的降解速率和降解率:

式中:为降解速率/(g/(L·min));为肌苷或鸟苷残留量/(g/L);为肌苷或鸟苷质量浓度/(g/L);为核苷降解率/%。
1.3.4 胞内物和胞外物对肌苷和鸟苷的降解作用
为了阐明核苷被降解的物质基础,对菌株的胞外分泌物和胞内物进行了提取,并通过上述方法测定它们对肌苷和鸟苷的降解情况。将乳酸菌株以3%的接种量到MRS肉汤培养基中,在37 ℃厌氧条件下进行2 次传代培养,取2 mL培养液4 ℃、5 000 r/min离心10 min,收集菌体沉淀。1 mL生理盐水洗涤菌体3 次,收集实验菌体并调整菌体浓度为1×10CFU/mL。悬浮于1 mL肌苷-鸟苷缓冲液,37 ℃放置8 h后4 ℃、6 000 r/min离心10 min,取450 μL上清液(胞外分泌物)与450 μL肌苷-鸟苷缓冲液,37 ℃培养60 min后加入100 μL终止剂高氯酸,取20 μL混合液经过无菌滤膜过滤用于HPLC分析。菌体沉淀重悬于1 mL生理盐水,超声波破碎(200 W,工作时间5 s,停顿5 s)5 min后4 ℃、12 000 r/min离心10 min,取450 μL上清液(胞内物)与450 μL肌苷-鸟苷缓冲液混合,37 ℃培养60 min后加入100 μL终止剂高氯酸,0.22 μm滤膜过滤后,取20 μL混合液用于HPLC分析。
1.3.5 高效降解核苷菌株对黄嘌呤氧化酶体外抑制能力的评价
对黄嘌呤氧化酶的抑制能力评价方法参考Umamahesari等方法并稍作改动。取0.75 mL黄嘌呤底物溶液,0.75 mL提取液混匀,最后加入0.5 mL预先在25 ℃保温20 min的黄嘌呤氧化酶液(0.5 U/mL)启动反应,在波长295 nm的紫外条件下记录反应时间内(0~42 min,每隔6 min记录一次实验数据)的吸光度变化。对照样中把黄嘌呤氧化酶液用PBS替换。黄嘌呤氧化酶的活性用黄嘌呤氧化酶的抑制率表达。由于黄嘌呤在295 nm波长处有吸光度,所以需扣除不加样品和酶的吸光度。每个样品做3 次平行实验。用酶标仪检测波长为295 nm的反应液。以别嘌呤醇为阳性对照,黄嘌呤氧化酶抑制率按式(3)计算:
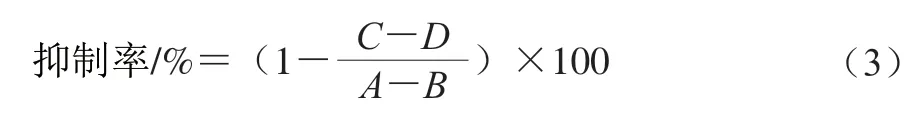
式中:为含有黄嘌呤氧化酶不含样品的吸光度;为不含黄嘌呤氧化酶和样品的吸光度;为含有黄嘌呤氧化酶和样品的吸光度;为含有样品但不含黄嘌呤氧化酶的吸光度。
1.4 统计分析
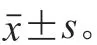
2 结果与分析
2.1 乳酸菌株的分离筛选
用无菌的生理盐水溶液对不同的特色食源性物质进行梯度稀释,每个稀释度做3 次平行实验,随后取稀释样品300 μL在MRS固体培养基上涂板后进行扩增培养。经过多次分离纯化后,最终筛选得到22 株疑似乳酸菌株,其在MRS平板上的菌落形态如图1所示。大多数菌株中间凸起呈半透明,表面上是光滑的点状菌落,边缘规则且无褶皱;另外少部分菌落表面相对暗淡粗糙,中间斑点呈乳黄色,边缘不规则。
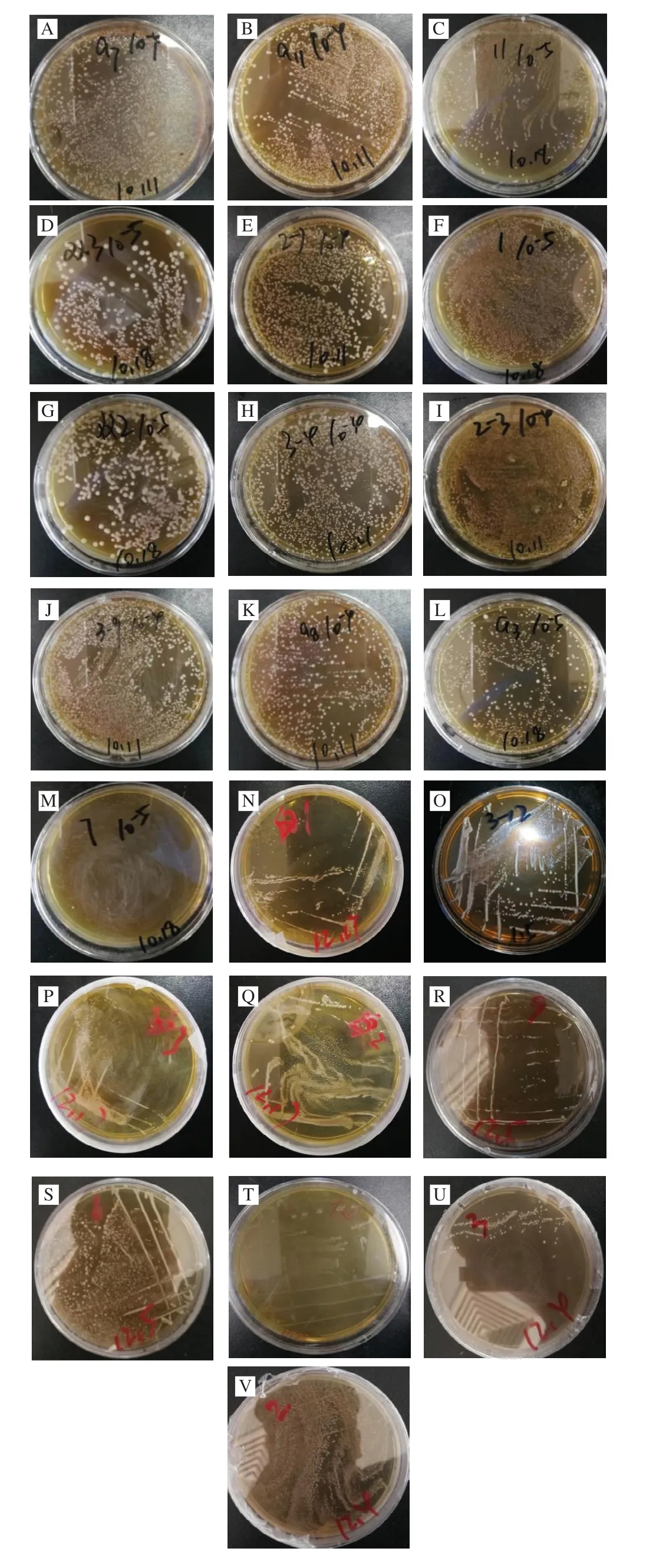
图1 乳酸菌菌落形态鉴定Fig.1 Colony morphology of lactic acid bacterial strains
进一步的镜检结果如图2所示,收集得到的22 株菌在革兰氏染色试剂的作用下均呈紫蓝色,表明为革兰氏阳性菌。镜检视野内菌落形态均一,在细胞形态上分别呈现为杆状(有长有短)、圆状(椭圆状),排列形态为单个排列或呈链条状排列。结合菌落平板形态结构观察,初步判断为乳酸菌。
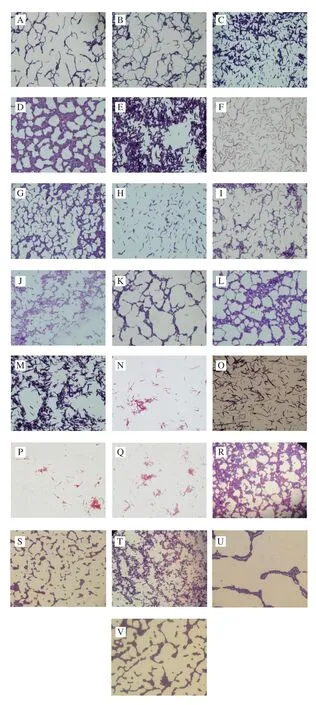
图2 菌株革兰氏染色镜检结果Fig.2 Gram staining microscopic examination of strains
2.2 乳酸菌株的鉴定
以细菌基因组总DNA为模板,对收集到的22 株乳酸菌株的16S rDNA进行PCR扩增,最终获得1 500 bp左右的PCR产物,送至天一辉远(广州)基因科技有限公司进行测序。将得到的各菌株16S rDNA测序结果在NCBI上进行BLAST比对,以确定菌株类型和种属关系,进而对菌种间、菌属间的差异性予以判断,实现细菌分类。BLAST的比对结果如表2所示。
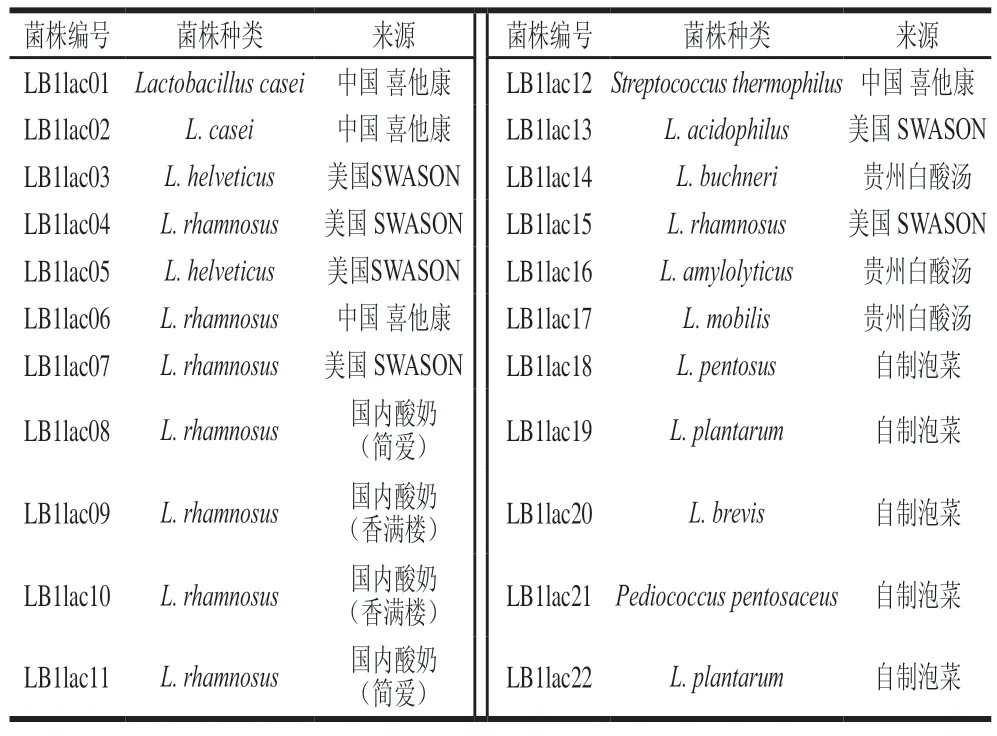
表2 乳酸菌鉴定结果比对Table 2 Comparison of results of lactic acid bacterial identification
至此,本实验中分离得到的22 株乳酸菌株可分类为:8 株鼠李糖乳杆菌()、2 株干酪乳杆菌()、2 株瑞士乳杆菌()、2 株植物乳杆菌()、1 株嗜酸乳杆菌()、1 株嗜热链球菌()、1 株活动乳杆菌()、1 株布氏乳杆菌()、1 株短乳杆菌()、1 株戊糖乳杆菌()、1 株戊糖乳球菌()、1 株解淀粉乳酸杆菌()。
2.3 酸菌株对核苷体外同化能力的评价
通过实验结果可知,肌苷在本色谱条件下保留时间为24.379 min,鸟苷保留时间为35.105 min。标准曲线分别为=45 571+14.802(=1)、=47 022-122.09(=0.999 8)。其中为峰面积,为质量浓度(g/L)。
乳酸菌对肌苷和鸟苷的体外同化能力实验结果如表3、4所示。结果发现20 株供试乳酸菌均具有一定的核苷分解能力。但大部分供试菌株对肌苷与鸟苷降解速率均小于2×10g/(L·min)。效果最好的菌株为LB1lac20,对肌苷的降解速率为0.004 6 g/(L·min),降解率为91.19%;对鸟苷的降解速率为0.004 8 g/(L·min),降解率为89.67%。与本实验其他菌株相比,对肌苷和鸟苷的降解能力显著。同时可以发现,菌株对肌苷和鸟苷同化能力之间存在很强的正相关关系,可能是由于鸟苷和肌苷属于同一类物质,可由同一酶催化降解。这表明在所测试的菌株中可能存在核苷水解酶。本实验结果与Tsuboi等的研究结论基本一致。在具体菌株对核苷的分解速率上,本实验筛选出的优选菌株LB1lac20远超杨殿斌等筛选出的其他菌株,仅次于植物乳杆菌DM9218。考虑到反应条件及菌种类型的不同,本研究筛选得到的LB1lac20依旧具有很高的研究价值。与麻菊美等的研究结果相比,LB1lac20对肌苷的降解率高于其筛选出的最高效菌株5-1,但鸟苷的降解率低于此菌株(89.37%)。
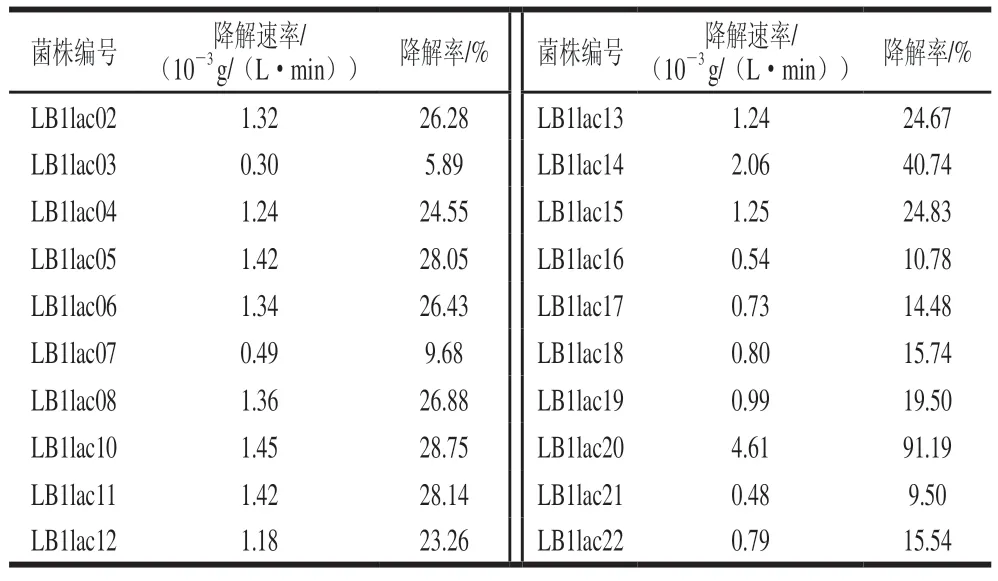
表3 不同乳酸菌对肌苷的体外降解情况Table 3 In vitro degradation rates of inosine by different lactic acid bacteria
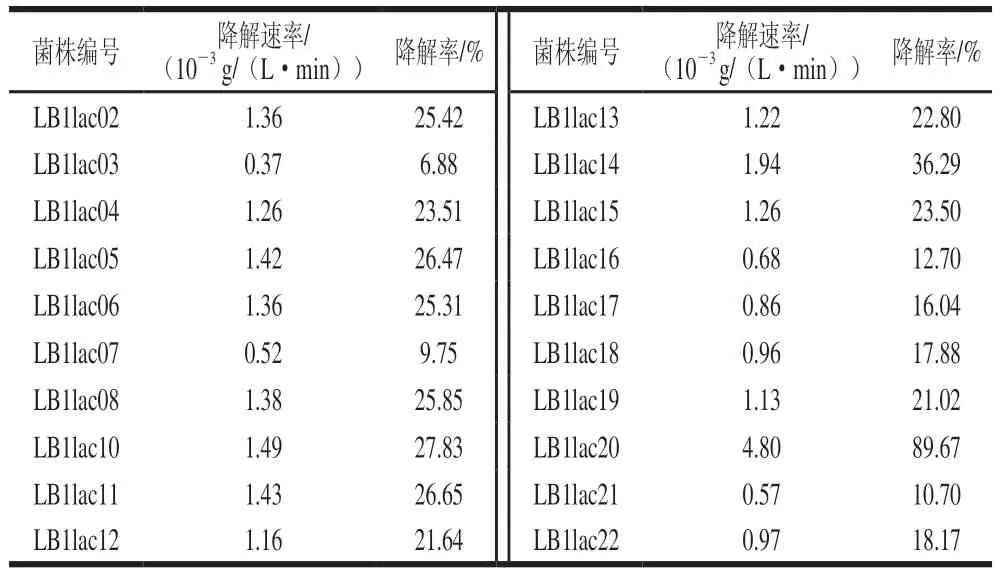
表4 不同乳酸菌对鸟苷的体外降解情况Table 4 In vitro degradation rates of guanosine by different lactic acid bacteria
此外,作为泡菜来源的LB1lac20,具有价格低廉、无药物毒副作用等优势,虽然效果不及合成药物,但是具有安全性和高效性并存的特点,并且可以作为日常饮食参与,患者依从度高。而泡菜是蔬菜利用乳酸菌发酵而成的低盐发酵食品,因其独特的生化特点、营养和感官特性也被大众广泛接受。而已有研究表明,泡菜具有抗氧化,抑菌,抗动脉粥样硬化等功效,开发具有益生功能的乳酸菌制剂也是当前泡菜中乳酸菌的一大研究趋势。综合考虑菌株对肌苷及鸟苷的分解率及其天然优势,选择分解两种核苷速率均为最佳的菌株LB1lac20作为候选菌株进行下一阶段实验。
2.4 胞内物和胞外物对肌苷和鸟苷的降解作用
对比不加LB1lac20的对照组(图3A),本实验菌株LB1lac20胞外物(图3C)不能起到降解作用,而胞内物(图3D)在60 min的反应时间内对核苷有明显的降解作用,对肌苷和鸟苷的降解率分别可以达到55.87%和32.26%。此实验结果说明本实验菌株LB1lac20的胞外产物不能降解肌苷和鸟苷,甚至一些生命活动不需要的肌苷和鸟苷会被排出胞外,造成肌苷和鸟苷的含量增加。而胞内提取物可以起到降解肌苷和鸟苷的作用,但效果会低于同等时间内菌悬液(图3B)的降解率。本实验的结果明确显示乳酸菌对核苷酸与核苷的降解作用是胞内完成,这也与金方等得出的结论一致。此外,之前有研究表明,DM9505可以通过其编码的肌苷水解酶,降解果糖代谢中间产物肌苷和间接对小鼠肠道菌群的调节等多种机制共同作用减少尿酸的生成,本实验结果进一步证实可能是胞内的核苷水解酶系在发挥作用。核苷水解酶破坏核苷的糖苷键,释放含氮碱和戊糖。核苷摄取是嘌呤和嘧啶进入肠上皮细胞的主要途径,某些乳酸菌可以通过降解或者吸收核苷竞争性减少肠道上皮对核苷的吸收,从而减少尿酸的生成。这些核苷酶广泛存在于植物和微生物中,但尚未在哺乳动物中检测到。
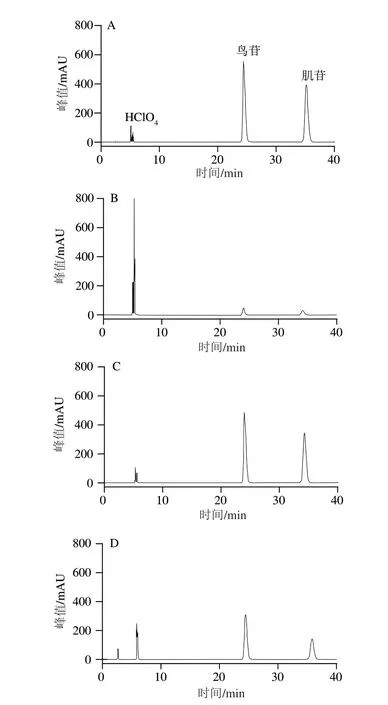
图3 LB1lac20对肌苷和鸟苷的降解Fig.3 Chromatograms showing LB1lac20 degradation of inosine and guanosine
2.5 高效降解核苷菌株对黄嘌呤氧化酶体外抑制能力的评价
为评价LB1lac20作为黄嘌呤氧化酶抑制剂的能力,利用尿酸生成法建立体外筛选模型。在反应体系中,黄嘌呤氧化酶催化黄嘌呤底物生成尿酸和超氧阴离子,而尿酸在295 nm紫外条件下有特征吸收峰,利用紫外分光光度法通过测定一定时间内吸光度的变化,即尿酸生成量,衡量黄嘌呤氧化酶的活性变化。同时使用别嘌呤醇作为本实验的阳性对照。别嘌呤醇主要通过抑制黄嘌呤氧化酶的活性进而达到抑制尿酸生成的目的,它可以和黄嘌呤氧化酶的活性中心结合生成别嘌呤二醇(又称氧嘌呤醇),别嘌呤二醇和黄嘌呤氧化酶结合形成不具有催化作用的复合体,即达到了抑制黄嘌呤氧化酶活性的作用。LB1lac20作为黄嘌呤氧化酶抑制剂的效果如图4所示。
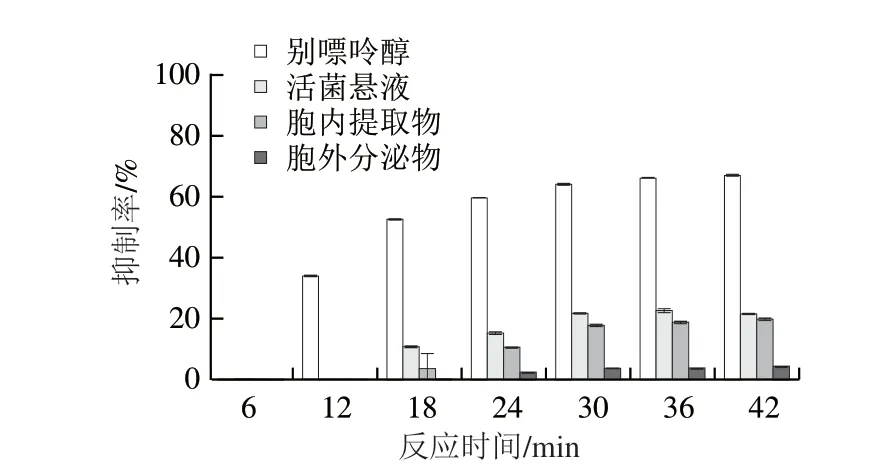
图4 黄嘌呤氧化酶体外抑制能力的评价结果Fig.4 In vitro xanthine oxidase-inhibitory capacity of LB1lac20
当黄嘌呤氧化酶浓度为0.5 U/mL时,比较其在不同反应时间(6~42 min)下的抑制能力。结果表明,在12 min别嘌呤醇(0.2 mg/mL)最先对黄嘌呤氧化酶起到抑制作用,对黄嘌呤氧化酶的敏感度高于LB1lac20菌悬液、胞内物和胞外物。在18 min活菌悬液和其胞内提取物也开始黄嘌呤氧化酶产生抑制作用。胞外分泌物在24 min开始对黄嘌呤氧化酶产生了微弱的抑制作用。在12~42 min的反应时间内,别嘌呤醇、活菌悬液、胞内提取物和胞外分泌物的抑制率均随着反应时间的延长而逐渐增加,之后则基本达到平稳状态。最终当反应时间达到42 min,别嘌呤醇(0.2 mg/mL)、活菌悬液、胞内提取物和胞外分泌物最终对黄嘌呤氧化酶的抑制率分别达66.61%、21.27%、19.60%和3.90%。结果表明此菌株的活菌悬液和胞内提取物显示出良好的黄嘌呤氧化酶抑制活性,进一步证实此菌株具有很大的降尿酸潜力。此外,LB1lac20菌悬液及其胞内提取物对黄嘌呤氧化酶的抑制能力较为接近,并且远高过其胞外分泌物,其黄嘌呤抑制能力可能主要来源于胞内。总之,通过建立尿酸生成法建立体外筛选模型,LB1lac20被证明具有一定的黄嘌呤氧化酶抑制能力,未来可以作为黄嘌呤氧化酶抑制剂参入到日常饮食中,并用于高尿酸血症的预防和治疗,具有很大的应用前景和价值。
3 结论
高尿酸血症是目前危害人类健康最为常见的代谢综合征之一,治疗关键为降低血尿酸浓度。降解核苷是乳酸菌降低尿酸含量的主要方式,本研究也选用相同原理筛选具有潜在降尿酸能力的菌株。此外,黄嘌呤氧化酶是嘌呤分解代谢过程中的一种关键性的酶,它可以催化次黄嘌呤和黄嘌呤直接生成尿酸。因此当体内黄嘌呤氧化酶活性异常活跃时,则会导致大量尿酸的生成,从而引发高尿酸血症。因而,黄嘌呤氧化酶抑制剂也是当前研究降尿酸药物的一个重要靶点。
本实验以国内外特色食源性物质为来源,利用常规的菌种分离方法(梯度稀释法、涂布培养法等)和现代的分子生物学方法(16S rDNA序列比对法)分离鉴定乳酸菌株。然后借助HPLC法分别鉴定了20 株收集得到的乳酸菌株其体外降解肌苷和鸟苷的能力,成功筛选出1 株具有高效体外降核苷活性的优势菌株LB1lac20。此菌种分离自国产泡菜,对肌苷和鸟苷的降解率均达到90%以上,是一株很有潜力的降尿酸乳酸菌株。因此本实验选择LB1lac20作为后续研究菌株。在此基础上对该菌株的胞内物和胞外物进行提取,并再次借助HPLC法对其胞内物和胞外物对肌苷和鸟苷的降解能力进行评价。证实其高效的核苷降解能力主要是由于胞内物的作用产生。为了进一步分析菌株LB1lac20的潜在降尿酸作用,利用尿酸生成法对尿酸生产过程中的关键酶(黄嘌呤氧化酶)进行体外抑制能力测定,并用临床药物别嘌呤醇作为阳性对照,分析菌株LB1lac20对黄嘌呤氧化酶的抑制作用效果。结果表明此菌株的菌悬液和胞内提取物均具有良好的黄嘌呤氧化酶抑制能力。综上,本研究发现的LB1lac20是1 株很有潜力的降尿酸乳酸菌株,未来可参与到高尿酸血症的预防和治疗中,具有很大的应用价值。后续可以进一步研究其在细胞和动物实验中的功效,以得到更直接准确地调控尿酸能力。

