抗冻蛋白对冷冻虾夷扇贝闭壳肌持水性及质构特性的影响
史羽瑶,郑 尧,王红丽,邱泽慧,王锡昌
(上海海洋大学食品学院,上海 201306)
虾夷扇贝()是海水养殖双壳贝类,是亚洲国家最重要的水产养殖品种之一,广泛分布于俄罗斯群岛、日本北海道和本州岛及中国渤海湾附近,具有个体大、生长快、营养价值高等特点,深受国内外消费者的欢迎。据《中国渔业统计年鉴》,2012—2019年我国扇贝产量基本呈逐年递增趋势,2019年扇贝总产量达182.81万 t,占海水养殖贝类总产量的12.70%。虾夷扇贝采捕后主要为活品或以闭壳肌为主的加工品(冻品、干制品等)形式流通。活品的经济价值最高,但存在品质极易劣化、货架期短等弊端。冷冻通过抑制微生物生长繁殖和酶促反应延长产品货架期,并在解冻后最大程度保持产品的原有特性。然而,长期冻藏会不可避免引起冰晶生长、蛋白变性及脂质氧化等,最终影响消费者的感官体验及商品价值。冰晶的生长会对肌纤维造成不可逆的机械损伤,并间接诱导蛋白质变性、脂质氧化,是导致冻藏水产品持水性下降、质构变差的根本原因。
抗冻剂具有降低冰点、抑制冰晶生长、延长冻品货架期的作用,在水产品中添加抗冻剂是一种有效的冻前品质调控方式。常见的抗冻剂有磷酸盐类、糖类和蛋白及其衍生物类。磷酸盐可以提高冻品的持水力,但同时促进了肌动球蛋白解离,加快肌原纤维结构的破坏。且过量磷酸盐会使冻虾质地黏稠,呈半透明状,影响其口感和滋味。海藻糖可以取代蛋白质分子表面的结合水并与之结合,从而抑制蛋白变性;但海藻糖是一种穿透性低温保护剂,会穿透细胞质,导致核膜收缩,且能量过高,不适于糖尿病患者等人群食用。与普通抗冻剂不同,抗冻蛋白作为最典型的冰活性阻冰剂,是生物为适应极端寒冷环境、保护生物体免受冷冻损害的特异性糖肽或多肽。抗冻蛋白具备2 大特性:1)热滞活性:它能够以非依数的形式降低溶液冰点而不改变其熔点,从而导致溶液的熔点与冰点之间出现差值;2)抑制冰晶生长:抗冻蛋白可通过氢键吸附于冰晶表面并积聚在冰-水界面处,利用Kelvin效应抑制胚胎冰晶的形成、生长以及重结晶。抗冻蛋白可以有效降低冻藏过程中冰晶对细胞和组织的损害,即使在低质量浓度下(如0.1 g/100 mL或更低)也有效。与传统商业抗冻剂相比,抗冻蛋白具有更好的冻藏稳定性,在水产品冷链流通过程中有广泛应用前景。但由于其不易分离纯化且分子质量较大,目前针对抗冻蛋白的实用性研究相对较少。
本研究旨在利用真空浸渍的方式将抗冻蛋白添加到虾夷扇贝闭壳肌中,并与焦磷酸钠、海藻糖两种传统抗冻剂作对比,探究抗冻蛋白相较于传统抗冻剂对冷冻虾夷扇贝闭壳肌持水性及质构特性的影响及其机制,以期为冷冻水产品的品质调控提供一定参考。
1 材料与方法
1.1 材料与试剂
虾夷扇贝由大连獐子岛股份有限公司提供,质量(149.14±18.33)g,闭壳肌净质量(17.36±4.01)g。将鲜活虾夷扇贝捕捞上岸后,在4 ℃条件下24 h内汽车运输至上海宝山区江阳市场,再经2 h冰藏运回上海海洋大学实验室。快速去除腮、内脏、性腺及外套膜,取出闭壳肌。
抗冻蛋白(纯度大于95%,分子质量52 kDa,热滞值约1.5 ℃) 南京安飞生物有限公司;焦磷酸钠、氯化钠、海藻糖、戊二醛固定液、叔丁醇 上海麦克林生化科技有限公司;戴维森固定液、无水乙醇、OCT包埋剂、伊红染液 北京索莱宝科技有限公司;其他生化试剂均为国产分析纯。
1.2 仪器与设备
DW-40L508超低温冰箱 艾本德(上海)国际贸易有限公司;TA.XT Plus质构仪 英国SMS公司;GM-0.33A隔膜真空泵 天津津腾仪器有限公司;H2050R高速冷冻离心机 长沙湘仪检测设备有限公司;CR-400型色差计 日本Knoica Minotla Sensing公司;FJ200-SH型数显高速分散均质机 上海标本模型厂;BT-224S电子分析天平 赛多利斯科学仪器(北京)有限公司;Eclipse E100正置光学显微镜 日本Nikon公司;MesoMR23-060H-1型低场核磁共振仪 上海纽迈电子科技有限公司;SU5000热场发射扫描电子显微镜 日本日立公司。
真空浸渍装置由真空干燥器、抽滤瓶和真空泵组成,如图1所示。
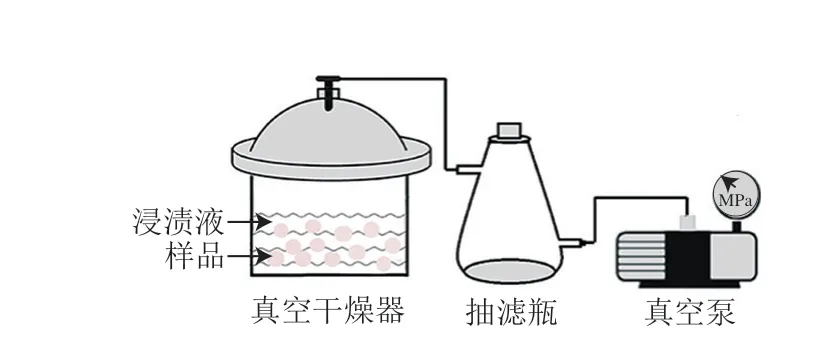
图1 真空浸渍装置示意图Fig.1 Schematic of vacuum impregnation equipment
1.3 方法
1.3.1 样品前处理
将120 个新鲜闭壳肌随机分成4 组,按照料液比1∶1.5加入以下浸渍液中:空白组:0.9 g/100 mL NaCl溶液;焦磷酸钠组:3.0 g/100 mL NaPO溶液+0.9 g/100 mL NaCl溶液;海藻糖组:3.0 g/100 mL海藻糖溶液+0.9 g/100 mL NaCl溶液;抗冻蛋白组:0.2 g/100 mL抗冻蛋白溶液+0.9 g/100 mL NaCl溶液。在4 ℃、0.07 MPa真空度下浸渍1 h,沥干称质量,使用鼓风冻结机将其冷冻到-18 ℃后,放入-18 ℃冰箱冻藏7 d,取样,于4 ℃冰箱解冻3.5 h,使其中心温度达到0~4 ℃。
1.3.2 得率测定
参考Jiang Qingqing等的方法称量浸渍前和解冻后的闭壳肌质量,分别记为、,得率即为新鲜闭壳肌质量与冷冻-解冻后闭壳肌质量之比。按式(1)计算得率:

1.3.3 水分含量测定
按照GB 5009.3—2016《食品中水分的测定》中的直接干燥法测定,每组至少重复3 次。
1.3.4 离心损失率的测定
将解冻后的闭壳肌沿肌纤维方向切下质量(2.00±0.02)g样品,记为/g,用双层滤纸包裹后放于50 mL离心管底部,以6 000 r/min离心10 min,再次称样品质量,记为/g。按式(2)计算离心损失率:
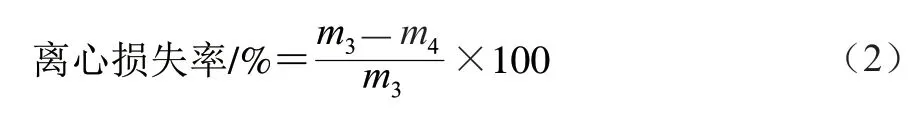
1.3.5 色差测定
参照Tironi等的方法并稍作改动,每组取5 个样品,采用色差仪测定闭壳肌亮度值(*)、红度值(*)、黄度值(*)。将色差仪镜头垂直紧贴于闭壳肌表面,确保镜口不漏光。按式(3)计算():

1.3.6 质构特性及剪切力的测定
参考马海建的方法,略作修改。将贝柱切成20 mm×20 mm×15 mm的长方体,进行2 次轴向压缩测定。测试条件如下:采用P/50平底柱形探头,测前速率1.00 m/s,测试速率1.00 mm/s,返回速率1.00 mm/s,压缩程度50%,两次压缩间停留时间5 s,触发力5 g,数据采集速率200 points/s。每组样品测定6 次。
使用WBS探头,沿垂直于肌纤维的方向将闭壳肌完全切断,记录剪切力值(g),每组测量8 次,去掉最大值和最小值,结果取其余数值的平均值。
1.3.7 低场核磁共振及磁共振成像分析
使用低场核磁共振分析仪测定样品中的水分分布,横向弛豫时间()采用CPMG脉冲序列进行测定。CPMG得到的指数衰减曲线用仪器自带软件进行反演。25 ℃条件下CPMG测试参数:90°脉冲时间18 μs;180°脉冲时间35 μs;时间点数据360 068;前置放大增益1;采样频率200 kHz;重复采样间隔时间3 000 ms;回波时间0.3 ms;回波个数6 000;累加次数8。将整个闭壳肌直接放入直径 60 mm核磁管中,每组至少取3 个样品进行测定。
采用自旋回波成像序列获得样品加权图像。所有图像的视野为80 mm×80 mm,层厚3.0 mm,层间距2.5 mm。重复等待时间500 ms,回波时间18.124 ms,重复采样8 次,质子密度图由软件(上海纽迈电子科技有限公司)统一映射、伪彩化。
1.3.8 冰晶形态的观察与测定
使用Luan Lanlan等的方法进行苏木精-伊红(hematoxylin-eosin staining,HE)染色确定闭壳肌组织中冰晶形态的变化。将组织标本包埋在含蒸馏水、福尔马林、乙酸和乙醇溶液的戴维森固定液中,然后用系列体积分数乙醇溶液对固定样品脱水。将脱水后的肌肉组织用石蜡包埋,用切片机沿横向和纵向切5 µm厚的切片。将组织切片进行HE染色,在光镜下观察肌肉组织微结构变化。
使用ImageJ图像分析软件,参考黄鸿兵等的方法并稍作修改,每组至少选取3 张图片计算冰晶的平均横截面积、平均当量直径、圆度和拉伸度。其中,当量直径为与冰晶面积相同圆的直径;圆度值介于0~1,圆度值越大,冰晶越圆;拉伸度为主长轴与次长轴比值,拉伸度为1时,被认为呈圆形或正方形,拉伸度越大,冰晶越长。每张图中冰晶样本量均为300以上,以确保数据准确性。
1.3.9 肌纤维微观结构测定
参考Tabilo-Munizaga等方法,取解冻好的闭壳肌,切成2~3 mm厚的小块,经2.5%戊二醛溶液于4 ℃固定12 h,用0.2 mol/L pH 7.2磷酸缓冲液漂洗3 次,每次15 min;然后依次用体积分数70%、90%、95%乙醇溶液及无水乙醇进行梯度脱水,脱水时间均为30 min;最后用体积比为3∶1、1∶1、1∶3的乙醇-叔丁醇对样品进行漂洗,每次10 min。冷冻干燥,镀膜后置于扫描电子显微镜下观察。
1.4 数据处理

2 结果与分析
2.1 抗冻蛋白对冷冻虾夷扇贝闭壳肌持水性及质构特性的影响
2.1.1 持水性变化
持水性被定义为肌肉保持自身水分及吸附水分的能力。由表1可知,经过真空浸渍后各组得率均大于100%,表示闭壳肌浸渍后增加的质量均大于解冻损失,说明真空浸渍可以使部分浸渍液截留在闭壳肌内。4 个处理组得率依次为:抗冻蛋白组>焦磷酸钠组>海藻糖组>空白组,抗冻蛋白组得率较空白组高4.61%。各组水分含量与得率变化趋势一致,且抗冻蛋白组离心损失显著低于其他浸渍组(<0.05)。
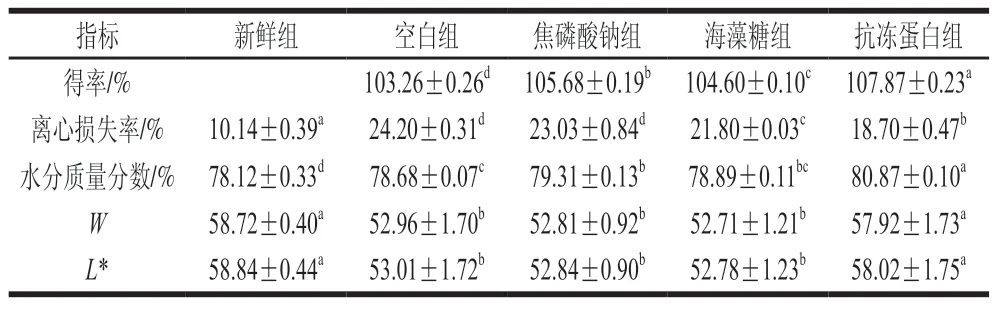
表1 虾夷扇贝闭壳肌持水性及色泽的变化Table 1 Changes in water-holding capacity and color of scallop adductor muscle
肌肉细胞中高达85%的水分被肌原纤维所占据,因此影响汁液流失的主要原因为肌纤维的收缩程度和细胞外间隙的形成。由此推测,真空浸渍提高得率主要涉及丝状晶格的膨胀和肌原纤维蛋白的增溶,从而导致组织内部气体、自由水及可溶性物质等被部分排出,使浸渍液更容易渗透到组织内部。离心损失的降低主要归因于组织较高的持水性。良好的持水性一方面由于肌原纤维的膨胀与增溶可以持留更多水分,另一方面,可能是由于抗冻剂抑制了冰晶生长,降低可冻结水含量,从而提高了闭壳肌的持水性。
2.1.2 色泽变化
Hughes等认为色泽、持水性与嫩度之间相互影响,肌肉的持水性及结构会影响肉的色泽和光散射特性。由表1可知,冷冻后抗冻蛋白组的*和相较于其他3 个浸渍组显著升高,且与新鲜组无显著差异(>0.05),这与速冻猪肉饼冻藏后的色泽变化一致。推测原因可能是由于冷冻过程中冰晶的生长导致肌丝晶格膨胀甚至断裂,纤维束受损变形,从而使光的散射变弱,光路变长,反射光减少,导致*和显著降低。因此,色泽改变可能是由于肌丝晶格排列变化影响光的散射,从而导致发生变化,也可能与组织表面水分增多,持水性降低有关。
2.1.3 质构特性变化
质构是衡量食品结构、评价冷冻水产品品质的重要指标。质构特性主要与肌纤维破坏程度以及蛋白质结构有关,冷冻过程中形成的大且形状不规则的冰晶会对细胞膜和结缔组织造成机械损伤,从而引起质构劣变。由图2可知,抗冻蛋白组闭壳肌的硬度、黏聚性与新鲜组几乎一致,显著高于焦磷酸钠、海藻糖组(<0.05),且比空白组分别提高了27.79%和55.47%。经冷冻后,所有浸渍组弹性均显著下降,且抗冻蛋白组>海藻糖组>焦磷酸钠组>空白组,抗冻蛋白组闭壳肌的弹性比空白组高10.28%。与鲱鱼抗冻蛋白结合CS@FeO纳米颗粒对真鲷解冻后质构特性的影响一致。
由图2可知,新鲜组样品剪切力显著高于冷冻后4 组,抗冻蛋白组剪切力高于其他浸渍组(<0.05),且较空白组高16.11%。这与抗冻蛋白作用于镜鲤后剪切力的变化情况一致。主要原因为冻结过程中冰晶的形成会破坏细胞膜、细胞器,使肌纤维结构部分降解,导致闭壳肌质地变软,剪切力下降。且肌纤维断裂程度越明显,结缔组织破坏越严重,剪切力就越小。以上结果充分证实了抗冻蛋白组质构特性与新鲜组更为接近,抗冻蛋白对质构特性的改善作用优于焦磷酸钠、海藻糖两种传统抗冻剂。

图2 虾夷扇贝闭壳肌质构特性的变化Fig.2 Changes in texture properties of scallop adductor muscle
2.2 抗冻蛋白对冷冻虾夷扇贝闭壳肌水分分布及迁移的影响
如图3所示,弛豫曲线反映闭壳肌中3 种类型水分,其中(0~10 ms)代表紧密结合大分子极性基团的结合水,(10~100 ms)和(100~1 000 ms)分别对应不易流动水(多为固定在肌原纤维网络内的水分)和自由水(肌原纤维晶格中的水分)。由表2及图3可知,冷冻后整体右移,说明细胞外冰晶的形成在一定程度上破坏了细胞膜,导致水分与肌肉组织结合能力变弱。冷冻后各浸渍组无显著差异(>0.05),抗冻蛋白组显著小于其他浸渍组(<0.05),原因可能为抗冻蛋白对冰晶形态的修饰作用减少了由肌纤维变性聚集引起的水分和蛋白质之间的化学交换,减缓了肌原纤维内水分迁移到细胞外。因此,抗冻蛋白组水分与肌原纤维结合更紧密,得率较高,持水性更好。

图3 虾夷扇贝闭壳肌中不同状态水分T2曲线Fig.3 T2 relaxation time curves of different water states in scallop adductor muscle
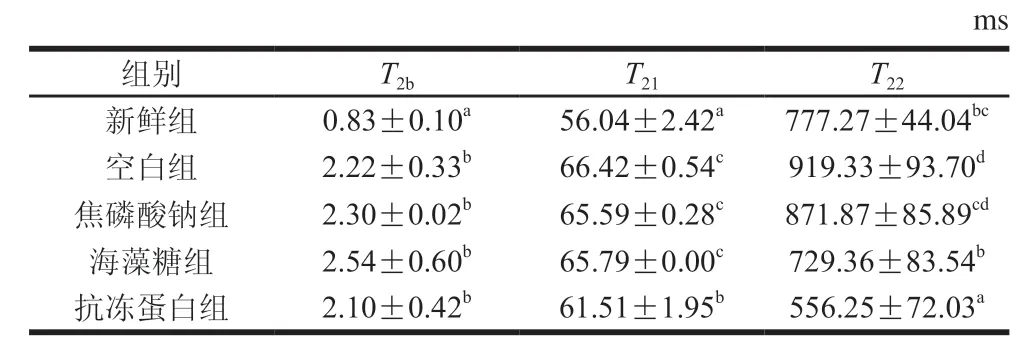
表2 虾夷扇贝闭壳肌中不同状态水分T2分布情况Table 2 Distribution of T2 relaxation time of different water states in scallop adductor muscle
通过质子密度加权成像的方法对虾夷扇贝闭壳肌的水分分布情况进行可视化处理,其中红色表示高质子信号密度,蓝色表示低质子信号密度,黄色区域的信号强度则介于红色和蓝色之间。氢质子越密集的区域信号越强,图谱越红,说明该区域水分含量越多,持水性越好。由图4可知,冷冻后抗冻蛋白组的质子信号密度与新鲜组几乎一致,其他浸渍组质子信号密度较低,红色区域逐渐被黄色区域代替。该变化趋势与表1中各组得率基本相同,进一步证实抗冻蛋白组持水性最好。且冷冻后各组样品从中心到周边区域的红色程度逐渐降低,边缘都为黄色和浅蓝色,这与牛半膜肌经冻融循环后观察到的变化情况相似。可能是由于肌纤维遭到破坏后,水分从肌纤维内部逐渐排出到肌纤维间隙,再通过肌纤维间隙形成的通道从闭壳肌边缘流出,从而导致边缘区域的持水性最差。

图4 虾夷扇贝闭壳肌质子密度加权图Fig.4 Proton density-weighted images of scallop adductor muscle
2.3 抗冻蛋白对冷冻虾夷扇贝闭壳肌冰晶形态的影响
冷冻过程中形成的冰晶会影响细胞完整性,而冰晶的大小和形态决定了冷冻食品品质的劣变程度。通常较大且形状不规则的冰晶会不可逆转地破坏细胞结构,导致持水性、质构特性的劣变和营养物质的损失,而较细小的球形冰晶可以减少对肌纤维的机械损伤。由图5可知,空白组形成了较大且形状不规则的冰柱,焦磷酸钠和海藻糖组可以在一定程度上改善冰晶形态,但仍会出现明显的组织间隙和形状不规则的冰晶。而抗冻蛋白组的冰晶细小且呈球状,较均匀地分散在细胞内外。这一现象直观诠释了抗冻蛋白组持水性及质构特性较其他组更好的原因。抗冻蛋白侧链的亲水基团通过氢键与冰晶棱柱面(冰晶生长表面)相匹配并结合,暴露出高表面自由能的疏水表面,从而降低了冰点,阻碍冰核的形成、冰晶生长以及重结晶。
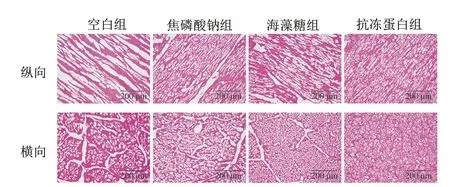
图5 虾夷扇贝闭壳肌冰晶形态的HE染色图Fig.5 Micrographs of ice crystals in scallop adductor muscle
横截面积与当量直径直接反映冰晶表面积的大小,如图6 A 所示,抗冻蛋白组的平均横截面积((282.31±19.87)μm)和平均当量直径((18.95±0.67)μm)最小,其平均横截面积较空白组减小了65.06%。焦磷酸钠和海藻糖组对冰晶形态也具有一定的修饰作用,但效果显著低于抗冻蛋白组(<0.05)。冰晶圆度和拉伸度反映冰晶形状的规则程度,相较于平均横截面积和当量直径的变化较小。如图6B所示,3 种抗冻剂浸渍组的冰晶圆度无显著差异(>0.05),但抗冻蛋白组的拉伸度低于其他浸渍组。进一步证实了抗冻蛋白对冰晶形态具有良好的修饰作用,从而减少了冰晶对肌纤维的挤压和破坏,增强细胞完整性,提高冷冻后虾夷扇贝闭壳肌的持水性及质构特性。
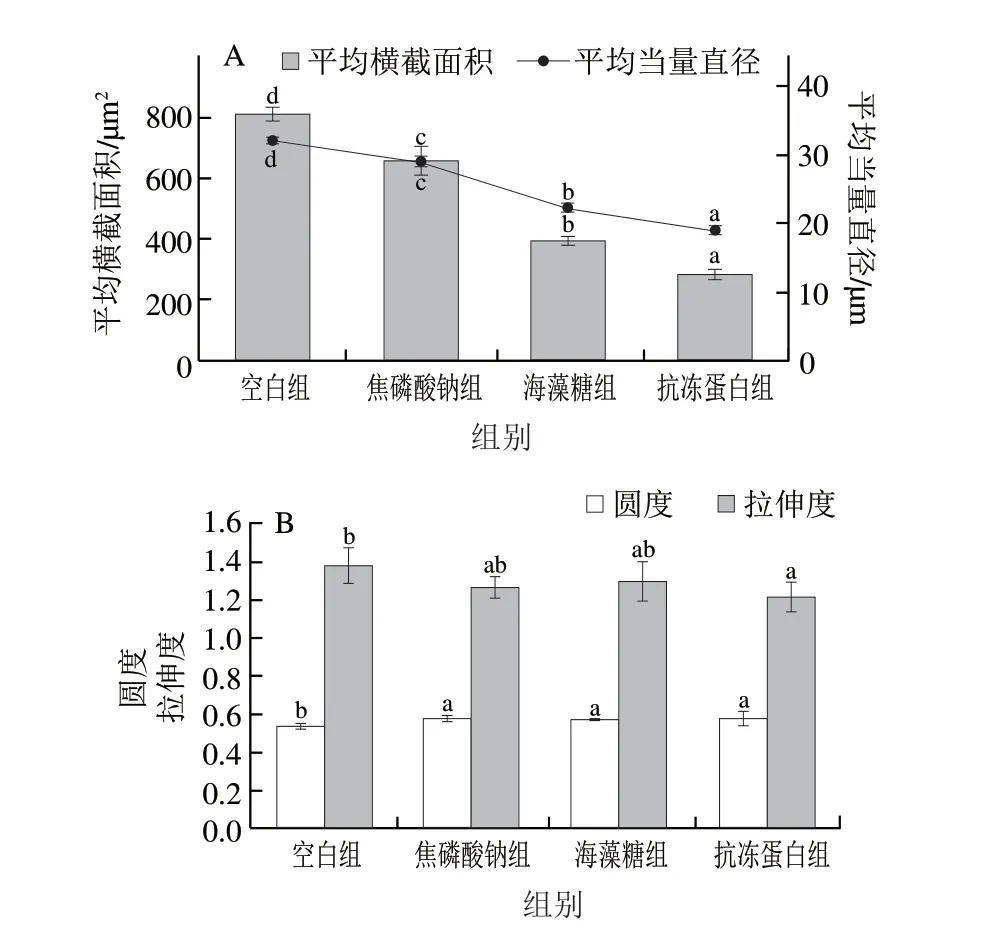
图6 虾夷扇贝闭壳肌的冰晶形态分析Fig.6 Analysis of ice crystal morphology in scallop adductor muscle
2.4 抗冻蛋白对冷冻虾夷扇贝闭壳肌组织结构的影响
肌肉持水性和质构特性与其组织结构密切相关。如图7所示,新鲜组纤维束排列有序,相互平行,具有清晰的网络结构。而空白组肌纤维受损变形,存在较大孔洞和严重的断裂情况。冰晶生长导致肌纤维断裂,从而使组织内部产生了不可逆的形变。相较于空白组,焦磷酸钠、海藻糖组肌纤维束相对整齐,纤维束间孔洞较小且形状较规则,说明焦磷酸钠和海藻糖一定程度上修饰了冰晶形态,减少了冰晶对肌纤维的机械损伤程度。而抗冻蛋白组肌纤维排列仍清晰可见,纤维束紧密堆积,破坏程度最小,推测原因也可能为抗冻蛋白结合到冰晶表面后积聚在冰-水界面处,使冰晶曲面和边缘表面积增大,蒸汽压力升高,体系的平衡状态发生改变,从而导致冰点降低,即Kelvin效应。因此抗冻蛋白对冰晶形态的修饰作用最佳,抗冻蛋白组硬度、黏聚性与新鲜组几乎一致,持水性较其他组显著提高。
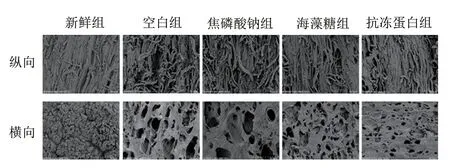
图7 虾夷扇贝闭壳肌组织微观结构变化(×800)Fig.7 Changes in microstructural structure of scallop adductor muscle (× 800)
3 结论
抗冻蛋白有效改善了冷冻虾夷扇贝闭壳肌的持水性及质构特性,且效果显著优于焦磷酸钠和海藻糖。主要表现为抗冻蛋白组硬度、黏聚性及质子密度与新鲜组几乎一致,且显著高于焦磷酸钠和海藻糖组。而相比于其他浸渍组,抗冻蛋白组得率、弹性及剪切力显著增加,显著缩短(<0.05),冰晶细小且呈球状,肌纤维结构较清晰完整,且冰晶平均横截面积比空白组减少了65.06%。本研究证实了抗冻蛋白具有吸附于冰晶表面从而抑制冰晶生长、修饰冰晶形态的作用,通过真空浸渍处理后对冷冻虾夷扇贝闭壳肌持水性及质构特性的调控作用优于焦磷酸钠、海藻糖,是一种有效的冷冻水产品抗冻剂,为进一步探究抗冻蛋白在冷冻过程中对蛋白变性的影响及抗冻机制提供参考。

