基于“质谱分析-网络药理学预测-活性验证”的牛黄解毒丸抗炎作用研究
伊博文 赵洁 赖华清 唐力英 陈攀龙 柴兴云 高小力 吴宏伟








摘要 目的:基于“質谱分析-网络药理学预测-活性验证”整合研究思路,解析牛黄解毒丸抗炎潜在作用机制解析及其活性成分。方法:通过高分辨质谱技术分析牛黄解毒丸化学成分,将分析出的成分;利用中药生物信息学分析工具(BATMAN-TCM)寻找对应的靶标;以“inflammation”作为关键词利用人类孟德尔遗传数据库(OMIM)获得炎症相关靶标;取成分靶标与疾病靶标交集,利用蛋白质-蛋白质相互作用(PPI)数据库(STRING)对共同靶标进行PPI分析,并采用Cytoscape软件对靶标进一步筛选,得到核心靶标;利用生物信息分析工具(DAVID数据库),对核心靶标进行京都基因和基因组百科全书(KEGG)通路富集分析,构建“药物-成分-靶标-通路”网络图;采用AutoDock 4.2.6软件,对关键靶标及相关药物分子进行分子对接验证,并针对前列腺素内过氧化物合酶2(PTGS2)这一靶标与其对应化学成分进行体外实验验证。结果:经高分辨质谱技术分析出牛黄解毒丸中236个成分,对应456个靶标,炎症相关靶标158个,二者交集靶标21个,PPI分析及网络拓扑分析后,获得核心靶标11个,活性成分14个,涉及肿瘤坏死因子(TNF)、核因子κB(NF-κB)、Toll样受体(TLR)和趋化因子等27条通路,分子对接结果显示,PTGS2、白细胞介素-1β(IL-1β)、白细胞介素-13(IL-13)和C-C基序趋化因子配体2(CCL2)等靶标与其对应的大黄酸,虫漆酸D,齐墩果酸等成分结合活性较高,在体外活性实验中,大黄酸对于其对应的PTGS2这一靶标具有较好的抑制作用。结论:本研究构建了牛黄解毒丸抗炎的调控网络,解析了牛黄解毒丸抗炎有效成分和作用机制,发现了大黄酸对PTGS2这一抗炎靶标具有较好的抑制作用。
关键词 牛黄解毒丸;抗炎;网络药理学;靶标
Analysis of Anti-Inflammatory Mechanism of Bezoar Antidotal Pill Based on “Mass Spectrometry Analysis-Network Pharmacology Prediction-Activity Verification”
YI Bowen1,ZHAO Jie2,LAI Huaqing2,TANG Liying2,CHEN Panlong3,CHAI Xingyun3,4,GAO Xiaoli3,4,WU Hongwei2
(1 Xiyuan Hospital,China Academy of Chinese Medical Sciences,Beijing 100091,China; 2 Institute of Chinese Materia Medica,China Academy of Chinese Medical Sciences,Beijing 100700,China; 3 School of Chinese Materia Medica, Beijing University of Chinese Medicine,Beijing 102488,China; 4 Center for Modern Research of Chinese Materia Medica,School of Chinese Materia Medica,Beijing University of Chinese Medicine,Beijing 100102,China)
Abstract Objective:To analyze the potential mechanism of anti-inflammatory action of Bezoar Antidotal Pill and its active components based on the integrated research idea of “mass spectrometry analysis-network pharmacology prediction-activity verification”.Methods:High-resolution mass spectrometry was used to analyze the components in Bezoar Antidotal Pill,and the analyzed components were used to find the corresponding targets by using the bioinformatics analysis tool of molecular mechanism of traditional Chinese medicine(BATMAN-TCM).Inflammation-related targets were obtained from the Mendelian Inheritance Database(OMIM) database,and the intersection of component targets and disease targets was taken.The protein interaction analysis of common targets was performed using the Protein Interaction Database(STRING) database,and the targets were further screened by Cytoscape software.Using the DAVID database,the Kyoto Encyclopedia of Genes and Genomes(KEGG) pathway enrichment analysis was performed on the core targets,and a “drug-component-target-pathway” network diagram was constructed; AutoDock 4.2.6 software was used to conduct molecular docking verification on key targets and related drug molecules,and for prostaglandin endoperoxide synthase 2(PTGS2) target and its corresponding chemical constituents for in vitro verification.Results:A total of 236 components in Bezoar Antidotal Pill were analyzed by high-resolution mass spectrometry,corresponding to 456 targets,158 inflammation-related targets,and 21 intersection targets.After protein interaction analysis and network topology analysis,11 core targets and 14 active ingredients were obtained,involving 27 pathways including tumor necrosis factor(TNF),nuclear factor kappa-B(NF-κB),Toll-like receptors(TLR) and chemokines.The docking results showed that the targets of PTGS2,interleukin-1β(IL-1β),interleukin-13(IL-13) and chemokine 2(CCL2) and their corresponding rhubarb Acid,laconic acid D,oleanolic acid and other components had higher binding activities.In vitro activity experiments,rhein had a good inhibitory effect on their corresponding PTGS2 target.Conclusion:In this study,the anti-inflammation regulatory network of Bezoar Antidotal Pill was constructed,and the active ingredients and mechanism of action of Bezoar Antidotal Pill were analyzed.It was found that rhein had a good inhibitory effect on the anti-inflammatory target PTGS2.
Keywords Bezoar Antidotal Pill;Anti-inflammation;Network pharmacology;Target
中图分类号:R285;R284.1文献标识码:Adoi:10.3969/j.issn.1673-7202.2022.07.006
炎症是机体受到多种炎症介质刺激以后由体内的核巨噬细胞、中性粒细胞及嗜酸性细胞等吞噬细胞参与的一系列复杂的防御反应[1-2],往往会有红、肿、热、痛和功能障碍等一些表现。通常情况下,适度的炎症可以帮助机体激活免疫系统清除病原体,促进组织愈合,但是一旦反应过度,将会带来严重的炎症损伤,随之而来的还会有多种疾病,大大增加了疾病的发病率和病死率[3]。
牛黄解毒丸是我国一种传统的中成药,由牛黄(人工牛黄)、大黄、雄黄、黄芩、生石膏、冰片、桔梗及甘草8味药组成,其具有泻火通便,清热解毒的功效,在临床上主要应用于咽喉肿痛,头痛牙痛,口舌生疮等症[4],由于其清热力比较强,在临床中还可以治疗因热毒内盛、风火上攻所致的急性咽炎、急性口炎、复发性口疮、急性牙龈(周)炎、急性结膜炎等疾病。相关实验研究表明,牛黄解毒丸中牛黄,大黄,黄芩,桔梗等这些成分都具有抗炎,抗菌,抗氧化,保护肝肾的作用[5-8]。牛黄解毒丸可以显著降低炎症水平,但是其有效作用成分和作用机制却还不清楚。
本研究以经典名方牛黄解毒丸为研究对象,从证候对应的关键病理环节炎症入手,采用“质谱分析-网络药理学预测-活性验证”的整合研究策略进行研究。为使得临床应用成分与网络分析后的成分一致,先借助高分辨质谱技术,分析牛黄解毒丸中的成分,然后采用网络药理学方法,借助BATMAN-TCM这个平台,搜索成分相关的靶标,再用人类孟德尔遗传数据库(Online Mendelian Inheritance in Man,OMIM)这个数据平台,搜索炎症相关靶标,并对得到的成分和靶标做分子对接和体外活性验证,以此帮助明确牛黄解毒丸抗炎机制,为临床使用提供理论和实验依据。
1 材料与方法
1.1 材料
1.1.1 仪器 超高效液相色谱仪(Agilent,美国,型号:HPLC 1290);5600+质谱仪(AB Sciex Instruments,美國,型号:Triple TOF 5600+);多功能酶标仪(ThermoFisher,美国,型号:SpectraMax iD5);电子天平(梅特勒-托利多集团,瑞士,型号:Toledo PL402-L)。
1.1.2 试剂 质谱级甲醇(赛默飞世尔科技有限公司,美国,批号:A456-4);质谱级乙腈(赛默飞世尔科技有限公司,批号:A955-4);色谱纯甲醇(赛默飞世尔科技有限公司,美国,批号:643023256);娃哈哈纯净水(杭州娃哈哈集团有限公司,批号:GB17323);环氧化酶-2抑制剂筛选试剂盒(上海碧云天生物技术有限公司,批号:052421210531)
1.1.3 分析样品 牛黄解毒丸[北京同仁堂(集团)有限责任公司,批号:18010695];阿司匹林(广东九明制药有限公司,批号:H44021139);大黄酸(成都克洛玛生物科技有限公司,货号:CHB-D-006,纯度≥98%)、齐墩果酸标准品(成都克洛玛生物科技有限公司,货号:CHB-Q-002,纯度≥98%)。
1.2 供试品制备 取牛黄解毒丸(大蜜丸)1粒(3 g),用剪刀剪碎,并加入适量硅藻土与丸剂一起研磨,分散均匀后,精密加入质谱甲醇100 mL,超声提取45 min,放冷,滤过,即得供试品溶液,将制得的样品进样进行化学成分分析。
1.3 色谱与质谱条件 色谱柱为ACQUITY UPLC Xbridge C18 Column(2.5 μm,2.1 mm×150 mm),流动相A为0.1%的甲酸水,B为乙腈,洗脱程序见表1。柱温为35 ℃,进样器温度为4 ℃,进样量为5 μL,流速为0.3 mL/min。质谱条件:质谱采用正/负离子模式(ESI+/-),采集范围为5~1 200 Da,采用独立数据采集(Independent Data Acquisition,IDA)模式,碰撞电压为35 V,毛细管电压为4 500 V(负离子)和5 500 V(正离子),离子源温度为400 ℃(负离子)和550 ℃(正离子),去簇电压为60 V。气帘气流量为25 L/min,Gas1和Gas2气流量均为50 L/min,所有气体均为氮气。
1.4 牛黄解毒丸化学成分及炎症相关靶标搜集 基于生物信息学分析平台BATMAN-TCM(http://bionet.ncpsb.org/batman-tcm/)根据结构相似性(得分>20分)对经过液质分析后牛黄解毒丸中的成分进行药物靶标预测。采用OMIM平台(www.omim.org),以炎症(inflammation)为检索词,搜索炎症相关靶标。
1.5 牛黄解毒丸抗炎核心靶标筛选 将牛黄解毒丸液质分析所得化学成分靶标与炎症相关靶标取交集,利用STRING数据库(https://string-db.org/),构建蛋白质-蛋白质相互作用(Protein-protein Interaction,PPI)网络(PPI score>0.4),然后将这些靶标导入到Cytoscape 3.7.2软件中进行可视化分析,利用连接度(Degree),介度(Betweenness),紧密度(Closeness)3个拓扑参数进行筛选,筛选条件为同时大于等于这3个参数值的中位数,以此进一步缩小牛黄解毒丸抗炎核心靶标的范围。在可视化分析得到的核心靶点的关系图中,靶点图标的形状越大,表明该靶标在网络中与其相关的其他靶点越多、在网络中的作用越重要;靶点间的连接线越粗,表明相关靶点蛋白间的Degree值越大,二者间的生物关联度越高。
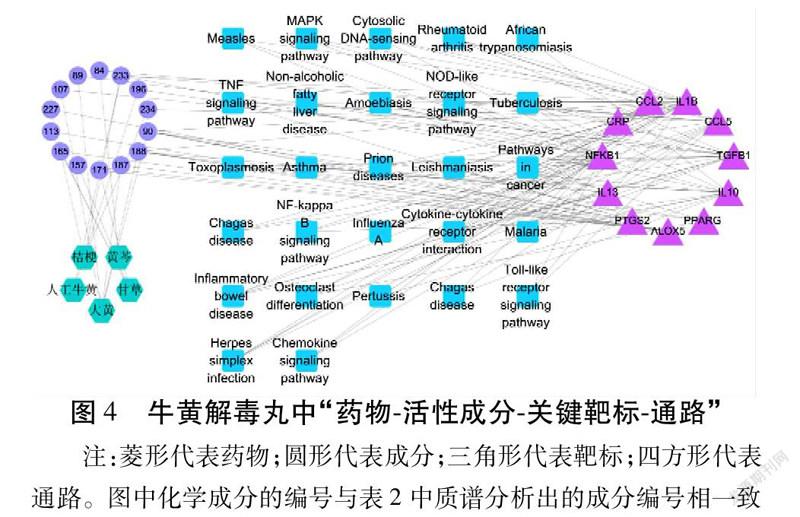
1.6 通路富集分析 将上述分析的核心靶点使用DAVID(https://david.ncifcrf.gov/)数据库进行京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析。以P<0.05为阈值,从中筛选牛黄解毒丸抗炎潜在的信号通路,并且P值越小表明富集得到的通路的可信度越高;“数量”表示该条通路富集的靶标数。利用Cytoscape软件,将富集到的通路、核心靶点以及其对应的化学成分绘制成“药物-成分-靶标-通路”网络图,全面阐明牛黄解毒丸抗炎的机制。
1.7 分子对接验证 为验证牛黄解毒丸抗炎潜在靶点准确性,将部分核心靶标与其对应的成分进行分子对接。在PDB蛋白数据库(http://www1.rcsb.org/)下载核心靶标蛋白结构,并保存为*.pdb格式文件;将药物成分分子式导入Chem 3D软件(18.0)进行能量优化后保存为*.pdb格式,然后利用Auto Dock软件(4.2.6)进行对接,找到最佳构象后然后利用Pymol软件可视化分析。一般认为,结合能<0,则认为该成分与靶点能够结合在一起,结合能越低,则二者结合能力越强,形成的构象也就越稳定。
1.8 体外实验驗证 利用环氧合酶-2(Cyclooxygenase-2,COX-2)抑制剂筛选试剂盒检测其有效成分的抗炎活性,阿司匹林为阳性药。试剂盒中提供了人重组COX-2(Recombinant Human COX-2,rhCOX-2)、底物(Substrate)、辅助因子(Cofactor)及可以被COX-2催化产生荧光的荧光探针(Probe)反应生成的强荧光探针,检测时的激发波长为560 nm,发射波长为590 nm。COX-2抑制率的计算,抑制率(%)=(RFU100%酶活性对照-RFU样品)/(RFU100%酶活性对照-RFU空白对照)×100%。
2 结果
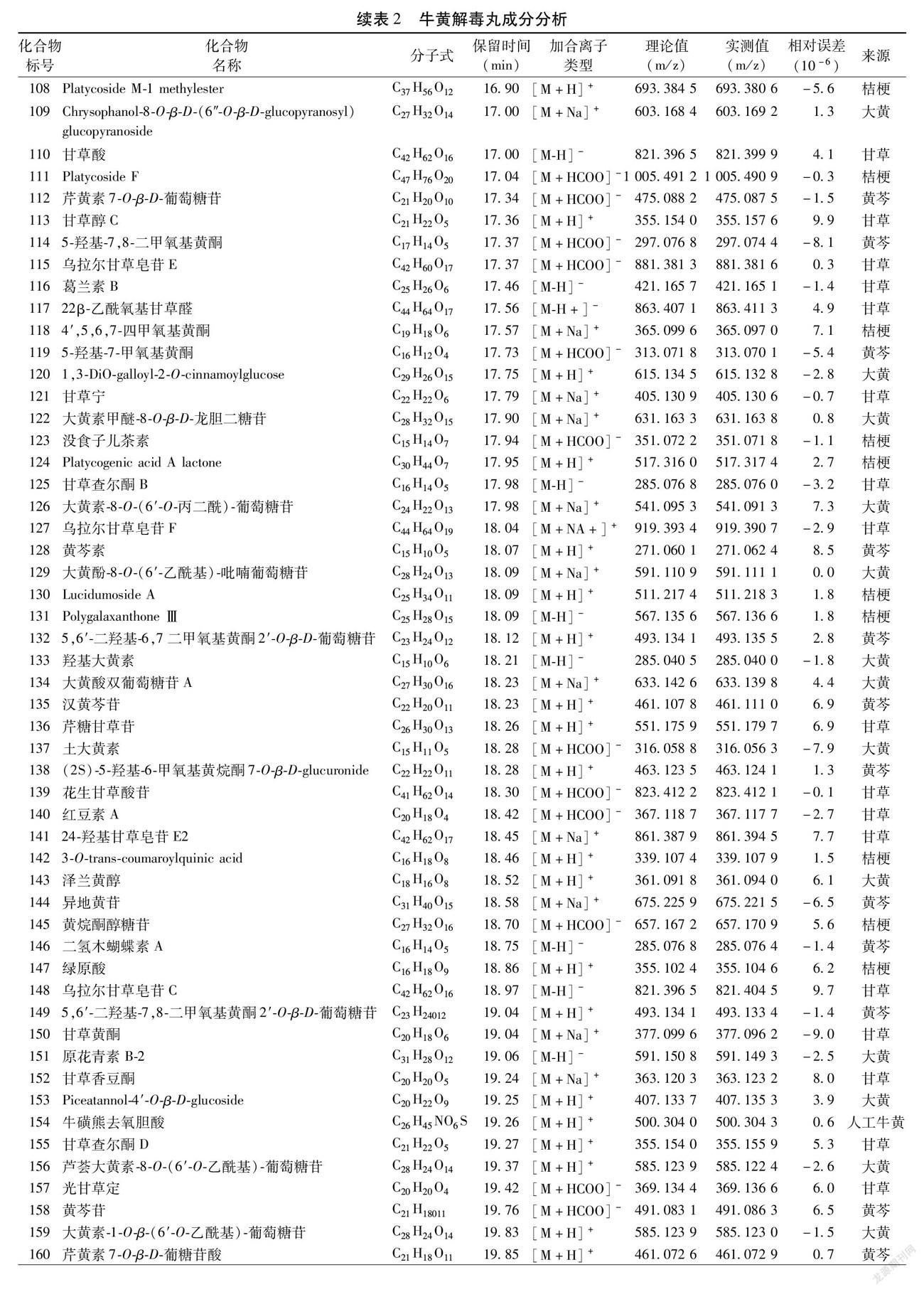
2.1 牛黄解毒丸化学成分分析 通过液质联用技术共鉴定出236种化合物:其中黄酮60种,类黄酮18种,查耳酮6种,色原酮2种,蒽醌45种,蒽酮4种,萜类35种,甾体10种,香豆素6种,苯乙醇苷5种,二苯乙烯类6种,油脂3种,有机酸5种,其他31种。见图1~2,表2。
2.2 牛黄解毒丸成分靶标及疾病靶标分析结果 基于液质分析后得到的236个成分,利用BATMAN-TCM数据库,分析这些成分作用的靶标,提取评分大于20的成分靶标作为潜在的药物成分靶标,去除重复值以后共得到456个化合物靶标。利用OMIM数据库,共筛选得到158个与炎症相关的疾病靶标。
2.3 核心靶标筛选 将分析到的药物成分靶标与炎症相关靶标取交集,共得到21个共有的靶标,将这21个靶标导入到STRING数据库,构建蛋白质-蛋白质相互作用(Protein-protein Interaction,PPI)网络,去除没有相互作用关系的边缘靶标蛋白,将剩下的靶标导入到Cytoscape中,以Degree、Betweenness、Closeness这3个拓扑参数的中位数(分别为9.500 0、0.015 3、0.613 5)作为筛选条件,最终获取牛黄解毒丸抗炎的11个核心靶标,并且在11个核心靶标中,IL-10、CCL2、IL-1β和PTGS2这4个靶点的形状最大,表明与其发生直接(或间接)生物信息关联的其他蛋白靶标最多,在网络中的作用更为重要。见图3。
2.4 KEGG通路分析和药物-成分-靶标-通路网络构建 基于11个核心靶标,通过KEGG通路富集分析,发现并得到27条信号通路,根据通路富集显著度评价参数P值的大小,现出了排名靠前的10条通路。其中细胞因子受体相互作用通路(Cytokine-cytokine Receptor Interaction)、TNF信号通路(TNF Signaling Pathway)、核因子κB信号通路(NF-kappa B Signaling Pathway)、Toll样受体信号通路(Toll-like Receptor Signaling Pathway toll)、趋化因子信号通路(Chemokine Signaling Pathway)、NOD样受体信号通路(NOD-like Receptor Signaling Pathway)等,均与炎症有着紧密的关系,并为牛黄解毒丸发挥抗炎作用的潜在信号通路。见表3。
此外,在“药物-成分-靶标-通路”网络图中涉及PTGS2,IL-1β,IL-10,CCL2,IL-13等11个靶标和大黄酸,齐墩果酸,白藜芦醇等14个成分,以及TNF信号通路(TNF signaling pathway)、NF-κB信号通路(NF-kappa B Signaling Pathway)、Toll样受体信号通路(Toll-like Receptor Signaling Pathway)、趋化因子信号通路(Chemokine Signaling Pathway)等27条信号通路。其中核心靶点对应的成分中,白藜芦醇(89)、大黄酸(90)、大黄酚(107)、表儿茶素5,3′-O-β-D-葡萄糖苷(187)与虫漆酸D(188)5种成分源于大黄,甘草醇C(113)、光甘草定(157)、Glyasperin C(165)和光甘草素(171)4种成分源于甘草,派立托胺(84)源于黄芩,齐墩果酸(227)和邻苯二甲酸二(2-乙基己)酯(234)源于桔梗,麦角甾醇(196)源于人工牛黄,硬脂酸(233)源于桔梗。以上结果从网络药理学预测的角度整体上揭示了牛黄解毒丸抗炎潜在物质基础及作用机制。见图4。
2.5 分子对接分析 选取牛黄解毒丸抗炎作用核心靶标网络中(图3)最为重要的4个靶标PTGS2,IL-1β,CCL2,IL-10及与其对应的化学成分进行分子对接实验,从计算的角度验证以上预测的准确性。将每个靶点与其对应成分对接的结果按照结合能大小依次排列。结合能小于0代表靶点与成分可以结合到一起,值越小则说明结合能力越强。其中PTGS2与齐墩果酸(-10.55 kcal/mol)、虫漆酸D(-9.6 kcal/mol)、大黄酸(-8.2 kcal/mol)均具有较好的结合能力;IL-1β与虫漆酸D(-8.36 kcal/mol)、大黄酸(-8.09 kcal/mol)的结合能力最佳;IL-13与虫漆酸D(-8.23 kcal/mol)、大黄酸(-7.83 kcal/mol)结合能力最佳;CCL2与硬脂酸的结合能为-4.08 kcal/mol (1 kcal=4.184 J)。见表4。
2.6 体外实验验证 基于分子对接的结果,选取炎症介质前列腺素合酶2(Prostaglandin Synthase,PTGS2)及其对应的化学成分大黄酸和齐墩果酸,进行体外活性验证。利用环氧化酶-2(COX-2)抑制剂筛选试剂盒检测其有效成分的抗炎活性,阿司匹林为阳性药。抑制COX-2的剂量反应曲线结果见图5,与阳性药阿司匹林(IC50=1 063.4 nmol/L)比较,大黄酸(IC50=250 nmol/L)有较好的COX-2抑制活性,齐墩果酸抑制COX-2活性稍弱,但阿司匹林的最大抑制率要高于大黄酸和齐墩果酸。体外实验进一步证实了分子对接的部分结果以及牛黄解毒丸中抗炎的活性成分。
3 讨论
本研究先通过高分辨质谱技术,得到牛黄解毒丸中的236个成分,然后利用网络药理学技术,分析得到11个核心靶标,对应14个化学成分,经KEGG分析发现有27条相关通路。其中涉及的核心靶标有PTGS2、IL-10、IL-1β、CCL2、IL-13等11个核心靶标,与之相对应的有大黄酸,齐墩果酸,白藜芦醇等这些成分。
大黄酸具有显著抗炎作用,有实验证明,大黄酸及其前体药物双醋瑞可以下调高热幼鼠腹腔液和非肥胖型糖尿病小鼠血清中IL-1β、IL-12和TNF-α细胞因子的浓度[9-10]。齐墩果酸属于五环三萜类化合物,具有抗炎、抗病毒等许多药理作用,连俊江等[11]在研究齐墩果酸对SW982细胞的毒性作用时发现齐墩果酸可以通过调节促分裂原活化的蛋白激酶(Mitogen Activated Protein Kinase,MAPK)、磷脂酰肌醇-3-激酶-蛋白激酶B(Phosphatidylinositol-3-kinase-protein Kinase B ,PI3K/AKT)和核因子κB信号通路而抑制IL-1β刺激的炎症介质的表达。白藜芦醇,一种多酚类化合物,王鹏[12]在对白藜芦醇抗急性痛风性关节炎疗效及机制研究中发现,白藜芦醇能抑制IL-1β的分泌,缓解关节组织中炎性细胞的浸润。
核心靶标中,PTGS2又称COX-2,是前列腺素内过氧化物合酶其中的一个亚型,参与细胞生长,发育以及多种炎症反应[13],在正常情况下,COX-2在组织细胞中几乎不表达,而当处于病理状态时,表达量就会上调[14]。CCL2是趋化因子的一种,在炎症反应、损伤修复等生理病理过程中发挥着重要作用[15],炎症反应会引导细胞发生定向迁移,加速释放炎症介质,并形成恶性循环[16]。IL-13是一种具有免疫调节作用的多效性细胞因子,是引起气道炎症反应的始动因子,在哮喘及过敏性气道炎症的发生发展中起重要作用[17]。IL-1β是针对真菌感染的炎症反应中至关重要的炎症介质[18-19]。在体外活性实验中,通过网络药理学分析,选取PTGS2靶标对应的大黄酸和齐墩果酸这2个成分进行验证,进一步证实了大黄酸和齐墩果酸对于炎症介质PTGS2均有一定的抑制作用。
KEGG通路富集分析结果显示,涉及NF-κB,TNF,Toll样受体等27条信号通路。NF-κB是核蛋白因子,在参与炎症反应,细胞增殖、分化与凋亡,免疫反应等相关的基因转录调控中起着重要作用[20]。Toll样受体信号通路,趋化因子信号通路。肿瘤坏死因子包含两大主要成员,TNF-α和TNF-β,其中TNF-α参与全身炎症和免疫反应[21]。Toll样受体是介导天然免疫的重要模式识别受体,它在炎症的发生和发展过程中极其重要,控制着脂多糖炎症信号的细胞内转导和NF-κB的激活,以及众多炎症介质的释放[22-23]。可见,多条通路都参与炎症反应,这同时也揭示了牛黄解毒丸抗炎机制。
综上所述,基于网络药理学分析结果,牛黄解毒丸通过大黄酸,白藜芦醇,齐墩果酸等化合物,作用于PTGS2,CCL2,IL-1β,IL-13等这些靶点上,通过NF-κB,Toll样受体,趋化因子等这些通路发挥抗炎作用。
参考文献
[1]Low A,Mak E,Rowe JB,et al.Inflammation and cerebral small vessel disease:A systematic review[J].Ageing Res Rev,2019,53:100916.
[2]Trépanier MO,Hopperton KE,Mizrahi R,et al.Postmortem evidence of cerebral inflammation in schizophrenia:a systematic review[J].Mol Psychiatry,2016,21(8):1009-1026.
[3]楊晓君,何洋,沈秦可,等.基于网络药理学探讨北沙参的抗炎机制[J].现代食品科技,2021,37(5):31-37.
[4]王银梅.牛黄上清丸(片)与牛黄解毒丸(片)之异同[J].湖北中医杂志,2015,37(12):50-50,51.
[5]梅慧奇,陈碧,黄增峰,等.体外培育牛黄对急性脑出血致全身炎症反应综合征患者TNF-α、IL-6的影响[J].中国中医急症,2008,17(12):1663,1667.
[6]唐春丽,魏江存,滕红丽,等.黄酮类成分抗炎活性及其作用机制研究进展[J].中华中医药学刊,2021,39(4):154-159.
[7]任正肖,车萍,李紫薇,等.黄芩化学成分和药理作用的研究进展[J].山东化工,2021,50(3):65-67.
[8]陈丹丹,洪挺,王栋,等.桔梗的化学成分及其药理作用研究概况[J].药品评价,2020,17(15):9-11.
[9]Pasin JS,Ferreira AP,Saraiva AL,et al.Diacerein decreases TNF-alpha and IL-1beta levels in peritoneal fluid and prevents Baker′s yeast-induced fever in young rats[J].Inflamm Res,2010,59(3):189-196.
[10]Malaguti C,Vilella CA,Vieira KP,et al.Diacerhein downregulate proinflammatory cytokines expression and decrease the autoimmune diabetes frequency in nonobese diabetic (NOD) mice[J].Int Immunopharmacol,2008,8(6):782-791.
[11]连俊江,程彬峰,高尧鑫,等.齐墩果酸对IL-1β诱导的SW982细胞炎症反应的抑制作用[J].药学学报,2016,51(11):1711-1716.
[12]王鹏.白藜芦醇抗急性痛风性关节炎疗效及机制研究[D].青岛:青岛大学,2014.
[13]Echizen K,Hirose O,Maeda Y,et al.Inflammation in gastric cancer:Interplay of the COX-2/prostaglandin E2 and Toll-like receptor/MyD88 pathways[J].Cancer Sci,2016,107(4):391-397.
[14]蔡凡,王红艳,王毅盟,等.老年糖尿病患者对阿司匹林敏感性差异与炎症因子的关系[J].内科理论与实践,2016,11(4):234-239.
[15]王薇,布力布·吉力斯汉,许春蕾,等.胃癌患者血清CCL2、ANXA2含量与癌细胞浸润性生长的相关性研究[J].中国细胞生物学学报,2021,43(2):404-412.
[16]Scanzello CR.Chemokines and inflammation in osteoarthritis:Insights from patients and animal models[J].J Orthop Res,2017,35(4):735-739.
[17]Wills-Karp M,Chiaramonte M.Interleukin-13 in asthma[J].Curr Opin Pulm Med,2003,9(1):21-27.
[18]Gao X,Zhao G,Li C,et al.LOX-1 and TLR4 aff ect each other and regulate the generation of ROS in A.fumigatus keratitis[J].Int Immunopharmacol,2016,40:392-399.
[19]Gringhuis SI,Kaptein TM,Wevers BA,et al.Dectin-1 is an extracellular pathogen sensor for the induction and processing of IL-1β via a noncanonical caspase-8 inflammasome[J].Nat Immunol,2012,13(3):246-254.
[20]楊雷,邓进,邓志红.NFkB及其基因多态性与炎症及肿瘤关系的研究进展[J].贵州医药,2016,40(10):1098-1100.
[21]唐强,尹侠,朱路文,等.运动预适应对离体老龄大鼠心肌缺血/再灌注损伤后心肌梗死面积及心肌组织炎症反应的影响[J].辽宁中医药大学学报,2021,23(12):4-8.
[22]Zhu YG,Qu JM.Toll like receptors and inflammatory factors in sepsis and differential expression related to age[J].Chin Med J(Engl),2007,120(1):56-61.
[23]徐颖,王爽,秦婷婷,等.复方银花解毒颗粒对脂多糖致幼龄大鼠急性肺炎模型的抗炎作用及TLR4/NF-κB/NLRP3信号通路的影响[J].中草药,2021,52(1):203-210.
(2022-03-10收稿 本文编辑:王明)

