结直肠癌患者UMPS酶基因多态性与氟尿嘧啶化疗敏感性及毒性相关性研究*
陈岷,张远,边原,钟磊,陈璐,涂碎萍,李获
(1.电子科技大学附属医院·四川省人民医院药学部,个体化药物治疗四川省重点实验室,成都 610072;2.成都市温江区人民医院药学部,成都 611130)
结直肠癌(colorectal cancer,CRC)是常见的恶性肿瘤之一[1]。在2019年全国肿瘤登记中心颁布的2015年中国恶性肿瘤流行情况的数据中,我国CRC发病38.81万例,位居第3位,死亡为18.704万例,位居第5位[2],并且呈逐年增加的趋势[3]。早期CRC确诊率较低,而确诊的中晚期CRC患者多已失去手术治疗机会,临床上常采用全身化疗[4]。氟尿嘧啶(flurouracil,5-FU)广泛用于CRC等实体肿瘤的治疗[5]。NCCN临床实践指南结肠癌(2021.V1)[6]与中国临床肿瘤学会结直肠癌诊疗指南2020版[7]均推荐5-FU为治疗CRC的一线化疗药物[8-9]。不同患者5-FU疗效与毒性反应存在较大差异,甚至有少部分患者出现致死性骨髓抑制等毒性反应[10-11]。5-FU临床一般以体表面积计算患者用药剂量,本身无抗肿瘤作用[12-13],静脉持续泵入体内后,约80%以上药物经肝脏DPD酶分解代谢为无活性的产物,仅约20%通过尿苷单磷酸合成酶(uridine monophosphate synthetase,UMPS)磷酸化为一磷酸氟尿嘧啶(FUMP),进一步转化成三磷酸氟尿嘧啶(FUTP)或三磷酸氟尿嘧啶脱氧核苷(FdUTP)等活性代谢产物,作用RNA和DNA的合成。UMPS基因多态性与5-FU敏感性密切相关。国内关于两者的相关性研究笔者尚未见到,因此从药物反应遗传学角度上分析中国人群CRC患者的UMPS基因多态性与化疗疗效和毒性之间的关系,进而加强患者药学监护和指导临床用药具有重要意义。
1 资料与方法
1.1研究对象 2017年3月试验计划经四川省医学科学院·四川省人民医院伦理委员会审批通过,编号:伦审(研)2017年第117号。纳入2017年3月—2018年3月在四川省医学科学院·四川省人民医院肿瘤科接受mFOLFOX6方案治疗、符合纳入排除标准的患者70例,入组患者详细了解本研究内容且皆自愿签署知情同意书。收集化疗前、化疗后检测肝肾功能﹑血常规,以评价毒性反应及耐受性,3~4周期MRI、CT、B超等影像学检查资料,以评价患者疗效。记录患者性别、年龄、组织类型等基础信息。于6:00—7:00采集患者5-FU泵注24~36 h后的外周EDTA抗凝静脉血4 mL。
1.2纳入及排除标准 纳入标准:①经病理证实为结直肠癌;②美国东部肿瘤协作组(ECOG)评分 ≤ 2分,预计生存期 ≥ 3个月;③辅助化疗停止时间≥6个月或未进行过化疗;④接受mFolfox6方案的化疗;⑤肝肾功能﹑血常规均达到化疗标准;⑥年龄30~75岁;⑦至少有1个可测量的实体肿瘤。排除标准:①精神疾病;②具有严重肝肾疾病;③孕妇;④合并其他抗肿瘤治疗;⑤不耐受化疗的患者。
1.3化疗方案 mFolfox6方案化疗:第1 天静脉滴注奥沙利铂85 mg·(m2)-1(>2 h),静脉滴注亚叶酸钙400 mg·(m2)-1(>2 h);滴注结束后,静脉推注5-FU 400 mg·(m2)-1,随后持续静脉泵注5-FU 1200 mg·(m2)-1·d-1× 2 d[46~48 h内总输注量2400 mg·(m2)-1],2周为1个周期,患者在化疗3或4个周期后评价疗效。
1.4试验测定和临床观察指标 ①化疗治疗前后的基础信息、肝肾功、血常规、MRI和CT等检查报告;②化疗后的完全缓解(complete response,CR)、部分缓解率(partial response,PR)、疾病稳定(stable disease,SD)、客观有效率(response rate,RR)、疾病进展率(progressive disease,PD)和疾病控制率(disease control rate,DCR);③化疗后的骨髓抑制、恶心呕吐、腹泻、过敏、手足综合征等毒性反应程度和发生率。
1.5基因测定方法 DPYD基因分型采用Sanger测序法分析,引物序列rs1801019-F:CAGGGAGGCAAGG-ACAAGTT和rs1801019-R:AGCATCTGCTAGCTGCAA-CA。PCR扩增体系共30 μL,包括DNA模版1 μL、正反引物2 μL、PCR扩增缓冲液(含Mg2+、dNTP、Taq酶)15 μL,以及12 μL dH2O。PCR 反应条件:98 ℃预变性3 min,98 ℃扩增10 s,55 ℃退火保持15 s,72 ℃再延伸10 s,共扩增30个循环。实验由成都擎科梓熙生物技术有限公司完成。
1.6疗效评价标准 患者在接受mFolfox6化疗前均接受影像学检查,评估病情,3或4个周期后重新评估,影像学检查均采用RECIST疗效评价标准[14]。以(CR+PR)计算患者疾病治疗RR,以(CR+PR+SD)计算患者DCR。
1.7毒性评价标准 对于患者化疗过程中出现的毒性反应采用NCI-CTC4.0毒性评价标准[15]进行处理。
1.8统计学方法 采用SAS 9.2版软件进行数据的统计分析,患者基础信息与疗效、毒性反应分析采用方差分析和χ2检验或Fisher确切概率,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1UMPS基因测序结果 结果见图1和图2。峰型图以4种颜色代表A(绿色)、T(红色)、G(黑色)、C(蓝色)4种碱基。峰高低代表信号强弱,峰宽窄表示分离效果,双峰代表杂合。图1中高亮部分为单峰,表示是纯合子,图2中高亮部分为双峰,表示是杂合子。
2.2UMPS基因SNP的检测结果 70例晚期CRC患者,有5例血液样本提取DNA不合格,因此未纳入后续分析。最终检测到UMPS基因的rs1801019位点CC 0例(0%),GC 20例(30.80%),GG 45例(69.20%),G基因频率为84.6%,C基因频率为15.4%。
2.3UMPS基因的遗传平衡检验 对CRC患者的UMPS基因型频率进行遗传平衡检验,以检验研究患者的基因型是否具有群体代表性。由表1可知,以100个健康人为对照组,检测UMPS基因rs1801019位点的符合Hardy-Weinberg遗传平衡,结果GG66例(66.0%),GC30例(30.0%),CC4例(4.0%)。
2.4UMPS基因多态性与临床特征相关性 UMPS基因的rs1801019位点的SNP(Gvs.C)分布与性别、年龄、手术、TNM病理分期、原发病灶部位、转移、组织病理学类型分类以及肿瘤标志物CEA、CA19-9均无明显相关性(P>0.05)。具体结果见表1。
2.5UMPS基因多态性与毒性反应相关性 结果见表2。
2.6UMPS多态性与疗效反应相关性 UMPS基因的rs1801019位点野生型患者疾病控制率高于突变型患者,而疾病进展率低于突变型患者,但差异无统计学意义(P>0.05),结果见表3。
2.7UMPS基因多态性与PR、SD、PD之间相关性分析 选取用药第4个周期,肿瘤分期为4期的患者,共11例,设因变量为PD为0,SD为1,PR为2,纳入自变量为年龄,性别,基因型进行无序多分类逻辑回归进行关联分析,结果未见相关性,见表4。
3 讨论
由于肿瘤个体化治疗日益成熟,预测化疗引起的疗效和严重不良反应成为肿瘤患者选择最佳治疗方案时的重要关注点。多项研究已经在涉及氟嘧啶药效学的基因中发现SNPs,NCCN指南甚至建议对一些DPYD基因进行基因分型,以评估毒性风险[16]。
5-FU本身无抗肿瘤活性,需经体内的磷酸化酶转化成为其活性代谢产物。UMPS是5-FU活化过程中最重要的磷酸化酶,可将5-FU通过磷酸化转化为5-FU的活性代谢产物,通过抑制RNA和DNA合成产生抗肿瘤作用。在治疗过程中,UMPS的突变或异常表达可能导致5-FU耐药。因而UMPS酶基因多态性与5-FU敏感性密切相关[15]。从药物反应遗传学角度上分析CRC患者UMPS的基因多态性与化疗疗效和毒性之间的关系,具有深刻的意义。
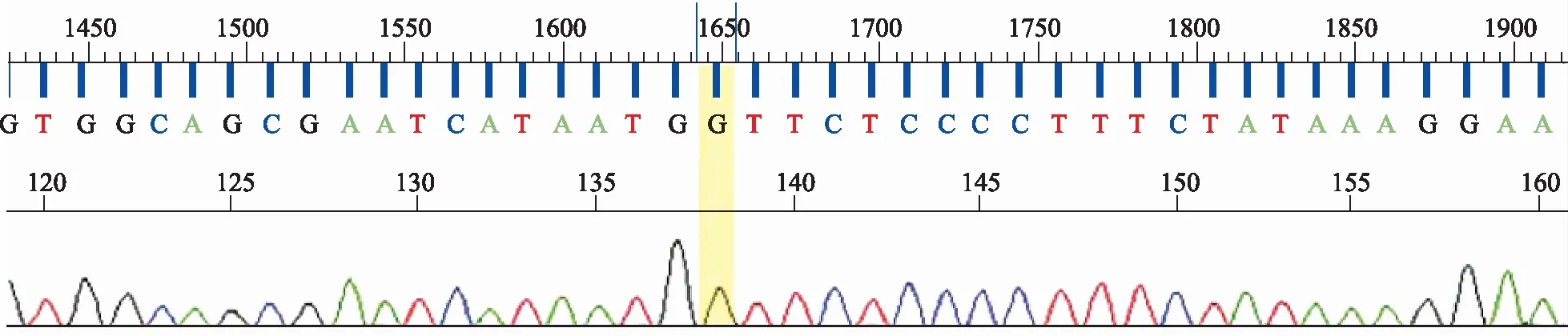
图1 UMPS rs1801019位点GG纯合型测序图谱(正向测序)
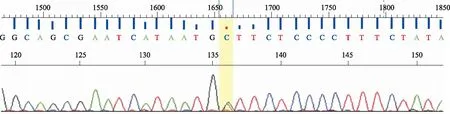
图2 UMPS rs1801019位点GC杂合型测序图谱(正向测序)
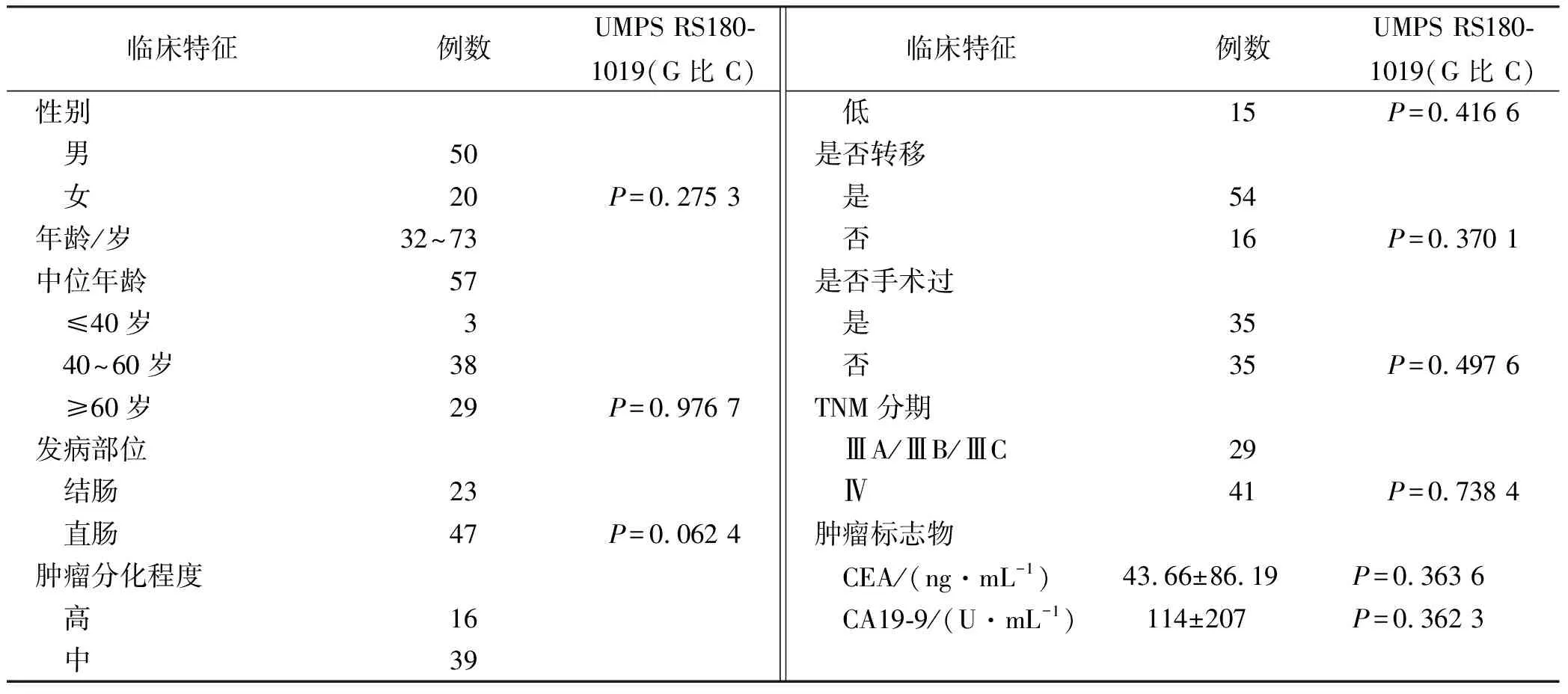
表1 CRC患者UMPS rs1801019位点多态性与临床病理关系
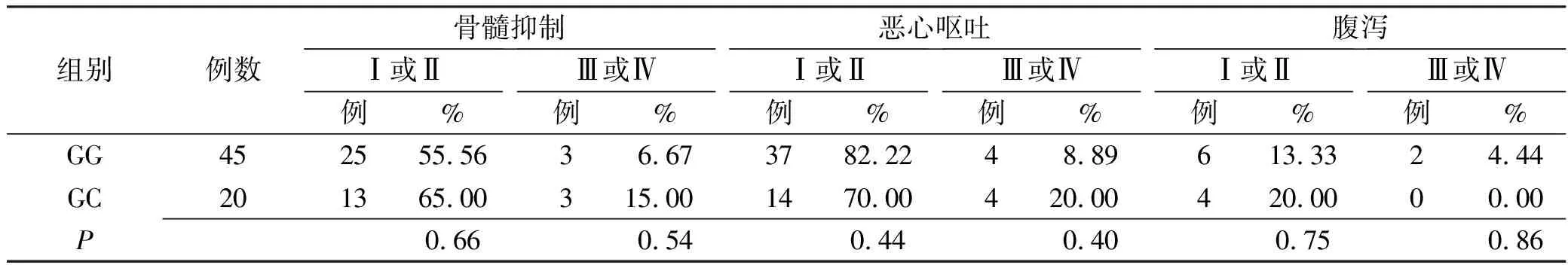
表2 UMPS基因RS1801019位点基因多态性与毒性反应关系
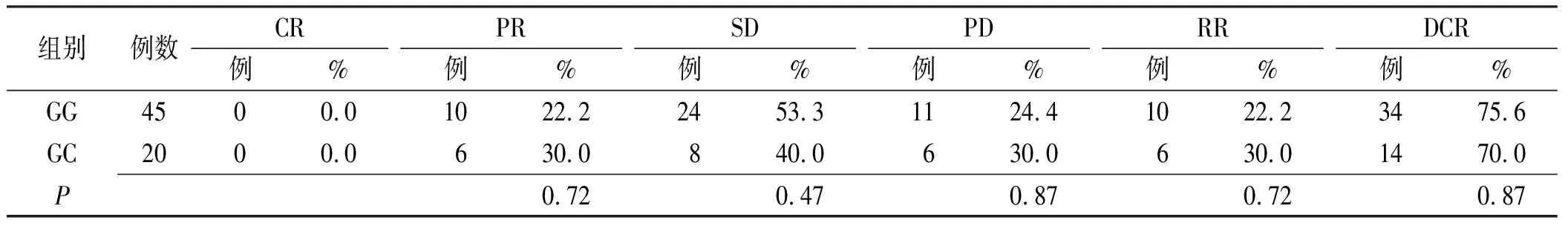
表3 CRC患者UMPS rs1801019位点基因多态性与疗效反应关系
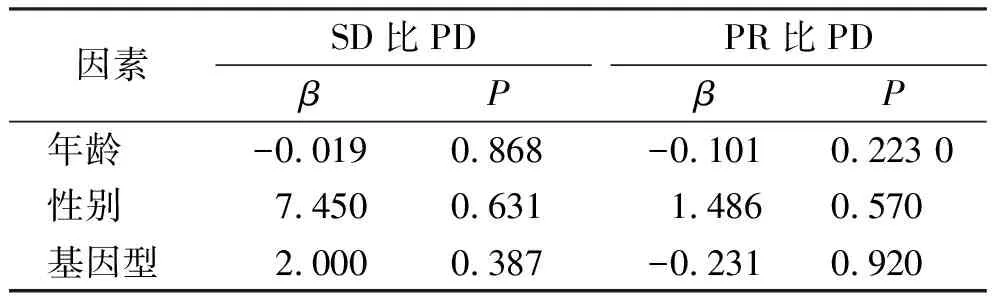
表4 CRC患者UMPS rs1801019基因多态性与PR、SD、PD之间的相关性分析
UMPS rs1801019位点在亚洲人群中突变率高,约为22%(https://www.snpedia.com/index.php/Rs1801019),以前较少报道过此位点基因多态性与5-FU疗效和毒性风险之间的联系,且结果并不一致。研究发现,UMPS的表达水平与5-FU的敏感性具有相关性,通过降低UMPS的表达,5-FU的敏感性明显下降[18]。但目前笔者未见中国人群该基因多态性的研究,因此本研究主要针对中国人群的UMPS rs1801019位点基因多态性与5-FU疗效和诱导毒性风险之间的联系进行研究。
本研究显示,中国人群UMPS基因的rs1801019位点多态性与性别、年龄、手术、TNM病理分期、原发病灶部位、转移、组织病理学类型分类以及肿瘤标志物CEA、CA19-9等临床基础数据均无明显相关性(P>0.05)。rs1801019位点野生型患者疾病控制率高于突变型患者,而疾病进展率低于突变型患者,但皆差异无统计学意义(P>0.05)。rs1801019位点野生型和突变型患者骨髓抑制、恶心呕吐和腹泻发生率差异无统计学意义(P>0.05),表明在中国人群中rs1801019无法单一用于5-FU为基础治疗的疗效和不良反应的指导。强烈建议监测其他代谢酶基因多态性来共同预测5-FU的疗效和毒性。但阴性结果原因可能与本研究的样本量有关,还需扩大样本量,进一步研究其真正的因果变异。

