大黄酸对糖尿病肾病的作用及其机制研究进展*
刘琪文,杨德智,杨秀颖,吕扬,杜冠华
(北京协和医学院中国医学科学院药物研究所1.晶型药物研究北京市重点实验室;2.药物靶点研究与新药筛选北京市重点实验室,北京 100050)
糖尿病肾病(diabetic nephropathy,DN)是1型和2型糖尿病的微血管并发症,也是慢性肾脏病和终末期肾病的主要病因[1]。在全球范围内,部分世界区域DN发病率呈上升趋势[2]。中国DN的总患病率占糖尿病患者占21.8%,表现出地域和性别差异[3]。在许多国家,糖尿病造成大于40%终末期肾病,是导致肾衰竭主要原因之一[4]。目前临床上治疗DN的药物主要是降压、降血糖药物[5],而针对DN发病机制的药物正处于临床试验阶段,其中一些药物临床试验中疗效欠佳,不良反应严重[6]。对于目前临床无治疗DN特效药的情况,来源于天然且有一定特色和优势的中药及中药提取物为临床提供更多选择。中医专家赵进喜教授常用熟大黄治疗DN[7],大黄的利尿解毒化瘀等功能可用于治疗DN[8]。随着对DN的深入研究发现,作为大黄主要提取物的大黄酸对DN有潜在的治疗作用,其作用方式是多靶点多途径的综合结果,如改善糖脂代谢紊乱,减少炎症反应、氧化性应激等[9-10]。因此,本研究总结近年国内外对大黄酸在DN方面药理及作用机制的实验研究并进行详细阐述,分析大黄酸对DN的治疗前景。
1 降血糖和降血脂
DN是糖尿病的一种慢性并发症,长期高血糖会使各种代谢物,包括高级糖基化终产品和活性氧化物都受到刺激,引起肾脏代谢紊乱和血流动力学改变,加重DN进展。因此,降低机体血糖和血脂水平可以阻止DN的恶化,改善肾脏和肾功能的损害。研究表明,大黄酸可以改善血糖血脂的代谢紊乱,降低高糖高脂对肾脏组织的损伤。研究者们前期探索大黄酸对糖尿病的治疗作用,结果表明大黄酸均可使糖尿病小鼠的血糖、总胆固醇(CHOL)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)降低[11-12]。已研究发现,激活过氧化物酶体增殖物激活受体γ(PPAR-γ)配体可增强葡萄糖转运蛋白4(GluT-4)的表达,促进脂肪组织摄取葡萄糖,提高胰岛素敏感性[13-14]。在对大黄酸调节糖代谢和脂代谢作用机制进一步阐释中,ZHANG等[15]发现大黄酸还可通过抑制脂质代谢关键PPAR-γ信号通路,进而降低db/db小鼠的血脂和空腹血糖。李柯等[16]发现大黄酸通过抑制蛋白酪氨酸磷酸酶1B活性增强胰岛素信号通路,改善脂糖代谢紊乱。
2 保护胰岛细胞、足突细胞和系膜细胞
研究发现,大黄酸可以保护分泌胰岛素的胰岛细胞,肾超滤作用的足细胞和维持肾小球毛细血管网结构完整性和调节肾小球滤过率的系膜细胞,这些细胞在DN中发挥重要作用。胰岛细胞在DN发病及发展过程中起关键作用,胰岛β细胞分泌的胰岛素对DN有保护作用[17]。胰岛移植可以使早期DN大鼠血糖下降,尿蛋白和肾小球基底膜的厚度降低,改善肾小球滤过屏障结构等多种方式治疗DN[18]。研究发现,大黄酸可以通过保护胰岛细胞降低机体血糖,保护肾组织,改善DN病症,减轻高糖状态对肾脏组织的进一步破坏。杜宏等[19]用大黄酸对db/db小鼠干预后的实验结果发现,小鼠早期胰岛素分泌恢复,胰岛β细胞的凋亡减少。LIU等[20]发现大黄酸通过抑制高糖引起的Drp1表达、恢复线粒体的数目和形态,保护胰岛细胞并减少胰岛β细胞的凋亡,促进胰岛素分泌以使血糖降低。
研究发现,糖尿病肾病患者中足细胞损伤后会发生肥大、脱离、凋亡等一系列变化,足细胞的损伤及相关蛋白的改变,最终会破坏肾小球滤过作用,导致蛋白尿和肾小球纤维化[21-22]。在对大黄酸治疗DN作用研究中发现,大黄酸可以通过增加足细胞的肾病蛋白(Nephrin)表达保护足细胞,减轻DN症状。陈建伟等[23]用大黄酸给高糖高脂加链脲佐菌素(STZ)饮食诱导的糖尿病大鼠干预,发现足细胞Nephrin蛋白的表达增加。DUAN等[24]用大黄酸对db/db小鼠干预后发现大黄酸可以抑制wnt/β-catenin信号通路,增加足细胞肾病蛋白的表达,以减少蛋白尿的排泄和修复高糖诱导的足细胞损伤。
系膜细胞维持肾小球毛细血管网的结构,调节肾小球功能,是肾部滤过作用的关键细胞,保护DN患者的系膜细胞,可以改善滤过作用,降低蛋白尿,减轻肾部损伤[25-26]。XU等[27]用大黄酸对高糖培养的大鼠肾系膜细胞进行干预发现,大黄酸可以通过上调bax,caspase-3及其相关蛋白的基因表达,使细胞周期停滞在G1并诱导细胞凋亡的机制,从而抑制高糖诱导的系膜细胞增殖和细胞外基质(ECM)的表达。段淑芳等[28]在探讨大黄酸对肾脏保护作用的实验中发现,高糖状态可使大鼠的系膜细胞凋亡率上升,而大黄酸可以抑制系膜细胞的凋亡,且存在剂量依赖关系,进而降低糖尿病大鼠蛋白尿,保护肾组织,改善肾脏病理损伤。
3 降低肾内转化生长因子活性,改善肾部病变
DN是一种糖尿病综合征,其主要临床表现为:出现微量或大量蛋白尿,肾小球基底膜增厚、肾小球硬化、肾间质纤维化等肾部形态学的改变,使得肾小球滤过作用降低,导致肾功能不全[6]。在DN发病机制中,转化生长因子-β1(TGF-β1)可以调控肾脏细胞外基质蛋白的合成,使肾小管间质纤维化和肾小球硬化。血管和肾细胞中葡萄糖可以通过己糖胺途径,刺激生成TGF-β1以促使肾脏细胞肥大、ECM沉积,并最终造成肾小球硬化,导致DN的进行性发展[29-30]。
研究发现大黄酸通过降低肾内TGF-β1活性,抑制TGF-β1/Smad信号通路,减轻肾间质纤维化,抑制肾小管上皮细胞的凋亡,减少ECM沉积,改善肾部病变。前期研究[12,31]发现大黄酸可以抑制TGF-β1mRNA的高表达,直接减少TGF-β1的合成,或通过抑制己糖胺通路异常活化和GluT1的产生,上调糖尿病大鼠肾皮质PPARγ来间接抑制减少TGF-β1的产生。在大黄酸对DN作用机制的进一步研究中,研究人员用蛋白印迹法检测到大黄酸可以明显抑制糖尿病大鼠肾组织中TGF-β1/Smad3信号通路的表达,明显改善肾组织病变,减轻肾间质纤维化,改善肾脏功能[32-33]。阳嘉仪等[34]发现大黄酸可通过下调DN大鼠的肾小管上皮细胞IKL/Snail信号通路抑制皮间质转化(EMT)过程,其中IKL为整合素连接激酶,是TGF-β1/Smad信号通路的关键因子,IKL可以启动Snail的表达。周珊珊等[35-36]发现大黄酸可以通过抑制肾小管上皮细胞的凋亡与EMT,产生抗肾脏纤维化的效果。大黄酸通过减低TGF-β的活性阻止DN的进行性发展,为DN的治疗提供新靶点和新策略。
4 抗炎作用
体外和病理实验发现,炎症是DN的主要发病机制[37]。糖尿病患者机体的代谢紊乱及血流动力学的变化可以激活肾脏中的炎症反应及通路。作用于炎症通路的药物可以更有效地阻断肾脏的损害,是治疗DN的新靶点和新策略[38-39]。研究发现,大黄酸可以通过抑制炎症过程中TGF-β1、趋化因子MCP-1、NF-κB因子方式抑制肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1β、一氧化氮(NO)、IL-6炎症因子的表达,以保护胰腺细胞和改善肾组织病变。段淑芳等[28,40]用不同剂量大黄酸对STZ诱导的糖尿病大鼠干预,实验发现中、大剂量大黄酸可以降低炎症因子TNF-α、IL-1β的表达保护胰腺细胞。用大黄酸干预高糖诱导的大鼠肾脏系膜细胞,发现大黄酸可以通过调控TGF-β1及单核细胞趋化因子MCP-1的表达,从而减少炎症反应。黄淼等[41-42]通过体内外实验发现大黄酸可以通过抑制炎症反应中关键的NF-κB信号通路,发挥抗炎作用,减缓DN的病程进展。
5 抗氧化应激
研究发现,氧化应激是DN的重要发病机制之一[43]。机体长期处在高糖环境中引发多种并发症都有一个共同的发病机制即氧化应激,氧化应激可能会使糖尿病患者机体增加胰岛素抵抗、降低葡萄糖耐受性、激发炎症反应损坏细胞[44]。抑制氧化应激过程的药物更针对性地减轻高糖对肾脏的损害,是治疗DN的新靶点和新策略。研究发现大黄酸通过抑制抗氧化酶、抑制还原型辅酶Ⅱ(NADPH)氧化酶方式,降低体内ROS等过氧化物质,来抑制组织细胞的氧化应激作用,对胰岛功能和肾脏组织细胞产生保护作用。黄淼等[41]应用大黄酸对db/db小鼠干预后,小鼠胰腺内氧化应激损伤标志物8-OHdG表达下降、氧化应激损伤得到抑制。黄娟等[45]发现大黄酸可以下调NADPH氧化酶亚基p22phox及p47phoxmRNA的表达,抑制大鼠肾组织的氧化性应激反应。ZHONG等[46]用大黄酸对人脐静脉内皮细胞进行干预,发现MDA和乳酸脱氢酶降低,抗氧化酶如一氧化氮合酶(NOS)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-PX)活性增加且有剂量依赖,产生抗氧化作用性。实验还表明大黄酸通过抑制Bid和caspase-3、-8和-9 mRNA的表达,减少由过氧化氢(H2O2)引起的ROS产生和内皮细胞凋亡。WU等[47]发现大黄酸可以抑制TGF-β1诱导上皮间质转化过程,通过激活SIRT3/FOXO3a信号通路抑制氧化应激反应,对切除5/6肾而引起的慢性肾损伤有保护作用,其可以减少肾间质病理损伤,减少胶原纤维,改善肾功能。
依据大黄酸对DN的体内外实验研究,DN的发病机制及大黄酸治疗DN的作用机制见图1和图2。
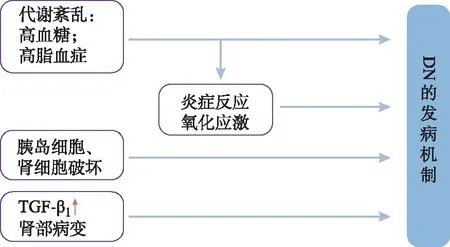
图1 DN的发病机制
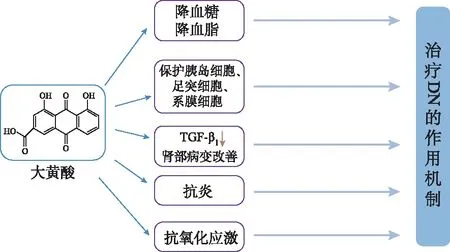
图2 大黄酸治疗DN 的作用机制
6 讨论与展望
综上所述,大黄酸对DN的治疗作用是多靶点多途径的综合结果。目前临床上DN的主要治疗药物为降压降血糖药物,与现有治疗药物不同的是,大黄酸可通过抑制PPAR-γ信号通路和GluT-4的表达,提高胰岛素敏感性,改善血糖血脂的代谢紊乱;保护在DN中发挥关键作用的胰岛细胞、足突细胞和系膜细胞;降低TGF-β1活性抑制肾间质纤维化和肾小管上皮细胞凋亡、减少ECM沉积等改善肾部病变,通过抗炎作用和抗氧化性应激,减少肾间质损伤等综合药理作用及机制治疗DN,改善肾功能。与其他药物比较,大黄酸对DN的作用是针对于DN本身的发病机制,更有针对性。通过多靶点的治疗作用,不仅可以降低体内血糖从源头阻止患者疾病的进一步恶化;还可以改善病症及保护发病部位的细胞等多种方式,改善患者机体状况。
然而,大黄酸生物利用度较低,成为其进一步开发的主要限制因素之一,目前已有多种改善其生物利用度低的新技术,如对大黄酸结构进行修饰、与水溶性好、低毒材料制成RH-LMWC共聚物、β-环糊精-大黄酸偶联物、肾脏靶向性的大黄酸生物降解纳米颗粒、大黄酸纳米聚合物、大黄酸和L-精氨酸共晶物等方式[48-51],其中共晶技术是可以在保证药物稳定性的同时有效地改善药物的理化性质。药物共晶是由活性药物分子和共晶配体组成,相比于其他技术,药物共晶技术具有极大的配体选择空间[52-53],对改善大黄酸生物利用度具有良好的研发前景,以期制备缓释、长效、低毒的大黄酸衍生物来治疗DN,故可用共晶技术筛选合适配体研制大黄酸共晶物,更高效地改善大黄酸的生物利用度。目前已通过体内体外实验证明大黄酸对DN有治疗作用,但需要加强大黄酸的临床作用、使用剂量、使用剂型等方面的研究,加快大黄酸治疗DN的研究进程。

