鞣酸对异丙肾上腺素诱导小鼠心肌肥厚的抑制作用*
厉博文,屈鑫亮,司明东,李菁,马东来,2
(1.河北中医学院药学院,石家庄 050200;2.河北省中药组方制剂技术创新中心,石家庄 050091)
药理研究表明,多种心血管疾病,如心肌梗死、心肌病、高血压等均表现出心肌肥厚的特征[1]。心肌肥厚是心脏代偿功能改变发生的心肌形态结构变化,其病理生理过程涉及许多生物因子,包括氧化应激的增加、神经激素的过度激活、炎症因子的增加和非选择性β-肾上腺素受体(β-AR)激活等。其中,非选择性β-AR激活是形成心肌肥厚的重要因素之一[2]。动物实验研究表明,持续使用β-AR激动剂异丙肾上腺素(isoproterenol,ISO)可诱发心脏炎症和心肌细胞肥厚[3-4]。实验动物皮下注射ISO,可快速形成心肌肥厚的病理特征,模拟心血管疾病早期阶段的病理状态。而长期病理性心肌肥厚可导致细胞间肌纤维和血管周围纤维化[5]。心肌纤维化常为心血管系统疾病终末期的病理表现,可导致心力衰竭、心律失常及心源性猝死等[6]。Toll样受体(Toll-like receptor 4,TLR4)是与心血管疾病的发生和发展密切相关,核转录因子(NF-κB)为引起心肌肥厚的刺激因子之一[7],两者间存在着紧密联系,王纪文等[8]发现在鼠肥厚的左室心肌细胞中,TLR4与NF-κB表达同时增高,当抑制NF-κB表达时,TLR4的表达降低。鞣酸(tannic acid,TA)是一类来源植物的水溶性多酚类化合物,广泛分布于谷物、水果、中药、茶叶和红酒等[9],具有抗脂过氧化、抗炎、抗肿瘤等药理活性[10-11]。前期实验[12]曾采用苏木精-伊红(HE)染色、免疫组织化学法、免疫印迹法(Western blotting,WB)技术等测定TA对ISO诱导小鼠心肌纤维化的作用机制,发现TA可以降低ISO诱导的小鼠心肌细胞中TLR4、p38、NF-kB (p65)蛋白的表达水平。目前文献多数报道TA对心肌损伤的保护作用[13],然而对TA抑制心肌肥厚的文献报道较少。因此,笔者在本实验旨在探讨TA是否通过TLR4/NF-κB信号通路减轻ISO诱导的小鼠心肌肥厚症状,为TA临床应用提供实验依据,为心血管疾病早期阶段病理性心肌肥厚的有效防治提供药物来源。
1 材料与方法
1.1实验动物 50只雄性昆明种小鼠,体质量20~22 g,由河北医科大学实验动物学部提供,于河北中医学院实验动物中心清洁级动物实验室饲养,实验动物生产许可证号:SCXK(冀)2018-004,实验动物使用许可证号:SYXK(冀)2017-005。小鼠饲养环境条件:室温(22~24 ℃)、相对湿度40%~70%,明暗交替为12 h,自由饮水摄食。
1.2药品与试剂 TA(Sigma-Aldrich公司,批号:V900190-100G,含量>98%);ISO(Cayman Chemicals公司,批号:I0600000,含量>99%);普萘洛尔(Afar Sally公司,批号:H26645,含量>98.5%);苏木精(Solarbio公司,批号:H8070);山羊血清(Solarbio公司,批号:SL038);DAB显色液(Solarbio公司,批号:DA1010);TLR4(ABclonal公司,批号:A5258);NF-κB p65(Wanleibio公司,批号:WL01980);HRP标记山羊抗兔IgG(thermo Fisher公司,批号:#31460);二甲苯、过氧化氢、无水乙醇曙红Y(醇溶)等均为国产分析纯。
1.3仪器 RM2235型石蜡切片机(Leica公司);DP73型显微镜拍照系统(OLUMPUS公司);QH01-9030A型电热恒温鼓风干燥箱(上海精宏实验设备公司);DH36001B型电热恒温培养箱(天津泰斯特公司);Chemi Doc Touch化学发光凝胶成像系统(Bio-Rad公司)。
1.4实验分组与给药 50只昆明小鼠按照随机数字表法分为5组,分别为空白对照组、模型对照组、普萘洛尔组、TA小剂量组和TA大剂量组,每组10只。参照文献[14-15]方法,将ISO和TA分别溶于无菌0.9%氯化钠溶液中,除空白对照组外,其他组每天皮下注射ISO10 mg·kg-1,空白对照组则每天皮下注射相同体积无菌0.9%氯化钠溶液;普萘洛尔组每天腹腔注射普萘洛尔10 mg·kg-1·d-1,TA小剂量组和TA大剂量组每天分别腹腔注射20,40 mg·kg-1·d-1TA溶液,空白对照组和模型对照组每天分别腹腔注射相同体积无菌0.9%氯化钠溶液,连续给药14 d。每天称取质量,并计算体质量增加情况。
1.5取材与心脏质量指数(HMI)测定 给药结束后,停止给予饲料,自由饮水12 h。记录小鼠体质量(BW),小鼠腹腔注射0.5%戊巴比妥钠45 mg·kg-1,在室温下眼眶收集血液,在3000 r·min-1(r=10 cm)条件下离心,取上层血浆保存于-20 ℃冰箱。操作时将心脏快速分离,并用冰0.9%氯化钠溶液清洗,去除多余组织,然后,用滤纸吸干表面水分,测定心脏质量(HW),保存于-80 ℃冰箱或用10%多聚甲醛进行固定,待用。计算HMI[16],HMI=HW/BW。
1.6TTC染色观察心肌梗死面积(myocardial infarction size,MIS) 以TTC染色的方法测定MIS,先将小鼠心脏分离,用0.9%氯化钠溶液冲洗,去除心房和右心室,置于-20 ℃的冰箱中,20 min后取出,沿房室沟的平行方向,将左心室切成厚度约0.2 mm的组织切片,得切片5片,置于37 ℃条件下0.2%TTC磷酸缓冲液(pH为7.4)中,水浴加热20 min后,以0.9%氯化钠溶液冲洗,去除切片表面TTC磷酸缓冲液,再置于4%甲醛溶液中,固定24 h,增强染色效果。最后,染色切片摄像,应用BI-2000图像分析仪计算MIS占心肌片总面积的百分比。MIS百分比(%)=(MIS/心肌片总面积)×100。
1.7HE染色观察心脏组织变化 将小鼠心脏从多聚甲醛固定液中取出,依次经过乙醇梯度脱水、石蜡包埋后切片、切片脱蜡和二甲苯透明处理,采用常规HE染色的方法进行切片染色,在光学显微镜下观察心脏组织学变化。
1.8免疫组化实验 制备小鼠心脏石蜡切片,依次经过常规脱蜡、洗片、冲洗、修复抗原、冲洗、加过氧化氢液、冲洗、加封闭液和冲洗处理,然后分别加兔抗大鼠TLR4(1:1000)、NF-κB(p65)(1:3000),且37 ℃、40 min反应、冲洗、SABC法染色后,显微镜观察染色效果。使用DP73 OLUMPUS型显微镜摄像系统随机记录5张心脏图像,并应用Las-version 4.2病理图像分析系统观察发现TLR4、NF-κB(p65)的蛋白表达位置及平均吸光度值。
1.9酶联免疫吸附测定法(ELISA)测定吸光度 按照ELISA试剂盒说明书方法,将样品置于96孔反应板中,空白对照组、模型对照组、普萘洛尔组、TA小剂量组和TA大剂量组分别加入血清样品50 μL,分别吸取肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-6和IL-1β抗体10 μL,加入96孔反应板中,依次经过孵育、洗板、显色液显色等操作,于波长450 nm处,应用全自动酶标仪测定吸光度,并计算样品浓度。

2 结果
2.1HMI的测定结果 空白对照组HMI值为(4.92±0.09) mg·g-1,模型对照组HMI值为(5.99±0.33) mg·g-1,普萘洛尔组HMI值为(5.51±0.38) mg·g-1,TA小剂量组HMI值为(5.91±0.22) mg·g-1,TA大剂量组HMI值为(5.83±0.33) mg·g-1。模型对照组HMI值显著高于空白对照组(P<0.01),表明已建立小鼠心肌肥厚的模型。与模型对照组比较,TA大剂量组和TA小剂量组HMI值虽然降低,但差异无统计学意义(t=-7.56,P>0.05),表明小、大剂量TA虽然具有一定的阻抑心肌肥厚作用,但作用效果不如普萘洛尔组显著。
2.2TTC染色观察心肌梗死情况 TTC染色结果见图1。样品均未出现明显的心肌梗死,但从图1中可以看出普萘洛尔组、TA小剂量组和TA大剂量组心脏组织均比模型对照组有变小趋势。
2.3组织学观察结果 见图2。空白对照组小鼠心脏大小正常,心肌细胞结构清晰可见;与空白对照组比较,模型对照组心肌细胞排列紊乱,心肌细胞间隙明显增宽,心肌纤维和细胞质出现溶解现象;与模型对照组相比,TA大剂量组和TA小剂量组心肌细胞排列趋于正常,细胞间隙变小,其中TA大剂量组变化明显,心肌纤维排列较为整齐,心肌肥厚程度明显改善。
2.4NF-κB(p65)和TLR4的表达 采用免疫组织化学染色法测定NF-κB(p65)(图3)、TLR4(图4)的蛋白水平。实验结果显示,与空白对照组比较,模型对照组NF-κB(p65)、TLR4蛋白水平明显增加(P<0.01);与模型对照组比较,普萘洛尔组、TA大剂量组和TA小剂量组心肌组织中NF-κB(p65)、TLR4蛋白水平均显著降低(P<0.01)。
2.5TNF-α、IL-6和IL-1β含量 TNF-α、IL-6和IL-1β含量结果见图5。实验结果显示,与空白对照组比较,模型对照组血清中TNF-α、IL-6和IL-1β含量升高,说明心肌肥厚的形成伴有炎症因子的激活(P<0.01);与模型对照组比较,TA大剂量组、TA小剂量组和普萘洛尔组都能够降低心肌肥厚小鼠血清中TNF-α、IL-6和IL-1β水平,其中TA大剂量组效果优于TA小剂量组。

A.空白对照组;B.模型对照组;C.普萘洛尔组;D.TA小剂量组;E.TA大剂量组。

A.空白对照组;B.模型对照组;C.普萘洛尔组;D.TA小剂量组;E.TA大剂量组。
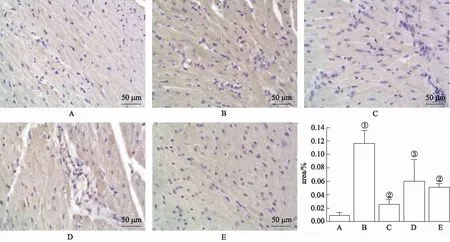
A.空白对照组;B.模型对照组;C.普萘洛尔组;D.TA小剂量组;E.TA大剂量组。①与空白对照组比较,t=-9.36,P<0.01;②与模型对照组比较,t=7.18,7.39,P<0.01;③与模型对照组比较,t=5.99,P<0.05。
3 讨论
心肌肥厚是冠心病、心肌梗死等多种心血管疾病的共同病理过程[17],因此,寻找预防或改善心肌肥厚的药物是防治老年心血管疾病的关键途径之一。
笔者在文献[18]小鼠心肌肥厚模型基础上进行改良,即每天分两次小剂量皮下注射ISO,提高小鼠的耐受力和成活率。皮下注射ISO 14 d后小鼠心脏病理学结果显示,模型对照组小鼠心脏全心质量指数明显升高,HE染色结果显示心肌细胞排列紊乱,心肌细胞间隙明显增宽。此外,本研究参考心肌肥厚患者的临床检测方法[19],采用免疫组织化学染色法,对实验小鼠中NF-κB(p65)、TLR4蛋白进行定性、定位和定量的检测[20]。免疫组化结果显示心肌组织胶原含量明显增加,以上实验结果均表明ISO诱导的心肌肥厚形成。TTC染色结果显示,注射ISO(10 mg·kg-1·d-1)在2周内小鼠已经形成心肌肥厚,但未出现心肌梗死。
TA具有抗氧化、抗炎和抗肿瘤等药理活性,广泛应用于医药、食品和保健品等领域。本实验结果显示,腹腔注射不同剂量TA 2周后小鼠HMI有所下降,心肌组织HE染色和免疫组化结果显示TA能明显改善心肌组织形态和减少胶原沉积,说明TA能够减轻ISO诱导的心肌肥厚。
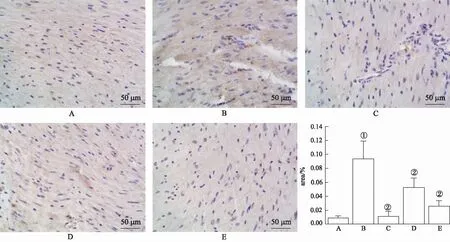
A.空白对照组;B.模型对照组;C.普萘洛尔组;D.TA小剂量组;E.TA大剂量组;①与空白对照组比较,t=-3.83,P<0.01;②与模型对照组比较,t=3.02~3.79,P<0.01。

A.空白对照组;B.模型对照组;C.普萘洛尔组;D.TA小剂量组;E.TA大剂量组。①与空白对照组比较,t=-14.10~-6.62,P<0.01;②与模型对照组比较,t=1.77~1.83,P<0.05;③与模型对照组比较,t=3.42~10.06,P<0.01。
研究表明,在机体长期处于应激状态下,可激活TLR4,从而导致TNF-α、IL-6和IL-1β等黏附因子和炎症介质的释放增加。NF-κB作为心肌肥厚刺激因子的下游靶点,可以进一步诱导TNF-α、IL-6和IL-1β等炎症因子的产生与释放,产生的部分炎症因子使NF-κB继续活化,加重炎症反应[21-22];因此TLR4和NF-κB的过度表达与心肌肥厚严重程度密切相关。TLR4与NF-κB之间存在密切关系,NF-κB信号通路为TLR4信号通路下游的关键转录因子[23]。它的激活与TLR4信号通路的激活有关[24]。实验研究发现,模型对照组小鼠血清中TNF-α、IL-6和IL-1β的含量显著增加,免疫组化显示心肌中TLR-4和NF-κB(p65)的表达水平显著升高,经过不同剂量TA处理后,以上检测指标都有不同程度降低,说明TA减轻或治疗心肌肥厚的作用机制可能与TLR-4/NF-κB信号通路有关。

