马来酸罗格列酮对2 型糖尿病治疗的药学分析
程秋敏,刘江建
福建省立医院药学部,福建福州 350001
糖尿病作为高发性、 危害性较大的内分泌系统疾病类型之一,多见于老年人、肥胖、家族病史等人群中,患者普遍伴有心血管疾病、神经系统损害、眼部损害等严重并发症, 这些并发症与长期高血糖状态未控制密切相关,因此需及早防治[1]。 临床糖尿病治疗尚无特效药物,需用药控制。 研究提出,机体胰岛素分泌缺陷、胰岛素抵抗是2 型糖尿病主要病因[2]。马来酸罗格列酮属于胰岛素增敏剂药物, 有利于增强外周组织对胰岛素的敏感性,发挥血糖控制效果。为评估马来酸罗格列酮的临床应用价值, 该次研究选取2020 年6 月—2021 年6 月2 型糖尿病患者84例为研究对象展开对比研究,现报道如下。
1 资料与方法
1.1 一般资料
选取84 例老年2 型糖尿病患者为研究对象。纳入标准:①与中国2 型糖尿病防治指南(2013 年)中诊断标准相符; ②空腹血糖≥7.0 mmol/L, 随机血糖≥11.1 mmol/L;③病例资料真实可靠、完整。 排除标准:①存在不同程度的意识缺失、严重精神障碍;②入组近期(1 个月)已接受有关降糖药物治疗;③心肝肾等脏器病变。 该研究经医院医学伦理委员会核准,患者知情同意并签署文件。将所有研究对象根据系统抽样法分为对照组(n=42)和观察组(n=42)。对照组:男、女分别为24 例、18 例;年龄42~79 岁,平均(65.63±4.05)岁;病程3~21 年,平均(12.56±3.41)年。 观察组:男、女分别为26 例、16 例;年龄40~81 岁,平均(66.87±4.58)岁;病程2~20 年,平均(11.96±3.58)年。 两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
对照组:应用盐酸二甲双胍(国药准字H33020526;规格:0.5 g)治疗,口服用药,3 次/d,剂量为0.5 g/次,持续给药3 个月。
观察组: 对照组用药基础上联合马来酸罗格列酮(国药准字H20020475;规格:4 mg×7 片)治疗,口服用药,1 次/d,用药剂量为4 mg。 持续用药3 个月。
1.3 观察指标
①血糖水平:使用全自动生化仪测定,指标有空腹血糖(FPG)、餐后2 h 血糖(2 hPG)、糖化血红蛋白(HbA1c)[3]。
②于治疗前后,采集外周血,以3 000 r/min 离心处理30 min 取得血清,利用全自动生化分析仪测定总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)[4]。
③胰岛功能:通过已糖酶激酶、高压液相法,根据相关计算公式胰岛素抵抗指数(HOMA-IR)。
④炎症因子水平:于治疗前后,采集外周血,离心后取得血清, 利用酶联免疫吸附法测定白介素(IL-6)、肿瘤坏死因子(TNF-α)水平[5]。
⑤观察患者用药不良反应发生情况, 并统计总发生率:包括恶心呕吐、腹痛、便秘等。
1.4 统计方法
采用SPSS 23.0 统计学软件处理数据,计量资料符合正态分布,以(±s)表示,组间差异比较采用t检验;计数资料以频数和百分率(%)表示,组间差异比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者血糖指标比较
两组治疗后血糖指标较同组治疗前均明显下降, 且观察组FPG、2 hPG、HbA1c 值较对照组显著低,差异有统计学意义(P<0.05)。 见表1。
表1 两组患者血糖指标比较(±s)
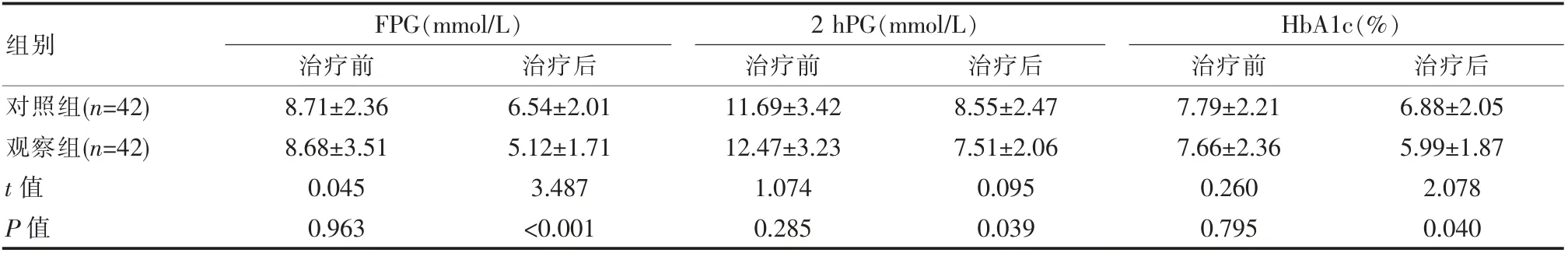
表1 两组患者血糖指标比较(±s)
组别FPG(mmol/L)治疗前 治疗后2 hPG(mmol/L)治疗前 治疗后HbA1c(%)治疗前 治疗后对照组(n=42)观察组(n=42)t 值P 值8.71±2.36 8.68±3.51 0.045 0.963 6.54±2.01 5.12±1.71 3.487<0.001 11.69±3.42 12.47±3.23 1.074 0.285 8.55±2.47 7.51±2.06 0.095 0.039 7.79±2.21 7.66±2.36 0.260 0.795 6.88±2.05 5.99±1.87 2.078 0.040
2.2 两组患者血脂指标比较
观察组治疗后TC、TG、LDL-C 指标较对照组显著低,HDL-C 指标更高, 差异有统计学意义 (P<0.05)。 见表2。
表2 两组患者血脂指标比较[(±s),mmol/L]

表2 两组患者血脂指标比较[(±s),mmol/L]
组别TC治疗前 治疗后TG治疗前 治疗后LDL-C治疗前 治疗后HDL-C治疗前 治疗后对照组(n=42)观察组(n=42)t 值P 值6.78±1.16 6.82±1.15 0.158 0.874 5.39±0.82 4.76±0.75 3.674<0.001 2.76±0.62 2.78±0.63 0.146 0.883 2.19±0.56 1.76±0.46 3.845<0.001 3.86±0.75 3.76±0.68 0.641 0.523 3.16±0.65 2.47±0.53 5.331<0.001 0.93±0.22 0.92±0.24 0.199 0.842 1.28±0.26 1.46±0.22 3.425 0.001
2.3 两组患者胰岛素抵抗指数比较
两组治疗后HOMA-IR 较治疗前明显改善,且观察组HOMA-IR 水平较对照组更低, 差异有统计学意义(P<0.05)。 见表3。
表3 两组患者胰岛素抵抗指数比较(±s)

表3 两组患者胰岛素抵抗指数比较(±s)
组别对照组(n=42)观察组(n=42)t 值P 值治疗前 治疗后3.51±0.62 3.42±0.58 0.687 0.949 3.22±0.76 2.21±0.55 6.977<0.001
2.4 两组患者炎症因子水平比较
经治疗后, 观察组IL-6、TNF-α 水平均显著低于对照组,差异有统计学意义(P<0.05)。 见表4。
表4 两组患者炎症因子水平比较(±s)

表4 两组患者炎症因子水平比较(±s)
组别IL-6(ng/L)治疗前 治疗后TNF-α(μg/L)治疗前 治疗后对照组(n=42)观察组(n=42)t 值P 值33.63±5.22 32.52±5.62 0.976 0.331 26.62±4.63 21.29±3.98 5.187<0.001 2.71±0.62 2.62±0.58 0.687 0.494 1.39±0.33 1.03±0.21 5.964<0.001
2.5 两组患者不良反应发生率比较
两组不良反应发生率比较, 差异无统计学意义(P>0.05),经处理后均消失。 见表5。

表5 两组患者不良反应发生率比较
3 讨论
对于2 型糖尿病患者而言, 长时间血糖异常升高容易损害肾功能、眼部、重要器官等,引起视网膜病变、糖尿病足等严重并发症[6]。 临床需要及时开展降糖治疗,稳定患者血糖水平处于正常范围内。 2 型糖尿病具体病机较为复杂,与胰岛β 细胞功能异常、胰岛素抵抗等存在一定联系, 引起血糖异常升高现象[7-8]。因此,该病治疗的关键环节在于对机体胰岛素抵抗、胰岛β 细胞功能的改善。
药学分析: 二甲双胍为2 型糖尿病临床治疗的首选药物,可抑制肝糖输出,降低肠道对葡萄糖的吸收率,增加外周组织对葡萄糖的利用及摄取,有效控制血糖, 同时通过对肝细胞胰岛素受体络氨酸激酶活性的调节,改善机体胰岛素抵抗,进而提高外周组织对胰岛素的敏感性[9-10]。 马来酸罗格列酮属于新型噻唑烷二酮类胰岛素增敏剂,能直接结合PPARS-γ受体并活化, 对PPARS 应答基因的表达进行调节,进一步促使PRSK 基因表达,增强胰岛素敏感性,有效提高葡萄糖运转蛋白GLUF-4 表达, 从而增加葡萄糖的摄取,改善机体胰岛素抵抗,修复胰岛功能,以实现有效降低血糖的目的[11-12]。同时其作为一种胰岛素增敏剂,有效增强脂肪、肝脏、肌肉等组织对胰岛素的敏感性, 进而提高葡萄糖在外周组织的利用率,降低肝糖输出,预防高血糖[13]。2 型糖尿病患者机体糖代谢与胰岛素、胰高糖素样肽、胰高血糖素具有一定联系, 患者机体胰岛素分泌增加会对胰高血糖素的释放起到抑制作用,导致糖脂代谢紊乱[14]。该次研究结果显示: 观察组治疗后血糖指标(FPG、2 hPG、HbAlc)、血脂指标(TC、TG、LDL-C)均明显低于对照组,HDL-C 高于对照组, 同时患者HOMA-IR 低于对照组(P<0.05)。 可见,应用马来酸罗格列酮有利于控制控制机体血糖水平波动,调节血脂,同时改善胰岛细胞功能。 分析原因为在二甲双胍用药基础上合用马来酸罗格列酮,可发挥互补作用机制,能更为明显地改善机体胰岛素抵抗; 同时通过促进葡萄糖运转蛋白GLUF-4 表达对胰岛功能进行调控, 并增强胰岛素敏感性,发挥协同作用[15]。 炎症反应、氧化应激等也会导致胰岛β 细胞受到炎性损伤及脂质过氧化损伤,损伤胰岛β 细胞,进而出现糖脂代谢紊乱情况[16]。IL-6、TNF-α 可促使炎症细胞粘附、凝聚,介导机体慢性炎症、内皮细胞功能损伤,致使胰岛β 细胞发生病理性损害, 促进B 淋巴细胞、T 淋巴细胞表达,使得胰岛β 细胞功能加快凋亡[17]。该次研究结果显示:经治疗后,观察组炎症因子(IL-6、TNF-α)水平均显著低于对照组(P<0.05)。 提示马来酸罗格列酮治疗可抑制机体炎症效应,减轻内皮损伤,保护并修复胰岛β 细胞功能,发挥显著疗效。 分析原因为,马来酸罗格列酮可以明显下调IL-6、TNF-α 的mRNA 表达,并提高自然杀伤淋巴细胞表面受体。此外, 两组不良反应发生率比较, 差异无统计学意义(P>0.05)。 可见,该治疗方案用药安全性有保证。
综上所述,2 型糖尿病治疗中应用马来酸罗格列酮,对改善机体糖脂代谢具有突出优势,可稳定控制血糖,同时有效调节血清炎性因子水平,改善胰岛细胞功能,且治疗安全性有保证,具有应用推广的价值。

