自身免疫性胰腺炎长期预后的研究进展
张艳蓉 孟茜茜 辛磊 王洛伟
海军军医大学第一附属医院消化内科,上海 200433
【提要】 自身免疫性胰腺炎(AIP)是一种特殊类型的胰腺炎,激素治疗后短期预后良好,但随着病程延长,相当一部分患者病情复发,且出现胰管结石、内外分泌功能不全等典型CP的临床表现。此外,AIP与胰腺及其他器官肿瘤的关系尚不明确。本文就AIP长期预后研究的相关进展作一综述。
自身免疫性胰腺炎(autoimmune pancreatitis,AIP)是一种由自身免疫介导的特殊类型胰腺炎,分为1型和2型。1型AIP被认为是IgG4相关疾病(IgG4-related disease,IgG4-RD)在胰腺的局部表现[1]。2型AIP较少累及胰腺外器官,可合并炎症性肠病[2]。一般来说,AIP患者经糖皮质激素(下文简称“激素”)治疗后临床症状明显缓解,实验室检查及影像学表现可明显改善,短期预后良好。但AIP的研究历史较短[3],对其长期预后仍不明确。本文将AIP长期预后分为长期缓解与复发、胰管结石形成、胰腺内外分泌功能不全、胰腺癌和胰腺外恶性肿瘤发生、AIP相关死亡事件5个部分,并就其相关的研究进展进行综述。
一、长期缓解与复发
在AIP患者接受激素治疗后,随着随访时间延长,复发率也明显升高。数项较大样本研究平均随访40~60个月,复发率为10.0%~47.8%[4-8]。总体上,1型AIP复发率显著高于2型AIP。荷兰一项回顾性研究纳入96例1型AIP患者和11例2型AIP患者,中位随访74个月,发现1型AIP复发率为55%,而2型AIP复发率仅为27%[9]。
值得注意的是,不同方案的激素治疗后AIP复发率亦有不同。一项随机对照试验纳入49例AIP患者,对比泼尼松维持治疗3年与26周停药的复发率,发现3年组复发率明显低于26周组(23.3%比57.9%,P=0.011)[10]。笔者所在上海长海医院胰腺疾病研究中心前期对AIP患者复发的危险因素研究也显示,未维持激素治疗是复发的独立危险因素(HR=4.53,95%CI1.35~15.17)[11]。2013年修订版的日本共识建议采用激素维持治疗降低复发风险[12],而欧美学者[13]考虑激素不良反应以及复发后激素治疗仍然有效,多不推荐激素维持治疗。
二、胰管结石形成
胰管结石是CP最常见的病理改变,曾有观点认为AIP不同于CP,少有胰管结石或胰腺钙化。欧洲一项纳入1 500例CP的多中心横断面研究显示,饮酒和吸烟与钙化存在正相关,而自身免疫病因与钙化存在负相关(OR=0.15,95%CI0.08~0.27,P<0.001)[14]。但随着研究的逐渐深入,发现1型AIP患者中有5%~41%在随访中出现新发结石或结石增加[4,7,15-18],病情复发是较公认的危险因素(表1)。2型AIP患者并发结石的案例尚未有报道。
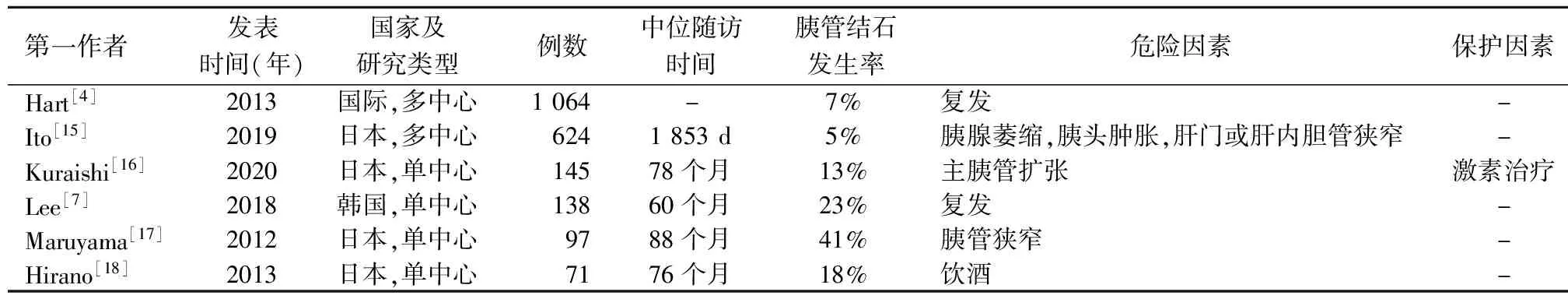
表1 自身免疫性胰腺炎患者胰管结石发生率及相关因素
Maruyama等[19]研究提出了AIP向典型CP转变的可能机制:AIP常发生胰头肿胀及主、副胰管狭窄,使胰液在上游胰管淤积,导致胰体部主胰管内压力增加,这些变化最终导致整个胰腺钙化及结石的形成。
三、胰腺内、外分泌功能不全
胰腺内、外分泌功能不全是CP典型的长期转归,常表现为糖尿病和消化不良,严重者出现脂肪泻[20]。由于AIP多以梗阻性黄疸、腹痛等主要症状起病,胰腺内、外分泌功能不全容易被忽视。据报道,16%~67%的患者在诊断AIP时即存在外分泌功能不全[8-9,21],19.0%~83.8%存在内分泌功能不全[6,9,22]。在长期随访中,2.9%~47.0%出现外分泌功能不全[7,9,23],9.5%~52.0%出现内分泌功能不全[6,22-23]。瑞典一项回顾性队列研究中位随访44个月,分别有21%和47%的AIP患者发展为胰腺内、外分泌功能不全,其中76%的胰腺外分泌功能不全属于重度(粪便弹性蛋白酶1<100 μg/g),73%的胰腺内分泌功能不全需要胰岛素治疗[23]。意大利一项多中心回顾性研究中,有31.2%(54/173)的AIP患者接受粪便弹性蛋白酶1检测,其中59.2%为病理性(<200 μg/g)[24]。Frulloni等[25]认为 AIP患者临床发病时的体重减轻可能与继发的胰腺外分泌和内分泌功能不全有关。
荷兰一项研究[9]通过多因素回归分析显示,AIP患者胰腺外分泌功能不全的危险因素是年龄较大(每增加1岁,OR=1.05,95%CI1.00~1.10),胰腺内分泌功能不全的危险因素包括年龄较大(每增加1岁,OR=1.06,95%CI1.01~1.11)和较长的随访时间(OR=1.36,95%CI1.11~1.68)。法国一项中位随访时间为41个月的研究显示,分别有39%和34%的患者出现胰腺内、外分泌功能不全,糖尿病的危险因素包括女性(OR=0.18,95%CI0.04~0.83,P=0.04)、年龄增加(P=0.006)和1型AIP(P=0.001),但未发现外分泌功能不全危险因素[26]。胰腺外分泌功能不全是CP患者死亡的重要独立危险因素[27],因此在AIP患者的随访中,应重视胰腺外分泌功能不全的风险和治疗。
部分AIP患者在诊断时即有血糖异常,接受较大剂量激素治疗期间血糖水平往往升高,但随着病情缓解和激素减量,胰腺内、外分泌功能可部分改善。日本的一项研究显示,激素治疗后中位随访40个月,85%的患者外分泌功能得到改善[8]。另有研究发现,激素治疗可使75%的AIP患者外分泌功能得到改善,50%的患者外分泌功能恢复正常[28]。日本一项全国性流行病学调查[22]结果显示,66.5%的AIP患者发病时合并糖尿病,在接受激素治疗后47.2%患者糖尿病得到改善,另有17.0%在接受激素治疗后出现新发糖尿病或糖尿病加重,患者年龄越大,新发糖尿病或糖尿病加重的比例越高。有研究认为激素治疗可抑制淋巴细胞浸润和胰腺纤维化,增加胰岛细胞的血流量,恢复部分内分泌功能[29];但也有研究认为如果糖耐量严重受损,即使在接受激素治疗后,也无法完全恢复,因此应在AIP早期积极予以激素治疗[30]。有研究表明,长期激素维持治疗虽然使患者C肽水平好转(从0.9增加到2.1,P=0.004),但胰岛素抵抗内稳态模型评估指数(homeostasis model assessment for insulin resistance,HOMA-R)也同时升高(从2.1增加到3.0,P=0.007)[31],因此激素长期维持治疗是否有利于保护胰腺内分泌功能仍无法确定。
四、胰腺癌及胰腺外恶性肿瘤
慢性炎症在肿瘤的发生中发挥重要的作用,CP已被证明是胰腺癌的危险因素[32],而部分AIP患者即使达到临床缓解仍存在亚临床程度的胰腺炎症,因此有观点推测AIP也可能是胰腺癌的危险因素,亦有多项研究报道AIP患者并发胰腺癌(表2),但整体上发病率较低。Macinga等[40]认为这可能是由于AIP的发病率低、研究随访期普遍较短造成的。
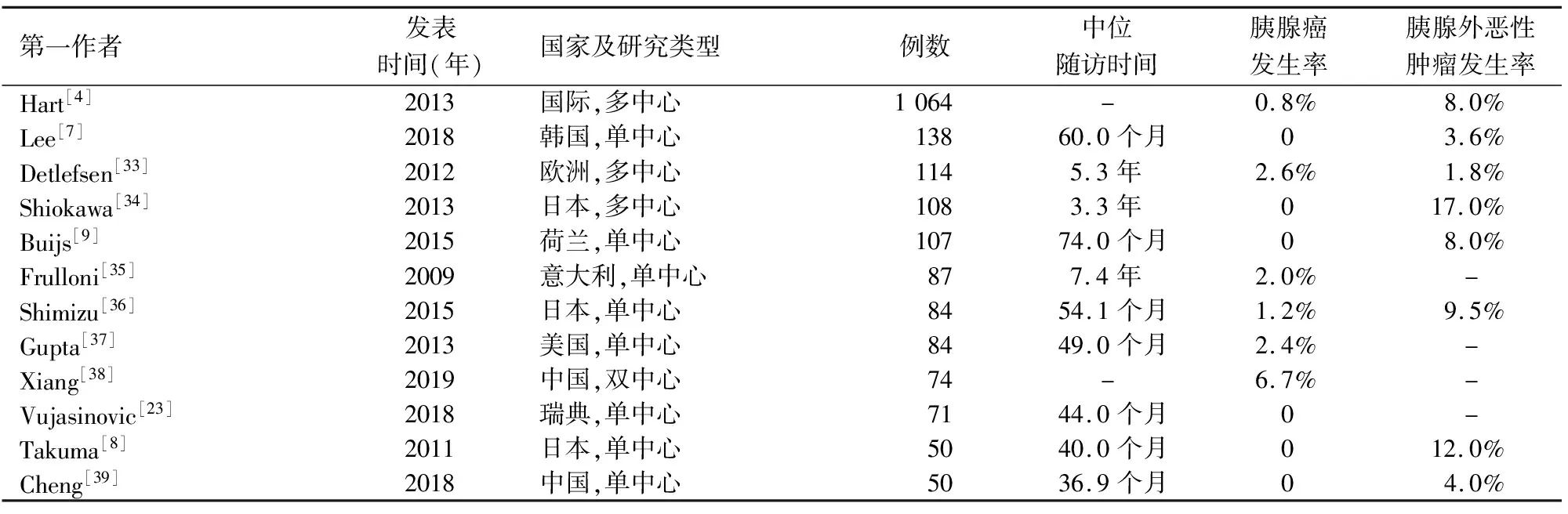
表2 自身免疫性胰腺炎患者恶性肿瘤发生情况
Gupta等[37]发现较CP患者,AIP手术切除组织中胰腺上皮内瘤变患病率较高(82%比40%),皆有高频率K-ras突变(100%比50%),提示AIP与胰腺癌的相关性[41]。另外,日本一项纳入135例AIP患者的回顾性研究发现,与年龄和性别匹配的参考人群相比,AIP患者罹患癌症的相对风险为4.9(95%CI1.7~14.9);对这部分合并癌症的患者随访发现,在成功治疗癌症后AIP复发率较低(1/8,12.5%),因此研究者推测AIP可能是一种副肿瘤综合征的表现[34]。
一项国际多中心研究报道,AIP患者在随访期间发生的恶性肿瘤多为胃癌(1.7%)、肺癌(1.4%)和前列腺癌(1.1%),而非胰腺癌(0.8%),且大部分癌症的诊断均在AIP确诊3年后[42]。我国一项前瞻性队列研究纳入587例IgG4-RD患者,平均随访61.4个月,发现患恶性肿瘤的风险增加2.78倍,以消化道恶性肿瘤(3例直肠癌,1例结肠癌)最常见(23.5%);无AIP患者合并胰腺癌;AIP是IgG4-RD患者发生恶性肿瘤的危险因素(OR=6.23,95%CI1.56~24.91),而嗜酸性粒细胞增多是保护因素(OR=0.09,95%CI0.01~0.88)[43]。
五、AIP相关死亡事件
对AIP患者的死亡事件研究较少,所报道的死因大多是伴发癌症、合并症或发生意外,极少有报道患者死于AIP的并发症。荷兰一项前瞻性研究纳入107例AIP患者,中位随访74个月后有5例死于并发症,其中2例患者因拒绝激素治疗导致终末期肝硬化,3例患者因延误诊断发展为不可逆的肝肾功能衰竭[9]。该研究结果显示,AIP患者与年龄和性别匹配的全国参考人群相比,生存率差异没有统计学意义。另有研究比较手术治疗后的1型和2型AIP随访期间死亡事件,发现1型AIP死亡率明显高于2型AIP(19.1%比5.9%,P=0.03)[33],原因可能是1型AIP患者年龄高于2型AIP患者。
此外,长期的激素治疗可能会导致严重的不良事件、甚至死亡,因此在随访中应予以重视。日本一项纳入84例患者的回顾性研究发现,激素累积剂量超过10 000 mg(约5年)是严重不良事件发生的危险因素之一[36],故研究者认为激素治疗应在6个月至5年之间,以降低复发和严重不良事件的发生。
综上所述,对AIP的长期随访研究仍处于起步阶段。总体上看,随着病程延长,相当一部分AIP患者病情复发,且出现胰管结石、内外分泌功能不全等典型CP的临床表现。AIP与胰腺及其他器官肿瘤的关系尚不明确。建议在临床工作中重视AIP患者的定期随访,关注其长期转归。
利益冲突所有作者声明无利益冲突

