菊苣酸对内毒素诱导的大鼠急性肺损伤的保护作用及机制研究
王 齐,刘梅梅,黄焱平,杨 珺
(安徽医学高等专科学校,安徽 合肥 230601)
CA是一种水溶性酚酸类化合物,是咖啡酸和酒石酸的衍生物,存在于紫锥菊、菊苣、蒲公英等天然植物中。菊苣酸是一种有效的抗氧化药物,能通过降低脂质过氧化物以及细胞内活性氧的积聚、清除自由基,发挥抗氧化损伤及心血管保护的药理作用[1]。ALI的特征是弥漫性肺泡毛细血管内皮损伤引起的肺水肿和肺扩张,表现为呼吸窘迫和难治性低氧血症[2]。急性呼吸窘迫综合征(ARDS)是一种严重的ALI形式,可迅速发展为多器官衰竭,患者预后差[3]。虽然在ALI期间激素对炎症反应表现出显著的抑制作用,但激素药物在临床使用中会导致不可预见的不良副作用。近年来临床和实验研究已经证明,肺毛细血管屏障损伤后引发肺水肿加重是ALI/ARDS最重要的病理特征[4-5]。相关研究表明,菊苣酸可通过抑制淀粉样蛋白积聚以及淀粉样蛋白前体蛋白和神经元分泌酶1水平的增加,来抑制脂多糖(LPS)诱导的记忆障碍和神经元丢失[6-7]。然而,CA对肺水肿的潜在影响及主要机制尚未有充分研究。因此,本文旨在阐明CA对大鼠模型中LPS引起的ALI和肺水肿的影响和相关机制。
1 材料与方法
1.1 实验动物和药品雄性SD大鼠90只,体重(180~200) g,(6±1)周,由安徽医科大学实验动物中心提供。饲养期间将动物安置在(24±1)℃、相对湿度为(50±1)%、光/暗周期为12 h的环境条件中。动物喂食标准谷物饲料,自由饮用自来水,饲养1周。菊苣酸由成都瑞芬思生物科技有限公司提供,纯度>98%。徕卡荧光显微镜,德国Leica公司。722N分光光度仪,江苏天睿精密科学仪器公司。超薄切片机,美国RMC。医学图像分析系统BI2000,成都泰盟科技有限公司。电泳仪1704150,美国伯乐。LSRFortessa流式细胞分析仪,美国BD公司。
1.2 分组、造模和给药将90只雄性SD大鼠随机分为6组:假手术组、CA组、LPS组、低剂量CA组、中剂量CA组、高剂量CA组,每组15只。假手术组灌胃给予生理盐水(5 mL/kg)1 h后,腹腔注射生理盐水;CA组将CA(40 mg/kg)溶解于生理盐水灌胃1 h后,腹腔注射生理盐水;LPS组灌胃给予生理盐水(5 mL/kg)1 h后,腹腔内注射LPS(10 mg/kg);低剂量CA组给予溶解于生理盐水CA(10 mg/kg)灌胃1 h后,腹腔注射LPS(10 mg/kg) ;中剂量CA组给予溶解于生理盐水CA(20 mg/kg)灌胃1 h后,腹腔注射LPS(10 mg/kg);高剂量CA组给予溶解于生理盐水CA(40 mg/kg)灌胃1 h后,腹腔注射LPS(10 mg/kg);LPS注射6 h后,腹腔注射2%的青藤巴比妥(60 mg/kg)麻醉大鼠。
1.3 HE染色和免疫组织化学检测
1.3.1 HE染色 LPS给药6 h后,麻醉安乐死大鼠取右肺中叶,4%多聚甲醛4 ℃固定48 h,进行石蜡切片(5 μm)。在二甲苯和乙醇梯度分离后,在室温下用苏木精染色5 min,伊红染色15 s。在光学显微镜物镜(×10)下观察肺组织的形态学变化。
1.3.2 髓过氧化物酶(MPO)免疫组化染色 麻醉安乐死大鼠取右肺中叶,4%多聚甲醛4 ℃固定48 h,进行石蜡切片(5 μm)。切片用梯度酒精脱水,二甲苯透明后在0.01 M柠檬酸缓冲液(pH 6.0)中微波炉加热修复抗原,并在室温下过氧化氢(0.3%)封闭30 min。滴加兔MPO多克隆一抗(1∶200;Abcam)在4 ℃孵育过夜。然后将切片与生物素标记的山羊抗兔IgG二抗(HRP)在室温下孵育30 min,并使用DAB底物试剂盒观察显色情况。在光学显微镜物镜下(×20)观察肺组织样本中MPO阳性细胞的位置和表达水平。
1.4 测定肺干湿重比注射LPS 6 h后,麻醉安乐死大鼠,取右上叶肺组织各100 mg,称重。在80 ℃的真空烘箱中干燥48 h,再次称重肺组织。计算烘干前后肺重量的比值。
1.5 肺血管通透性检测大鼠腹腔注射LPS 6 h后,注射2%的青藤巴比妥(60 mg/kg)麻醉大鼠,再将2%伊文思蓝(EB)溶液(30 mg/ kg)从大鼠颈内静脉注入。30 min后,通过右心室用生理盐水灌注,直到心脏骤停,冲洗肺组织中的血管内EB,收集每只大鼠的部分左下叶肺组织,称重并放于离心管中。将100 mg左下叶肺组织加入1 mL甲酰胺,放置在37 ℃的水浴中24 h,在室温下离心30 min,然后提取上清液。用620 nm波长的分光光度计测量上清液的吸光度值。采用标准曲线法计算每个样品的EB含量。肺微血管通透性以EB含量与湿肺重之比表示。
1.6 支气管肺泡灌洗液(BALF)的收集和分析腹腔注射LPS后6 h,麻醉大鼠,气管内插入塑料套管,无菌生理盐水抽吸收集BALF,共3次。BALF样品在4 ℃下离心10 min,提取上清液。采用BCA法检测BALF样品中的总蛋白浓度。在室温下用Wright-Giemsa染色1 min,使用细胞计数评估细胞总数,并在物镜(×4)下观察。
1.7 Western blot分析腹腔注射LPS后6 h,麻醉安乐死大鼠,取右肺上叶组织,采用一步RIPA法从大鼠肺组织中提取总蛋白后采用BCA法测定蛋白含量。经过8%SDS-PAGE电泳(每组100 mg蛋白质)分离后,将蛋白质样品转移到PVDF膜上,用5%脱脂牛奶在室温下密封1 h。使用的主要抗体和浓度如下:ZO-1(1∶1000,Thermo Fisher Scientific公司),Occludin(1∶500,Thermo Fisher Scientific公司)、JAM-1(1∶1000,Santa Cruz Biotechnology公司)和GAPDH(1∶5000,Cell Signaling Technology公司)。所有一抗在4 ℃下孵育过夜。以GAPDH为内参。Western blot条带的平均光密度采用Quantity One图像分析软件测定,计算目标带的平均光密度与GAPDH的平均光密度的比值。
1.8 统计学分析计量资料以“均数±标准差”表示。使用SPSS 15.0进行ANOVA方差分析和Tukey检验。P<0.05为差异有统计学意义。
2 结果
2.1 CA抑制LPS诱导的大鼠ALI和肺部炎症HE染色结果显示,在假手术组和CA组中,大鼠肺结构显示肺泡腔完全透明,肺泡间隔内无水肿或炎症细胞浸润。而LPS组肺间质组织明显水肿增厚(图1 A,箭头),并伴有肺泡萎缩。CA预处理防止了LPS诱导的ALI和对肺泡结构的损伤(图1 A和B)。免疫组化检测显示与假手术组和CA组相比,注射LPS后大鼠肺组织中MPO阳性细胞染色明显增加。与LPS组相比,CA预处理组的MPO阳性染色较弱(图1 C和D)。这表明CA阻止了LPS诱导的白细胞浸润和大鼠肺组织损伤。

图1 CA对LPS注射后急性肺组织损伤及肺组织MPO表达水平的影响注:A:各组大鼠肺组织HE染色图像(标尺,200 μm),箭头表示间质水肿和增厚(×40);B:各组大鼠肺组织MPO免疫组化图像(×40)(标尺,200 μm);C:肺损伤量化评分;D:各组肺组织中MPO阳性细胞的统计分析;与假手术组比较,*P<0.05;与LPS模型组比较,#P<0.05
2.2 CA防止LPS诱导的肺微血管通透性和肺水肿与假手术组相比,大鼠腹腔注射LPS6 h后肺组织湿干重比显著增高,表明肺组织水肿显著增加。LPS组与假手术组相比,肺组织EB外渗和BALF蛋白含量也显著升高,提示LPS破坏了肺血管和肺泡上皮屏障的完整性。此外注射LPS后BALF的总细胞数量也显著增加。与LPS组相比,中剂量CA组和高剂量CA组的肺湿/干重比、EB外渗、BALF蛋白浓度和BALF总细胞数均显著降低(表1)。这些数据表明,CA预处理可有效抑制LPS诱导的肺水肿,并增加肺微血管通透性。

表1 CA对脂多糖诱导的肺微血管通透性和肺组织水肿的影响
2.3 CA抑制LPS诱导的大鼠肺组织紧密连接蛋白的下调Western blotting结果表明,LPS诱导后大鼠肺组织中紧密连接蛋白ZO-1、Occludin和JAM-1的表达水平显著降低(图2和表2)。在CA 20 mg/kg和40 mg/kg剂量组中,肺组织紧密连接蛋白表达量显著高于LPS组。这说明CA对LPS引起的肺紧密连接蛋白表达的降低有一定的抑制作用。
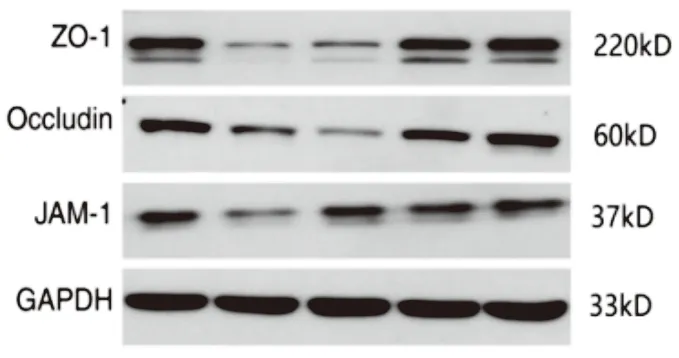
图2 Western blotting检测大鼠肺组织ZO-1、Occludin和JAM-1的定量分析图

表2 大鼠肺组织中ZO-1、Occludin和JAM-1的定量分析
3 讨论
最近的研究表明,肺微血管屏障损伤和由此引起的肺水肿是早期ALI的主要病理特征,是治疗ALI/ARDS的关键靶点[8-9]。研究显示脂多糖作为革兰氏阴性菌细胞壁的主要成分是引起肺损伤的常见原因,因此在实验研究中被广泛用于建立ALI动物模型[10]。LPS通过与白细胞Toll样受体4结合激活NF-κB,诱导多种炎症因子的表达,包括TNF-α、IL-1β和IL-6,导致细胞旁连接的破坏[11]。因此粘附在血管壁上的白细胞通过释放蛋白酶和过氧化物破坏微血管,使肺微血管通透性增加并引起肺水肿,最终导致肺顺应性降低和肺功能受损。
本研究表明,CA预处理可以阻止LPS诱导的大鼠ALI,使MPO的表达水平降低,细胞因子的产生下降,下调LPS炎症肺组织中粘附分子的表达。本研究表明了CA可以抑制LPS诱导的炎性细胞的浸润并降低MPO表达的上调。LPS除了通过白细胞过度活化间接损害血管外,还直接损害微血管屏障功能,导致微血管通透性增加和肺水肿[12]。本研究结果显示,与LPS组相比,CA预处理组的肺组织湿干重比、BALF蛋白含量和EB外渗率均明显下降,说明CA可以抑制LPS诱导的肺微血管的通透性以及肺水肿。微血管屏障主要由微血管内皮细胞之间的紧密和粘附连接调节。紧密连接蛋白包括Claudin,Occludin和JAM通过与细胞质中的ZO家族蛋白连接,在稳定细胞间紧密相互作用中发挥关键作用[13]。CA不仅可以稳定肺微血管紧密连接蛋白Occludin的表达,还可以增加JAM-1和ZO-1蛋白的表达水平。CA通过增加连接蛋白的表达水平来影响肺组织中的微血管屏障,防止LPS诱导的肺微血管通透性增高和肺组织水肿。
综上所述,CA对LPS诱导的大鼠ALI具有保护作用并与减少肺组织微血管屏障的破坏有密切关系。

