浸种与层积过程中紫椴种子内源激素变化
臧思航,葛丽丽,刘 强,郑金萍,郭忠玲
(北华大学林学院,吉林 吉林 132013)
紫椴(Tiliaamurensis)为椴树科(Tiliaceae)椴树属(Tilia)落叶乔木,是我国东北林区珍贵的用材树种和蜜源树种,也是国家二级保护树种[1].由于具有重要的生态价值及经济价值,近年来被过量开采,紫椴种群数量和质量逐年降低[2].除此之外,紫椴种子具有一定的休眠特性,也是造成紫椴种群天然更新不良的重要原因[3].在解除种子休眠方面,浸种与层积是常用的手段,不会对种子造成损伤.成熟的林木种子只有在水分充足的条件下吸涨才能萌发.赵群金[4]提出的“三水电层”假说指出,种子生理现象的产生是由于改变了活性中心所控制的电荷特征所起的作用,浸种过程会使扩散层水分子数量增多,运动速度加快,活性中心控制区域的电荷密度增加,从而激活控制酶发生相关化学反应,种子的休眠状态被打破.金雅琴等[5]研究指出,层积过程能够显著增加种子内部的赤霉素(GA3)含量,并有助于降低种子中脱落酸(ABA)的含量,为破除种子休眠、促进萌发创造条件,随着层积处理时间的增加,种子发芽率及发芽势均随之增加.根据“三水电层”假说,层积会影响种子内部水分子的运动状态,以及某区域的电荷密度,打破活性中心与“三水电层”电荷平衡,使种子内的激素平衡向着促进发芽的方向转化[4].
植物内源激素在植物的整个生长发育阶段起着重要作用,生长素、细胞分裂素、赤霉素、脱落酸是常见的植物内源激素[6],以往研究[7-10]证明了种子休眠与内源激素间存在一定关系.本研究通过测定浸种与层积过程中紫椴种子中4种内源激素(吲哚乙酸(IAA)、ABA、GA3、玉米素(ZT))含量,分析其在种子解除休眠过程中的调控作用.
1 材料与方法
1.1 试验材料
紫椴种子来源于吉林省林木种子调制储备中心,种源为吉林省临江种源,采种时间为2019年9月.种源地位于吉林省东南部的长白山腹地,属中温带大陆性季风气候,年均气温2~4 ℃,年降水量750~1 000 mm.试验前,先将紫椴种子除去果梗与杂物,再挑选籽粒饱满的种子作为供试材料.
1.2 试验方法
1.2.1 浸种处理
将紫椴种子倒入容器内,加入冷水浸泡,水量以没过种子10 cm左右为宜.浸泡过程中,要视水质情况定期换水,当水变得浑浊、微起泡沫、产生异味时换水.在浸种的第2、4、6、8、9、10天分别取样,于-80 ℃超低温冰箱中保存待用.
1.2.2 层积处理
层积处理参见杨立学等[11]的方法,将去除杂质的种子洗脱后晾干,用0.5%的KMnO4溶液消毒,转入0~5 ℃冰箱层积.种子与湿沙的体积比为1∶3,沙子的相对含水率为60%~70%.层积过程中保持湿润,并定期翻动,层积90 d左右,每15 d取样1次,共计6次.
1.2.3 内源激素测定
试验所用仪器为岛津超高效液相色谱仪(LC-30AT)连接SCIEX 5600+质谱仪.色谱柱为SHIMADZU InerSustain C18(100 mm×2.1 mm,2 μm),流动相A:乙腈,B:0.1%甲酸水溶液,梯度洗脱,柱温35 ℃,进样器温度为4 ℃,进样量为10 μL.
样品前处理:称取0.15 g样品,加入1 mL 80%甲醇溶液浸泡12 h,保存于4 ℃冰箱中.在冰水中水浴超声30 min,离心5 min(12 000 r/min,4 ℃).取800 μL上清液,常温下减压回收溶剂.残渣加入80 μL 80%甲醇复溶.上样SPE色谱柱富集植物激素.用160 μL蒸馏水洗涤2次,再用5%甲醇水溶液160 μL洗涤两次,弃去洗液,用160 μL甲醇洗涤4次,收集甲醇洗液.减压浓缩至干,加入100 μL甲醇复溶,即得到植物激素供试品溶液.进样10 μL.
2 结果与分析
2.1 激素标准品提取色谱
配置内源性植物激素标准溶液,按1.2.3中的色谱-质谱条件进样分析.标准品的出峰时间见图1.
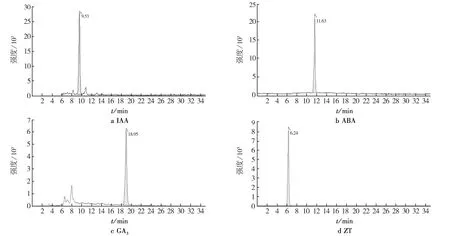
图1 激素标准品提取色谱Fig.1 Chromatogram of hormones standard extraction
2.2 标准曲线
以IAA、ABA、ZT、GA3标准品为原溶液,配置一系列不同质量浓度的标准品混合液,用峰面积(y)对质量浓度(x)作线性回归曲线,得到的回归方程见表1.
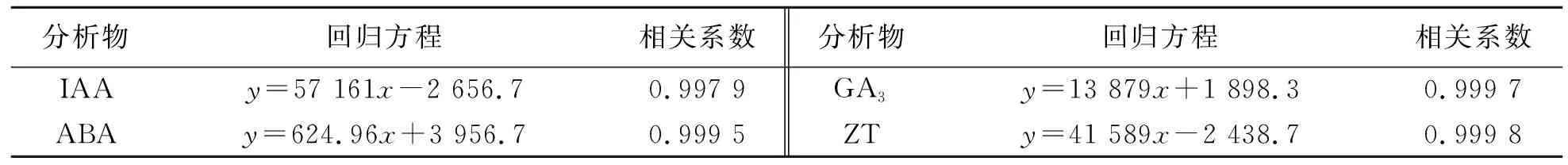
表1 内源激素测定的工作曲线Tab.1 Calibration curves of internal hormones
2.3 浸种过程中的内源激素含量
不同浸种时间4种激素含量变化见图2.作为种子萌发的引发手段,浸种将种子由休眠或低活力状态提高到旺盛生长水平,期间有很多物质参与其中,形成了有利于种子萌发的状态.由图2可见:种子进入水中后,作为促进种子萌发的主要激素,IAA含量呈现波浪形变化.未浸种的种子中IAA含量较高,在浸种8 d后,种子中的IAA含量最低;从整个浸种过程来看,果皮中的IAA含量低于种子内部胚中的IAA含量.
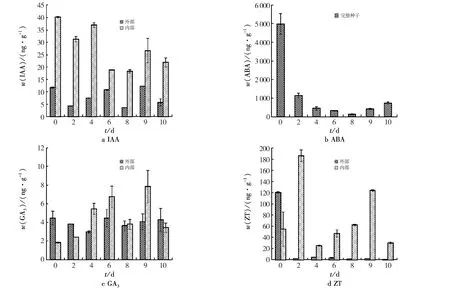
图2 不同浸种时间4种激素含量Fig.2 Content of four hormones in different soaking times
ABA含量在未浸种时的含量较高,浸种2天时ABA含量急剧下降(1 279.57 ng/g).在浸种过程中,ABA含量呈先降低后升高的趋势,在浸种8天时达到最低(150.98 ng/g).
浸种初期,种子中GA3含量总体较低,随着浸种时间的增加,GA3含量呈增加趋势,浸种8天时有所下降,但高于对照组的GA3含量,浸种9天时GA3含量最高.在浸种初期,种子外部果皮中的GA3含量高于种子内部胚乳中的GA3含量.随着水浸时间的增长,从浸种第4天开始,种子内部的GA3含量超过果皮中的GA3含量.
未水浸的种子果皮中ZT含量较高,整个浸种过程种子外部的ZT含量始终低于种子胚乳中的ZT含量.浸种2 d,种子中ZT含量最高,4~10 d种子中ZT含量呈现先增加后降低的趋势,浸种第9天时,内部的ZT含量最高,且高于对照组.
2.4 层积过程中内源激素含量
不同层积时间4种激素含量见图3.由图3可见:在层积过程中,种子果皮中的IAA含量较低(21.85 ng/g),而种子内部的IAA含量在90天左右达到最大(45.82 ng/g),种子中IAA含量整体呈现“升高—降低—升高”的趋势;在45天时,ABA含量较高(72.83 ng/g),随着层积时间的增加,种子中ABA含量整体呈现“升高—降低”的趋势;GA3含量在层积初期呈上升趋势,随着时间的增加,在45天左右达到最大,继续层积,种子中GA3含量逐渐下降,但胚乳中的GA3含量有所增加;种子内部的ZT含量一直高于果皮中ZT的含量,整体变化趋势呈“W”状,在层积45天时达到峰值,60天时急剧下降.
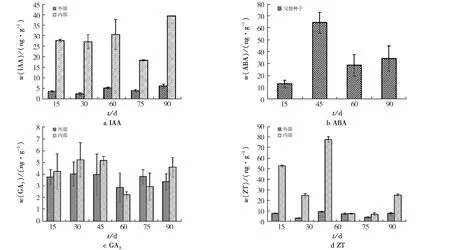
图3 不同层积时间4种激素含量Fig.3 Content of four hormones in different stratification times
2.5 内源激素比值
不同浸种时间内源激素比值变化见图4.由图4可见:在浸种过程中,紫椴种子ABA/IAA呈先下降后回升的趋势,未处理时,种子中ABA/IAA为103.451 3,为最高值,随着浸种时间的增加,ABA/IAA逐渐降低,在浸种第9天,ABA/IAA又开始回升;ABA/ZT变化趋势与ABA/IAA相同,未水浸的种子中ABA/ZT为39.253 1,为最高值,浸种4~8 d,ABA/ZT略有下降,在浸种9 d以后,ABA/ZT有所回升,在浸种第10天达到24.007 3;ABA/GA3在浸种初期为788.617 9,随后比值急剧下降,在浸种第8天时降到最低(18.998 8),9~10 d呈上升趋势.
不同层积时间内源激素比值见图5.由图5可见:在层积过程中,紫椴种子ABA/IAA变化趋势与ABA/ZT基本一致,ABA/IAA与ABA/ZT在种子层积初期接近于0,随着层积时间的增加,在60天时达到最大值;ABA/GA3在层积初期急剧上升,在45~60 d变化缓慢,到层积后期急剧下降为1.234 3.
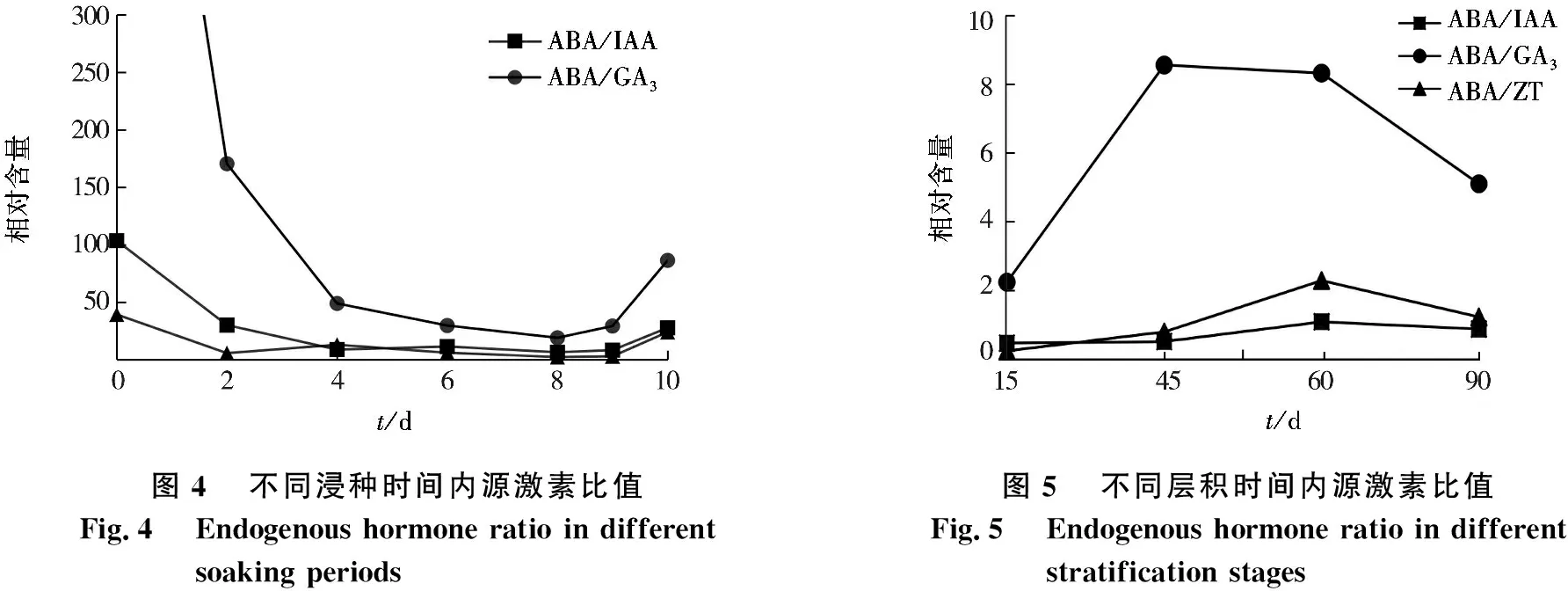
图4不同浸种时间内源激素比值Fig.4Endogenous hormone ratio in different soaking periods图5不同层积时间内源激素比值Fig.5Endogenous hormone ratio in different stratification stages
3 结论与讨论
本次研究发现,在浸种过程中,紫椴种子IAA含量不断变化.浸种初期(0~6 d),果皮中的生长素含量随着浸种时间的增加呈上升趋势,在浸种6天时,果皮中的抑制物含量较低,此时果皮中的生长素对胚的发育起一定的促进作用,当浸种达到9 d时,种子的整体抑制物水平降到最低,开始产生IAA,且种子内部所形成的生长素量要高于外部果皮中生长素的量.王志清等[12]研究认为,细辛种子IAA含量变化呈波浪形变化是因为种子吸水膨胀后需要IAA来促进种子萌发,但当IAA含量达到一定值时则会抑制萌发.本研究分离后的种子在浸种过程中可能由于ABA含量较低,部分时间节点并未检测到ABA,因此,通过检测完整种子中脱落酸的含量来反映此过程的ABA含量的动态变化.测定结果表明:水浸过程能够大大减少ABA含量.浸种萌发过程中,伴随着ABA降解导致含量降低,种子对ABA的敏感性也降低[13].浸种2~4 d,IAA含量有所增加,此时ABA含量降低;在6~8 d,两种激素的含量都呈下降趋势;浸种9~10 d,IAA含量降低,ABA含量有所上升.浸种前期,GA3含量呈上升趋势,种子外部的GA3含量要高于种子内部的GA3含量,浸种4 d后,内部的GA3明显比果皮中的含量多,第6天时果皮中的抑制物含量最低,此时的GA3含量达到最高,到第9天左右,种子内部的GA3含量达到最高.在浸种过程中,果皮中的ZT变化并不明显,但种子内部胚中的ZT含量在4~9 d呈上升趋势,随后在9~10 d有所下降.
低温层积过程中,植物激素对种子解除休眠的调控是各种激素协同作用的结果[14].层积初期(1~2月),紫椴种子中IAA含量无明显变化,或许是因为IAA需要经历一段时间才能从束缚态转变为游离态,60 d左右,种子内部的IAA含量开始下降,随后在层积90 d左右种子内部胚中的IAA含量达到最高,推测此时紫椴种子接近萌发状态,所以种子内部的生理生化过程加速,而种子外部果皮中的IAA含量在整个层积过程中基本保持不变.类似结果也存在于红松(Pinuskoraiensis)种子萌发过程中.李金克等[15]研究表明,红松种子在低温层积过程中的生长素含量呈现先降后升的“V”形变化.未作处理的种子中ABA的量极高,开始层积时ABA含量降低,45 d左右又有所增加,但随着层积时间的增加,种子中的ABA量呈下降趋势,75天时未能检测出ABA,猜测此时种子中的ABA含量极低.总体来看,ABA含量一直保持较低水平,推测ABA含量下降或许导致种子发生萌动,但是并不是解除休眠的前提.近年来,有研究[16]也表明,种子的休眠与解除是由多种抑制物质同时作用的结果.本研究中,ABA的含量变化趋势证明了ABA介入了种子休眠诱导,但是否是萌发的主要抑制物质还需进一步证明.种子内GA3的含量变化与IAA大致相同,均是呈先增加后降低再增加的趋势,层积两个月GA3含量最低,层积后期又有所回升.在种子出现萌发迹象以前,GA3含量处于不断累积的过程,说明GA3对解除种子休眠具有一定的促进作用.种子外部果皮中ZT含量在层积过程中无明显变化,种胚中的ZT前期降低,随后在第45天达到峰值,或许是由于种子将要萌发引起的含量变化,之后急剧降低,直至第90天才有所回升,推测是种子萌发后新生器官内源激素合成的结果.

