安五脂素在小鼠体内的药代动力学研究
陈 聪,李 涵,冯彦博,林 豪,敬 舒,王春梅,李 贺,陈建光,孙靖辉
(1.北华大学药学院,吉林 吉林 132013;2.北华大学附属医院,吉林 吉林 132011)
华中五味子是木兰科植物华中五味子(Schis-andrasphenantheraRehd.et Wils)的成熟干燥果实,作为补益类的代表药物应用于临床已有2 000年之久[1].华中五味子的有效活性成分包括木脂素、挥发油、有机酸及多糖等,其中木脂素是华中五味子主要的活性成分[2-3].
安五脂素是华中五味子具有代表性的木脂素成分,也是鉴定华中五味子的标志性成分[4].本课题组前期[5]发现安五脂素具有很好的抗氧化作用,能够改善由肠缺血再灌注所导致的大鼠肝脏损伤,通过激活Nrf2/ARE通路和调节Caspase-3、Bcl2与Bax进而调节D-半乳糖所致衰老小鼠的免疫功能[6],还能够明显提高氧化应激所导致的心脏损伤[7]和抗疲劳作用[8-9],目前关于安五脂素的药代动力学研究鲜有报道.
本实验运用高效液相色谱法对安五脂素在小鼠体内的药代动力学特征和组织分布进行分析,为其作为候选药物的药效物质基础提供数据支持和参考.
1 材料和方法
1.1 实验试剂
安五脂素标准品(纯度>98%,成都普菲德公司);五味子酯甲(内标,纯度>98%,成都普菲德公司);色谱甲醇(天津市永大化学试剂公司).
1.2 实验小鼠
雄性ICR小鼠(长春亿斯实验动物技术有限公司,合格证号:SCXK(吉)2020-0003)18~22 g,小鼠在实验室适应1周后进行实验.
1.3 实验仪器设备
高效液相色谱(Thermo公司,美国);小型台式冷冻离心机(Eppendorf 公司,德国);组织匀浆机(上海左乐仪器有限公司).
1.4 高效液相色谱条件
高效液相色谱的分离柱为C18柱(100 mm×30 mm,18 μm,600 bar),柱温设置为32 ℃,吸光度230 nm.色谱甲醇和水分别作为流动相A和B,设置梯度的洗脱程序:0~15 min (75%~90% A),10~15 min (90%~100% A),15~18 min (100%~75% A).流速设置为1 mL/min,进样量为10 μL.
1.5 安五脂素在小鼠体内的血浆药代动力学实验
1.5.1 血浆和组织标准品的制备
以甲醇为溶剂将安五脂素标准品和五味子酯甲内标配置浓度为100 μg/mL和4 μg/mL.将不同体积的安五脂素标准品母液和200 μL五味子酯甲加入200 μL空白小鼠血液(或组织匀浆液)中混匀.最终配置安五脂素浓度为0.01、0.05、0.2、0.5、1、2、5 μg/mL的血浆(组织)标准溶液,每个样品中五味子酯甲浓度为4 μg/mL.
1.5.2 安五脂素给药及血浆样品脏器组织的采集和制备
给予36只小鼠口服灌胃安五脂素,剂量为10 mg/kg(给药前12 h禁食不禁水),给药后于0.5、1、1.5、2、3、4、6、8、12、24、36、48 h的每个时间点选取3只小鼠,将小鼠置于干燥器内,干燥器下部放入10 mL左右的乙醚,约0.5 min小鼠进入麻醉状态,麻醉后通过摘眼球取血200 μL,取心、肝、脾、肺、肾和脑组织,将生理盐水匀浆(1∶9)加入200 μL五味子酯甲(4 μg/mL)中,进行样品前处理.
1.6 方法学考察
1.6.1 专属性
通过比较6个不同批次的小鼠空白血浆(组织)、加入安五脂素和内标的空白血浆(组织)样品,进行专属性考察,观察空白血浆(组织)是否对安五脂素和内标的保留时间和峰面积有干扰.
1.6.2 标准曲线、定量限(LOQ)和检出限(LOD)
选取各浓度梯度的安五脂素血浆(组织)标准溶液,通过绘制安五脂素/内标的峰面积与安五脂素浓度的关系曲线,得到标准曲线.记录安五脂素的色谱峰面积,以信噪比10∶1为定量限,以信噪比3∶1作为检测限.
1.6.3 精密度和准确度实验
精密度和准确度通过日内(3个不同浓度QC样本,每个浓度6个重复样本,测定3次)和日间(连续3 d)分析的变异结果进行评估,通过峰面积计算相对标准偏差(RSD),以RSD小于20%为宜.
1.6.4 稳定性考察
将3个不同浓度的QC样本(每个浓度6个重复样本)经过3个冻融循环(从-20 ℃到室温条件)进行稳定性考察,记录各色谱峰的相对峰面积,以峰面积计算RSD.
2 结 果
2.1 方法学验证
安五脂素(100 μg/mL)和五味子酯甲内标(IS,4 μg/mL)的保留时间分别为11.91 min和7.42 min.在安五脂素和IS的保留时间内未观察到内源性干扰.
本研究中安五脂素在各样本中的精确度的RSD值<5.6%,准确度的RSD值<6.2%,平均回收率在92.7%~98.5%之间,稳定性<3.4%,说明本研究的方法学考察表明结果可信.见图1.
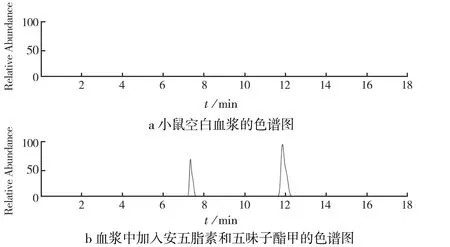
图1 小鼠血浆中安五脂素和五味子酯甲的色谱图Fig.1 Chromatgram of Anwulignan and Schisandrin A.in mouse plasma
2.2 安五脂素的吸收和体内分布
给小鼠灌胃安五脂素后,将在高效液相色谱中检测到的每个时间段的峰面积结果代入标准曲线中,得到相应的安五脂素浓度值,再将得到的数据通过DAS软件(3.2.8版本)进行分析,药时浓度见图2,药代动力学参数见表1,各组织中的安五脂素含量见图3.

表1 小鼠灌胃安五脂素后的主要药代动力学参数Tab.1 Primary pharmacokinetic parameters of Anwuli- gnan in mice after the intragastric administration

图3 小鼠灌胃安五脂素后在不同组织中的药时浓度Fig.3 Concentration of Anwulignan in the different tiss-ues of mice after the intragastric administration
3 讨 论
在本实验中,我们采用非房室模型的判断方法进行安五脂素在小鼠体内的药代动力学的研究,发现安五脂素在小鼠体内吸收较慢(tmax=3 h),持续时间也较长(t1/2=7.1 h),直到24 h仍能在血液中测到安五脂素的原型,说明安五脂素的消除速度较为缓慢,有可能存在肝肠循环.AUC0~t、AUC0~∞分别为(9.37 ± 2.36)mg/(L·h)、(12.58 ± 3.51)mg/(L·h),说明安五脂素进入体循环较多.表观分布容积(Vd)可以用来推断药品在体内分布的广泛程度,如果药物在体内均匀分布,则Vd值接近于0.8~1.0 L/kg,当Vd值大于1.0 L/kg时,则药物的组织浓度高于血药浓度,药物在体内分布广泛,或者组织蛋白对药物高度结合[10].本研究结果显示:安五脂素的表观分布容积为(32.81 ± 4.79) L/kg,说明安五脂素具有很强的亲脂性,比较容易进入细胞,并通过血液广泛分布到组织中,这一结果在安五脂素的主要器官分布数据中也有体现.此结果与SONG等[11]的研究基本一致.
口服灌胃安五脂素后,在小鼠的各个主要器官中均检测到安五脂素原药,说明安五脂素分布广泛,药物的组织分布与血液循环、血管的通透性、药物蛋白结合等因素有关[12],化合物在各脏器中的差异性分布主要取决于血液在器官中的流速、流量和化合物与脏器的亲和性[13].肝脏是药物的主要代谢器官,存在大量与代谢相关的酶和小分子化合物,因此,各化合物在肝脏中分布的比率最大;脾脏是体内最大的免疫器官,具有抗炎作用的化合物在脾脏内发挥药效作用[14].肝、肾和脑都是血液循环快速的器官,因此,小鼠灌胃安五脂素后在这些组织中都很快检测到了安五脂素,分布浓度依次为肝>心>脑>肾>肺>脾,在肝脏中的浓度最高,说明安五脂素在肝脏中消除较慢.安五脂素可以抑制CYP450酶的活性,能够导致相关药物酶的活性减弱,具有减缓自身或其他药物的代谢能力,也可以很好地证明本实验中安五脂素在小鼠肝脏中的含量最高,并且消除较为缓慢.通过对安五脂素结构的探究,发现它可能含有抑制肝脏中相关酶的结构,可能具有保肝作用,因此,肝脏很可能是安五脂素发挥主要治疗作用的靶器官,未来需要进行系统的研究[11].本实验中,在小鼠心脏、肾脏、肺和脾脏中都检测到了安五脂素,但是含量较少,停留时间较短,说明安五脂素在这些脏器中可以快速消除并且作用时间较短.值得注意的是,安五脂素在脑组织中的浓度较高,要高于其他五味子木脂素在脑组织的含量[15-17],提示安五脂素具有较强的透过血脑屏障能力,进而发挥中枢药理活性,这一结果能够为今后的安五脂素功效学研究提供参考.
华中五味子的主要活性物质是五味子木脂素,而安五脂素是华中五味子木脂素的代表性成分,因此,本研究通过对安五脂素的药代动力学特征进行分析,对华中五味子的后续研究具有一定参考价值.

