硫酸氨基葡萄糖脂质体的制备及其对骨关节炎的治疗作用
纪帅帅, 闫洁, 王子吟, 杨梦婷, 胡嫚, 霍强, 程秀
(蚌埠医学院药学院药物化学教研室,安徽 蚌埠 233030)
骨关节炎是一种常见的慢性疾病,据统计,我国约有50%的中老年人患有骨关节炎,这对于一个拥有2.6亿中老年人的国家而言,对骨关节炎的治疗刻不容缓[1]。目前还没有较好的骨关节炎的治疗手段,主要是以对症治疗为主,表现为缓解患者的疼痛、延缓关节软骨退变、提高患者的生活质量等[2]。因此,开发有效的治疗方法尤为重要。在目前的骨关节炎治疗方法中,局部关节腔内注射给药比口服给药更有效,因为其降低了全身毒性[3]。但是,关节腔内注射给药也有缺点,包括药物停留时间短,药物在关节腔中的浓度过高等[4]。因此,为了提高关节腔内注射给药的治疗效果,将抗炎药物纳入载体,实现药物的长期持续释放是一个可行的策略[5]。脂质体是一种优良的药物载体,具有毒性低和生物相容性高等优点[6]。作为一种成熟的纳米技术,已有多种相关制剂上市用于治疗各类疾病[7]。硫酸氨基葡萄糖(glucosamine sulfate,GAS)作为一种广泛用于骨关节炎的抗炎和软骨保护的药物,具有刺激软骨细胞外基质的蛋白多糖和胶原合成,抑制促炎因子分泌的作用[8]。通常,GAS作为口服药物使用,口服生物利用度仅为10%左右,治疗效果不显著。直接用于关节腔给药,也存在局部浓度过高和停留时间短等问题[9]。本研究利用氢化磷脂酰胆碱构建包载GAS的脂质体(GAS-Lips),避免了口服利用度低与局部注射滞留时间短等缺点。GAS-Lips在关节腔内缓慢而持续地释放GAS,并具有一定的润滑性,能够延缓关节磨损,发挥治疗作用,为骨关节炎纳米制剂的开发提供研究基础。
1 材料与方法
1.1 主要试剂和仪器
氢化磷脂酰胆碱、胆固醇、十八胺、GAS、Cy3荧光染料(上海阿拉丁试剂有限公司);三氯乙醛水合物(上海麦克林生化科技有限公司);注射用青霉素钠(江西省科达动物药业有限公司);肝素钠(辰欣药业股份有限公司);大鼠TNF-α、IL-6 ELISA试剂盒(上海碧云天生物技术有限公司)。
马尔文粒度分析仪(英国马尔文仪器有限公司);UV-2700紫外可见分光光度计(岛津仪器苏州有限公司);WS-900恒温摇床(北京维根技术有限公司);Tanon ABL X6动物活体成像分析仪(上海天能科技有限公司)。
1.2 动物培养
SPF级4周龄雄性SD大鼠,体重140~160 g,由湖南斯莱克景达实验动物有限公司提供,饲养于蚌埠医学院实验动物中心,并获得蚌埠医学院实验动物中心伦理批准。
1.3 制备GAS-Lips
精密称取处方量的氢化磷脂酰胆碱30 mg,称取胆固醇2 mg,分别溶于适量无水乙醇中,将其加入到50 mL的茄形瓶中旋转蒸发成膜后,置真空干燥器中放置2 h,分别加入0.3 mL(1 mg/mL)十八胺和含有1 mg GAS的 pH 7.4 磷酸盐缓冲液6 mL于茄形瓶中,充入氮气密封并置于摇床中水化15 min,探头超声水浴10 min制备得到脂质体。
1.4 GAS-Lips的表征
1.4.1 脂质体和GAS-Lips粒径分布及Zeta电位考察 取制备好的脂质体和GAS-Lips溶液,适度稀释后,置于马尔文四通石英样品池中,采用DLS Zetasizer Nano-90测量样品的粒径和Zeta电势,每次测量重复3次。
1.4.2 脂质体和GAS-Lips形态学考察 制备适宜浓度的脂质体和GAS-Lips溶液,分别取10 μL滴加在200目有碳支持膜的铜网上,常温放置2 h,干燥后用透射电子显微镜观察样品的形态。
1.5 GAS-Lips的制剂学评价
1.5.1 GAS检测波长的确定 称取一定质量的GAS,去离子水稀释至适宜浓度,紫外分光光度计检测波长在200~600 nm时的最大紫外吸收峰。
1.5.2 标准曲线的制备 精密称取2.5 g GAS,去离子水溶解后转移至25 mL容量瓶中定容,配制成浓度为100 mg/mL的GAS储备液。用移液管精密量取0.25、0.5、1.0、1.5、2.0、2.5 mL储备液置于25 mL容量瓶中,稀释定容得到浓度为10、20、40、60、80、100 mg/mL的标准溶液。以去离子水溶液作为空白对照,测定各标准溶液275 nm处光密度(D)值。以GAS的浓度为横坐标,D值为纵坐标,绘制GAS标准曲线。
1.5.3 包封率与载药量的测定 包封率和载药量是评价纳米递药系统处方及制备工艺的两个重要指标。通过薄膜分散法用不同浓度GAS制备GAS-Lips,在4 ℃条件下以12 000 r/min离心20 min,收集上清液,通过紫外分光光度计在275 nm处测定相对应的D值,按下列公式计算包封率和载药量:
包封率/%=(Wtotal-Wfree)/Wtotal×100%
载药量/%=(Wtotal-Wfree)/Ntotal×100%
其中,Wtotal是系统中的药物总质量;Wfree是溶液中游离的药物总质量,Ntotal是总纳米粒的质量。
1.5.4 释药性分析 采用动态膜透析法研究GAS-Lips的体外释放行为。精密吸取一定量的GAS和GAS-Lips,加到截留分子量为3 500 Da透析袋中,再将透析袋放入含有100 mL pH 7.4的磷酸盐缓冲液的烧杯中,并在37 ℃恒温摇床中以100 r/min进行体外释放实验。于0.5、1、2、4、6、8、10、12 h分别取样2 mL并补充相同体积的磷酸盐缓冲液,4 ℃条件下8 000 r/min离心10 min收集上清液。所取样品用紫外分光光度计在275 nm处测定D值,并带入“1.5.2”标准曲线计算累积释放量。
1.6 体内滞留性考察
将Cy3与Cy3-Lips注射到膝关节腔后,分别在1、6、12 h时使用动物活体成像分析仪观察Cy3与Cy3-Lips在大鼠膝关节部位的荧光信号分布,并进行半定量分析。
1.7 GAS-Lips的体内药效评价
对饲养1周后的大鼠进行前交叉韧带横断术(anterior cruciate ligament transection,ACLT),构建大鼠骨关节炎模型。通过水合氯醛麻醉大鼠,并对其腿部进行剃毛。找到髌韧带与副韧带中间的位置,切开关节囊,找到关节腔所在部位,将胫骨向内侧进行错位。用剪刀将前交叉韧带剪断,后将髌韧带复位并缝合,最后肌肉注射青霉素抗菌,连续3 d。实验分为4组,分别为假手术组、ACLT+未给药组、ACLT+GAS组、ACLT+GAS-Lips组,每组6只,共24只。实验周期为8周,手术后第3周的第1天开始关节腔注射给药,每周给药1次,1次100 μL(5 mg/kg),共给药6次。
1.7.1 治疗过程中大鼠体重称定 从第1次给药开始称量各组大鼠体重并记录,之后每周测定大鼠体重变化,持续6周,以时间为横坐标,体重为纵坐标,绘制大鼠体重变化曲线。
1.7.2 关节炎大鼠膝关节部位离体形态观察 给药6周后,处死骨关节炎大鼠,观察膝关节部位形态变化,并剪除周围肌肉与筋膜组织,用磷酸盐缓冲液清洗干净,拍照记录。
1.7.3 Micro-CT观察膝关节软骨损伤变化 给药6周后,处死并切取骨关节炎大鼠的后肢,磷酸盐缓冲液冲洗干净后立即用4%多聚甲醛固定,用Micro-CT对样品进行成像。
1.7.4 ELISA法检测大鼠血清中炎症因子的表达差异 给药6周后,通过大鼠眼眶取血。每只大鼠眼眶取血1~2 mL。将装有血样的EP管于4 ℃条件下5 000 r/min离心20 min,收集上清液。按照ELISA试剂盒进行实验,在450 nm处测定D值,计算血清中TNF-α、IL-6的含量。
1.8 统计学分析
2 结果
2.1 GAS-Lips的表征
2.1.1 脂质体和GAS-Lips粒径分布及Zeta电位检测 粒径和Zeta电位结果如图1所示。脂质体和GAS-Lips粒径分别为(220.24±2.82)nm和(255.02±3.64)nm,随着GAS加入,粒径增大,表明药物成功载入脂质体中。由于氢化磷脂酰胆碱与胆固醇形成的脂质体表面携带少量负电荷,而GAS是一种带正电荷的单糖,与所形成的脂质体结合,逆转脂质体表面的负电荷,因此GAS-Lips脂质体Zeta电势为正电荷。
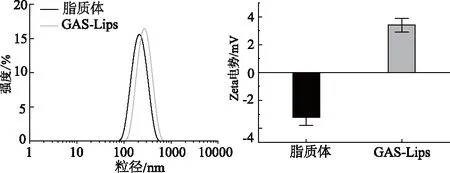
图1 空脂质体与载药脂质体粒径分布与Zeta电势
2.1.2 脂质体和GAS-Lips形态学考察 透射电镜结果如图2所示,脂质体呈球形或类球形,无粘连,分散均一。空白脂质体粒径为(163.25±2.91)nm,GAS-Lips粒径为(214.56±3.76)nm。在脂质体制备过程中,粒径增大,说明GAS载入脂质体中。

图2 脂质体和GAS-Lips透射电镜结果
2.2 GAS-Lips的制剂学评价
2.2.1 GAS检测波长的确定 紫外可见分光光度计扫描200~600 nm波长范围内紫外吸收,结果如图3所示,确定其紫外吸收峰在275 nm处。
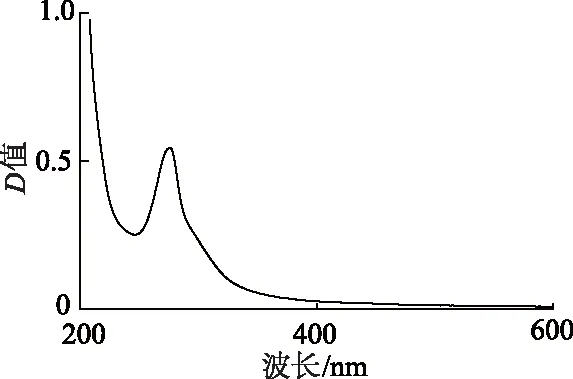
图3 GAS紫外吸收峰
2.2.2 GAS标准曲线的建立 以GAS的浓度为横坐标,D值为纵坐标,对测定结果做线性回归曲线,得到GAS的标准曲线。如图4所示,GAS的标准曲线为y=0.003 6x-0.003 1,R2=0.999 6,GAS浓度在0~100 mg/mL范围内线性关系良好。
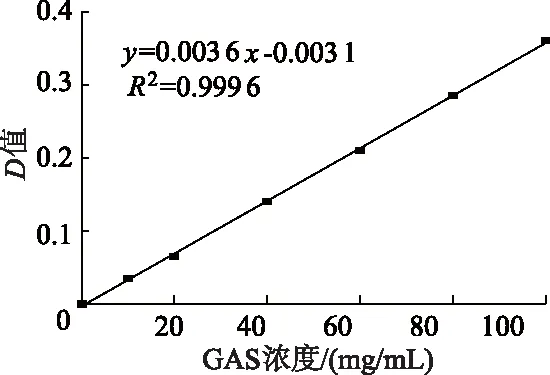
图4 GAS标准曲线
2.2.3 GAS-Lips载药量和包封率的测定 如图5所示,在GAS低浓度时,具有较高的包封率和较低的载药量。随着GAS浓度的增加,GAS-Lips的载药量逐渐增加,包封率下降明显,但载药量增加到一定程度后几乎不变,说明脂质体载药量有限。在不改变配方的前提下,比较不同浓度GAS对载药量和包封率的影响,GAS浓度为4 mg/mL时,具有较高的包封率和载药量,分别为(78.62±1.01)%和(9.90±0.75)%,所以选择GAS浓度为4 mg/mL用于后续实验。
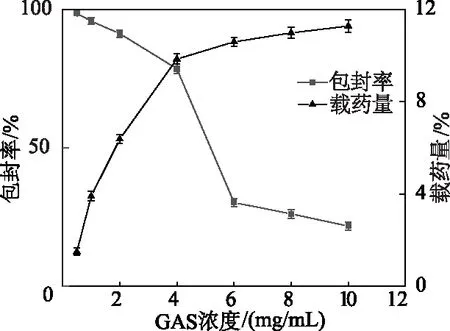
图5 GAS-Lips载药量和包封率的测定
2.2.4 释药性分析 采用动态膜透析法研究制剂的体外释放行为,结果如图6所示,GAS在pH 7.4的磷酸盐缓冲液中,以快速方式进行释放,2 h累计释放量达到(99.61±0.63)%,基本全部释放。相比于GAS,GAS-Lips在溶液中释放速率缓慢,2 h累计释放量为(48.57±2.01)%,12 h累计释放量为(88.62±1.06)%,表明脂质体作为药物载体具有一定的缓释作用。
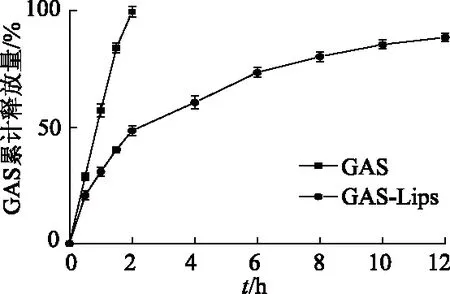
图6 GAS-Lips体外释放曲线
2.3 体内滞留性考察
荧光信号图以及半定量结果如图7所示,Cy3与Cy3标记的脂质体在1 h均在大鼠膝关节部位呈现较强的荧光强度,随着时间的延长荧光强度逐渐减弱。与Cy3组相比,Cy3-Lips组在6 h和12 h时平均荧光强度增加,差异均有统计学意义(P<0.01)。表明脂质体可以增加药物在关节腔部位的黏附和滞留性。
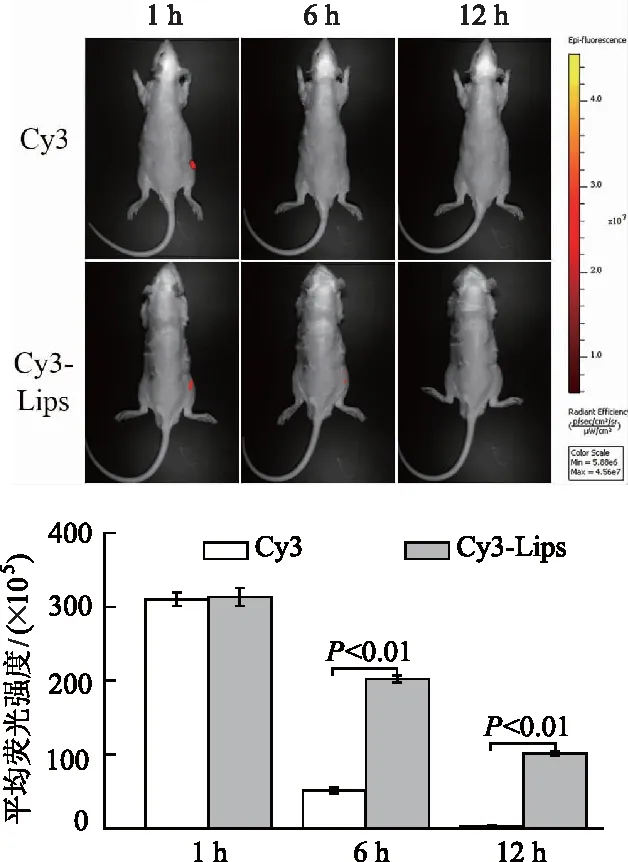
图7 大鼠膝关节荧光信号以及半定量结果
2.4 体内实验
2.4.1 治疗过程中大鼠体重变化 各组大鼠体重变化曲线如图8所示,各组大鼠生长状况良好,体重稳定上升,给药组大鼠与假手术组相比没有明显差异。
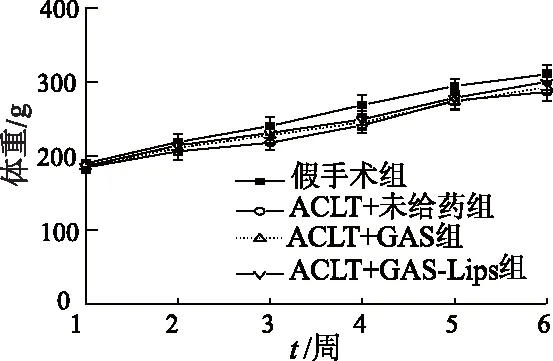
图8 给药过程中大鼠体重变化
2.4.2 大鼠膝关节离体形态考察 如图9所示,假手术组大鼠膝关节软骨损坏较轻,表面相对光滑,周围无骨赘形成;与假手术组比较,其余各组大鼠关节软骨出现损坏,表面出现不光滑现象。其中ACLT+未给药组周围骨赘生成明显、软骨损坏程度最高、表面更粗糙;与ACLT+未给药相比,ACLT+GAS组与ACLT+GAS-Lips组软骨损坏程度轻。与ACLT+GAS组相比,ACLT+GAS-Lips组软骨表面损伤程度较轻,表面更光滑,表明GAS-Lips具有治疗骨关节炎的作用,效果比游离药物好。
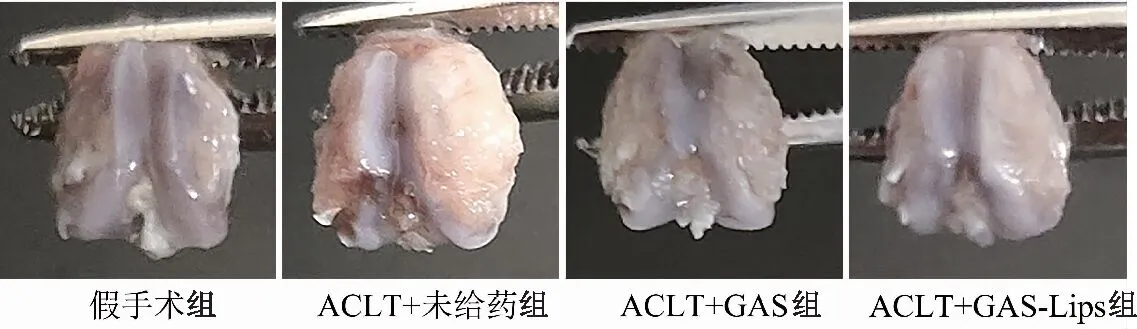
图9 大鼠膝关节形态图
2.4.3 关节Micro-CT成像 如图10所示,与其他各组相比,假手术组大鼠关节面软骨表面较完整,表层基质塌陷区域最少,关节表面相对光滑。与假手术相比,ACLT+未给药组表层基质塌陷区域最多,软骨结构损伤严重,ACLT+GAS-Lips组和ACLT+GAS组软骨表面表层基质塌陷区域较少,软骨结构破坏较轻。与ACLT+GAS组相比,ACLT+GAS-Lips组软骨表面更光滑,表明GAS-Lips具有良好的治疗骨关节炎的作用。
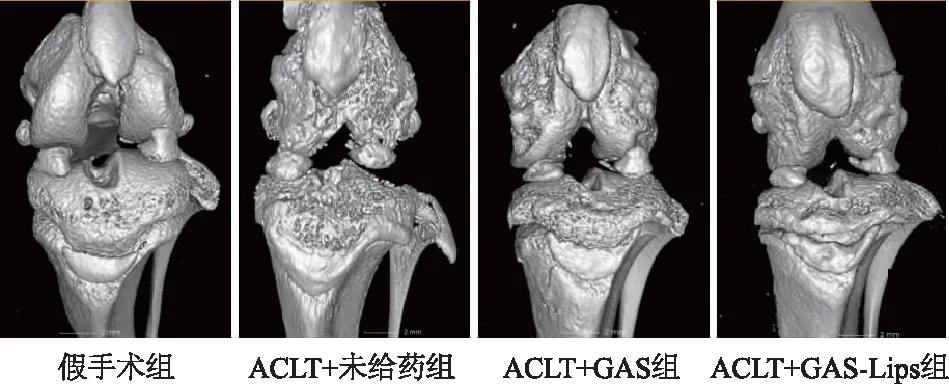
图10 关节Micro-CT成像
2.4.4 大鼠血清中炎症因子的表达差异 ELISA法检测大鼠血清中TNF-α、IL-6表达水平,见图11。与ACLT+GAS-Lips组相比,ACLT+未给药组和ACLT+GAS组炎症因子TNF-α、IL-6表达均增高,差异有统计学意义(P均<0.01)。表明GAS-Lips具有良好的抗炎作用,利于骨关节炎的治疗。
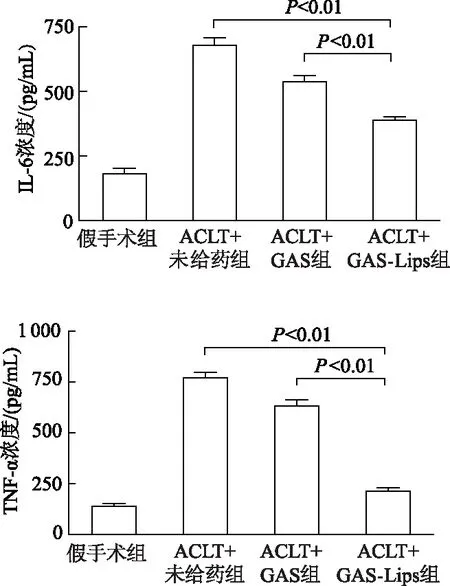
图11 大鼠血清中TNF-α、IL-6的含量
3 讨论
骨关节炎是一种严重影响患者生活质量的关节退行性疾病,伴有关节软骨侵蚀、硬化、滑膜炎症、骨赘(骨刺)和显著的骨质改变[10]。目前构建骨关节炎模型的方法主要有关节腔注射药物(Ⅱ型胶原酶、木瓜蛋白酶、完全弗氏佐剂等)和手术(前交叉韧带切除术、半月板切除术等)两种,由于药物注射成功率低,不稳定[11],因此本研究采用前交叉韧带剪断的方法构建大鼠骨关节炎模型。
炎症因子过表达会加剧软骨的退变,关节腔内炎症反应产生的TNF-α、IL-6会加剧组织的损伤,因此,抑制TNF-α、IL-6等炎症因子的过表达有利于骨关节炎的修复。GAS是一种带电荷的氨基单糖,通过抑制疼痛相关基因和基质金属蛋白酶的活性,降低促炎因子的分泌水平,广泛用于骨关节炎的治疗[12]。在退行性关节疾病中,含有脂质体纳米颗粒的药物在骨关节炎治疗中的作用已被广泛研究。脂质体是一种优良的药物载体,具有稳定药物物理化学性质、增加药物摄取、延长药物释放等多种优势[13-14]。但是部分脂质体由于载药量低,限制了其在骨关节炎方面的临床治疗,因此,制备更有效的载药脂质体纳米粒子可以为临床治疗骨关节炎提供良好的基础。本文所制备的GAS-Lips与其他脂质体相比,具有较高的载药量以及良好的缓释效果。局部注射脂质体,可以更好地增加游离药物的靶向性和滞留性,减少药物体内代谢,达到更好的治疗效果。
本研究选取氢化磷脂酰胆碱与胆固醇作为制备脂质体的材料,其具有一定的润滑和延缓关节磨损的作用,同时采用常规骨关节炎治疗药物GAS,通过降低促炎因子分泌的作用,达到保护软骨和抗炎的作用。
总之,本研究通过薄膜分散法制备脂质体,制备工艺较为简单。负载游离药物GAS,增加药物在骨关节炎部位的缓释作用,增强药效,为骨关节炎药物的开发提供研究基础。

