大脑前额皮层Nrg1基因敲低对小鼠精神分裂症样行为形成的影响
丛启杰,曾荣森,刘耘溪,孙竞
(江苏大学药学院,江苏 镇江 212013)
精神分裂症是一种以思维与行为不协调为主要特征的重度精神类疾病,其发生与神经发育相关基因突变密切相关[1]。神经调节素1(neuregulin 1, Nrg1)是精神分裂症易感基因,在调控神经元树突发育、轴突髓鞘形成等神经活动中发挥重要作用[2-3]。值得注意的是,不同脑区基因表达变化与精神分裂症的发生发展密切相关[4],其中前额皮层是兴奋性谷氨酸神经系统投射以及大脑思维活动控制的重要区域[5]。研究发现,地卓西平诱导的神经发育精神分裂症小鼠模型中NRG1蛋白表达下降;奥氮平、利培酮和氟哌啶醇能够上调NRG1表达并发挥抗精神分裂症行为异常的作用[6]。郭文平等[7]研究通过双环己酮草酰二腙诱导的发育障碍精神分裂症小鼠模型发现,前额皮层Nrg1mRNA和NRG1蛋白表达降低,推测Nrg1基因可能参与少突胶质细胞的脱髓鞘和髓鞘再生。研究表明,前额皮层与其他脑区的功能性连接障碍[8]、神经递质紊乱[9]及精神分裂症的异常行为存在关联,但前额皮层Nrg1基因突变对小鼠精神分裂症行为异常的影响尚不清楚。因此,本研究通过脑立体定位注射技术构建前额皮层Nrg1基因敲低C57BL/6小鼠,对其神经行为表型进行鉴定,以研究大脑前额皮层Nrg1基因敲低在C57BL/6小鼠精神分裂症样行为表型形成中的作用,并初步探究其导致精神分裂症表型的相关分子信号机制。
1 材料与方法
1.1 siRNA来源、主要试剂及仪器
阴性对照siRNA(产品编号:siN0000004-4-10)购自广州锐博生物技术有限公司;Nrg1-siRNA(靶标序列:GTCTAGGACATAGTGAGTA)委托广州锐博生物技术有限公司合成,通过2′甲氧基及5′胆固醇修饰siRNA,聚丙烯酰胺凝胶电泳法纯化siRNA,干粉状态于-20 ℃保存。
PBS、Trizol裂解液、NanoDropTM8000分光光度计、逆转录试剂盒均为美国Thermo公司产品;荧光定量试剂盒(德国Roche公司);IP细胞裂解液、BCA蛋白浓度测定试剂盒、蛋白上样缓冲液均购自碧云天试剂公司;蛋白质常规分子标志物、小鼠抗小鼠β-肌动蛋白单克隆抗体、兔抗小鼠NRG1单克隆抗体、兔抗小鼠囊泡型γ-氨基丁酸转运体(vesicular GABA transporter,VGAT)多克隆抗体、羊抗兔二抗、羊抗小鼠二抗均购自武汉三鹰公司;小鼠抗小鼠囊泡型谷氨酸转运体-1(vesicular glutamate transporter 1, VGLUT1)单克隆抗体(英国Abcam公司);脑立体定位仪(广州瑞沃德公司);旷场实验箱、高架十字迷宫均为上海然哲仪器设备公司产品;Noldus EthoVision XT软件(北京诺达思公司);LightCycler®96 System(德国Roche公司);电泳仪(美国Bio-Rad公司);凝胶成像分析系统(上海勤翔科学仪器公司)。
1.2 动物模型建立
1.2.1 动物及分组 8周龄SPF级成年雄性C57BL/6小鼠45只,体质量22~25 g,购自江苏大学实验动物中心,许可证号:SCXK(苏)2018-0012。基于旷场实验将小鼠分为3组:正常对照组,阴性对照组和Nrg1-siRNA组,每组15只。
1.2.2 脑立体定位注射 采用戊巴比妥钠(30 mg/kg)麻醉小鼠,剪去头顶部毛发,固定于脑立体定位仪。头顶部正中切口,暴露前囟和后囟,调整固定器使前囟和后囟在同一水平面上。采用颅骨标志定位,注射位点为矢状缝左侧1.5 mm,前囟前1.5 mm,颅骨平面向下1.5 mm处,另一侧位与矢状缝对称。正常对照组两侧前额皮层注射2 μL PBS,阴性对照组和Nrg1-siRNA组小鼠两侧前额皮层分别注射2 μL 0.25 mmol/L阴性对照siRNA和Nrg1-siRNA,每侧注射10 min,结束后滞留时间5 min。取出注射器,缝合皮肤,将小鼠放置于保温环境中适应,观察小鼠状态,4 d后进行后续实验。
1.3 前脉冲抑制实验
小鼠放入背景噪音为65 dB的检测箱中适应5 min,每15 s通过伪随机试验进行前脉冲抑制测试,测试包括6次惊吓脉冲(120 dB,40 ms/次),144次混合类型脉冲,接着6次惊吓脉冲后结束,共计156次测试。混合类型脉冲包括:背景噪音(65 dB,80 ms/次),单独惊吓脉冲(120 dB,40 ms/次),5种单独前脉冲(分别为69、73、77、81、85 dB,20 ms/次),5种单独前脉冲与惊吓脉冲联合(140 ms/次)。前脉冲抑制率(%)=(1-前脉冲与惊吓脉冲联合刺激反应幅度/单独惊吓脉冲反应幅度)×100%。在每次测试之间,用75%乙醇彻底清洗检测箱,以消除嗅觉提示再进行下一组实验。
1.4 旷场实验检测小鼠自发运动
通过在旷场实验箱中监测小鼠的活动来评估小鼠的自发活动。将小鼠放置在设备的中央,自由记录30 min。箱体上方装备行动轨迹采集摄像机,Noldus EthoVision XT软件分析处理运动轨迹和参数。分析运动轨迹和总步行距离判断各组自发运动变化情况。在每次测试之间,用75%乙醇彻底清洗实验箱,以消除嗅觉提示。
1.5 高架十字迷宫实验检测小鼠焦虑状态
高架十字迷宫是非条件反射模型,以动物自发的恐惧反应为行为学基础。该设备由悬空的十字架型臂组成,包含一组开放臂和一组封闭臂。将小鼠头部朝向非开放臂放置在四个臂的中央区域,自由记录5 min。箱体上方装备行动轨迹采集摄像机,通过Noldus EthoVision XT软件分析处理运动轨迹和参数。记录动物进入开放臂时间百分比和次数百分比。在每次测试之间,用75%乙醇彻底清洗实验箱,以消除嗅觉提示。
1.6 实时荧光定量PCR法检测Nrg1 mRNA表达
取前额皮层区域注射部位脑组织50~70 mg,采用Trizol法提取总RNA。使用NanoDropTM8000分光光度计检测总RNA含量和纯度。逆转录体系包括总RNA模板5 μg,Oligo(dT)18引物1 μL,加无RNA酶水至12 μL,65 ℃加热5 min。加入反应缓冲液4 μL,RNA酶抑制剂1 μL,10 mmol/L dNTP混合液2 μL和RevertAid RT 1 μL,短暂离心后42 ℃加热60 min,70 ℃加热5 min。继而取cDNA 2 μL,SYBR Green Master 10 μL,正向和反向引物各0.2 μL,无RNA酶水加至20 μL体系,行实时荧光定量PCR检测。95 ℃ 预热10 min;95 ℃ 10 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环;72 ℃ 5 s,95℃ 1 s;程序:37 ℃ 冷却30 s。以β-肌动蛋白为内参基因,采用2-ΔΔCt方法计算结果。β-肌动蛋白:正向引物5′-GTGACGTTGACATCCGTAAAGA-3′,反向引物5′-GCCGGACTCATCGTACTCC-3′;Nrg1:正向引物5′-TTCCCATTCTGGCTTGTCTAGT-3′,反向引物5′-CCAGGGTCAAGGTGGGTAG-3′。
1.7 蛋白免疫印迹法检测NRG1、VGAT和VGLUT1蛋白表达
取注射部位前额皮层区域脑组织,低温匀浆后冰上裂解30 min;4 ℃行14 000×g离心15 min,取上清液。BCA法测定蛋白浓度,加入蛋白上样缓冲液制备蛋白样品,100 ℃煮沸5 min变性处理。经12.5% SDS-PAGE分离蛋白;80 V分离20 min,110 V分离70 min;300 mA转膜90 min至PVDF膜;将膜置于封闭液中室温封闭1 h;TBST洗膜3次,每次15 min;将膜置于一抗稀释液中(NRG1、VGAT和VGLUT1,稀释比均为1 ∶1 000,β-肌动蛋白稀释比为1 ∶2 000,稀释液为TBST),4 ℃孵育过夜;TBST洗膜3次,每次15 min;将膜置于二抗稀释液中(羊抗兔二抗和羊抗小鼠二抗稀释比均为1 ∶1 000,稀释液为TBST),室温孵育1 h;TBST洗膜3次,每次15 min;ECL超敏发光液曝光,化学发光成像系统成像拍照,Image J软件用于灰度分析。
1.8 统计学分析
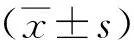
2 结果
2.1 Nrg1-siRNA注射降低前额皮层Nrg1 mRNA和NRG1蛋白表达量
注射后4 d,每组随机抽取5只小鼠检测前额皮层Nrg1mRNA和NRG1蛋白表达量。结果显示,Nrg1-siRNA组小鼠前额皮层注射脑区Nrg1mRNA和NRG1蛋白表达量均显著低于正常对照组(t=9.860、5.770,P均<0.01)。与正常对照组相比,阴性对照组Nrg1mRNA和NRG1蛋白表达差异无统计学意义(t=1.069、1.436,P均>0.05)。由此表明,前额皮层Nrg1基因敲低小鼠模型构建成功。见图1。
a: P<0.01,与正常对照组比较
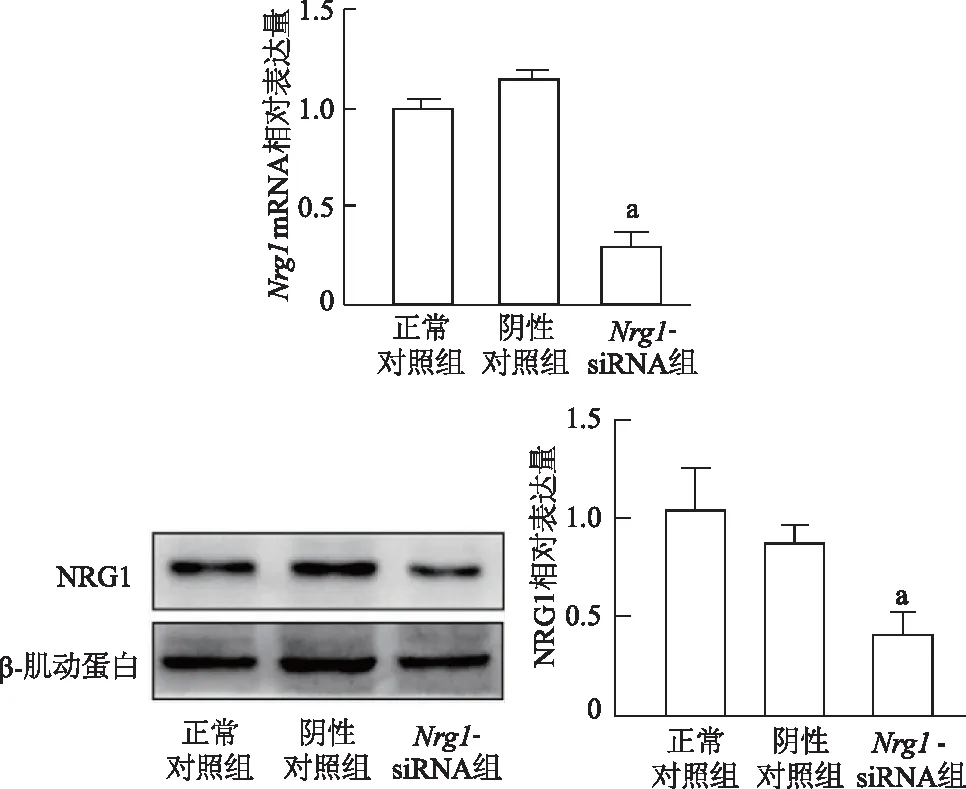
2.2 前额皮层Nrg1基因敲低小鼠前脉冲抑制受损
前脉冲抑制实验结果显示,在前脉冲预刺激为69 dB、73 dB、77 dB、81 dB和85 dB时,Nrg1-siRNA组小鼠的前脉冲抑制率均显著低于正常对照组(t=3.481、3.296、3.755、3.489、3.498,P均<0.05);正常对照组与阴性对照组相比,差异无统计学意义(P均>0.05)。由此表明,Nrg1基因敲低小鼠前脉冲抑制受损。见图2。
a: P<0.05,与正常对照组比较
2.3 前额皮层Nrg1基因敲低小鼠自发活动量增加
旷场实验结果显示,与正常对照组相比,Nrg1-siRNA组小鼠移动总距离显著增长(t=6.874,P<0.01),平均速度也显著升高(t=4.607,P<0.01),表明小鼠的自发活动量增加。此外,Nrg1-siRNA组小鼠在中心滞留的时间显著低于正常对照组(t=5.805,P<0.01),提示小鼠可能出现了焦虑行为。见图3。

a: P<0.01,与正常对照组比较
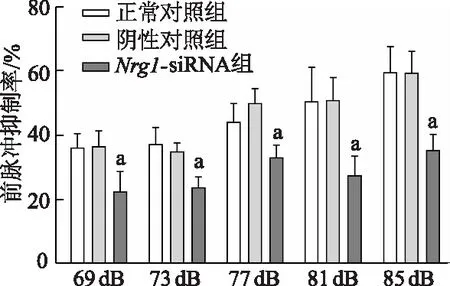
2.4 前额皮层Nrg1基因敲低小鼠表现出焦虑行为
高架迷宫实验结果显示,Nrg1-siRNA组小鼠进入开放臂的次数百分比和时间百分比显著低于正常对照组(t=6.501、6.466,P均<0.01),正常对照组与阴性对照组相比,差异无统计学意义(P均>0.05)。由此说明Nrg1基因敲低小鼠出现了焦虑样行为异常。见图4。
a: P<0.01,与正常对照组比较
2.5 前额皮层Nrg1基因敲低对VGAT和VGLUT1蛋白表达的影响
蛋白免疫印迹结果表明,与正常对照组相比,Nrg1-siRNA组小鼠前额皮层VGAT蛋白表达水平未发生显著变化,VGLUT1/VGAT比值明显增加(t=10.180,P<0.01)。正常对照组与阴性对照组相比,差异无统计学意义(P>0.05)。见图5。
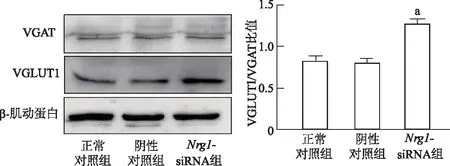
a: P<0.01,与正常对照组比较
3 讨论
siRNA作为转染质粒,可直接用于在体动物转染,与以病毒为载体的shRNA相比,具有毒性低、安全性高等特点。本研究采用脑立体定位注射Nrg1-siRNA构建前额皮层Nrg1基因敲低小鼠,结果显示,Nrg1-siRNA组小鼠大脑前额皮层Nrg1mRNA和NRG1蛋白表达量均显著降低,表明Nrg1基因敲低小鼠模型构建成功。阴性对照组小鼠大脑前额皮层Nrg1mRNA和NRG1蛋白表达量变化差异无统计学意义,验证了Nrg1-siRNA的特异性,不存在非特异性敲低现象,进一步证实Nrg1基因敲低模型的可靠性。目前研究认为,精神分裂症症状主要分为阳性症状、阴性症状和认知功能障碍[10]。精神分裂症患者感觉门控功能损伤是导致以前脉冲抑制率降低和言行不一致为表现的阳性症状的主要原因之一[11]。Hong等[12]研究提出,Nrg1基因rs3924999的错义突变可能与精神分裂症患者前脉冲抑制功能的减弱有关。本研究显示,前额皮层Nrg1基因敲低小鼠的前脉冲抑制率显著降低,初步验证了以上结论。另一方面,自发活动量增加被认为是与精神分裂症阳性症状密切相关的异常行为[13]。本研究旷场实验结果显示,前额皮层Nrg1基因敲低小鼠的移动总距离和移动速度显著增加,提示小鼠出现精神分裂症阳性症状。同时,本研究还发现,前额皮层Nrg1基因敲低小鼠在旷场中心区域滞留的时间显著降低,这可能与小鼠的焦虑行为有关,与精神分裂症阳性症状一致。临床研究也发现,约65%精神分裂症患者会出现焦虑状行为[14]。为进一步验证小鼠的焦虑行为,本研究采用高架十字迷宫评价小鼠的焦虑情况。结果显示,前额皮层Nrg1基因敲低小鼠更加倾向于进入封闭臂,进入开放臂的时间百分比和次数百分比显著低于正常对照组,表明Nrg1基因敲低会导致小鼠出现焦虑样行为异常。以上结果表明,前额皮层Nrg1基因敲低会导致小鼠出现精神分裂症样的前脉冲抑制损伤、自发活动量增加和焦虑样行为,与临床上观察到的精神分裂症患者阳性症状一致。
为初步探究前额皮层Nrg1基因敲低诱导精神分裂症阳性症状的分子机制,本研究检测了抑制性神经元标志物VGAT和兴奋性神经元标志物VGLUT1的表达水平。VGAT为γ-氨基丁酸转运体,VGLUT1为谷氨酸转运体,其发挥转载神经递质进入囊泡并释放进入突触间隙的作用,调节突触间抑制性和兴奋性神经递质的平衡[15]。本研究结果显示,前额皮层Nrg1基因敲低增加了前额皮层VGLUT1蛋白的表达水平,对VGAT蛋白表达没有显著影响,从而致前额皮层VGLUT1/VGAT比值升高,提示Nrg1基因敲低后突触间兴奋性神经递质和抑制性神经递质的转运出现失衡,这可能是导致呈现精神分裂症阳性症状的原因之一。多项研究采用质子磁共振光谱法发现,精神分裂症患者中谷氨酸升高[16],结合本实验结果中VGLUT1蛋白升高的现象,本研究后续可进一步探讨谷氨酸代谢是否在Nrg1基因敲低导致的精神分裂症样行为异常中发挥作用。
本研究在成年C57BL/6小鼠模型中验证了前额皮层Nrg1基因敲低诱发的精神分裂症样行为异常,避免了基因编辑动物维护成本高和周期长的缺陷,为后期快速构建精神分裂症在体模型以及不同脑区精神分裂症易感基因精准调控研究提供了新的方法学研究基础。本实验以成年小鼠为模型,与精神分裂症神经发育假说的相关性还需加强,后期应进一步探究易感基因突变影响局部脑区神经发育异常的机制。
综上所述,前额皮层Nrg1基因敲低可导致C57BL/6小鼠出现以前脉冲抑制损伤、自发活动量增加以及焦虑为特征的精神分裂症样行为改变,其分子机制可能与前额皮层γ-氨基丁酸和谷氨酸的转运平衡失调有关。

