富含亮氨酸重复序列蛋白 1 通过上调哺乳动物雷帕霉素靶蛋白表达促进乳腺癌细胞迁移和侵袭
王乐, 朱孝仁, 彭诗晴, 陈敏斌
(1. 江苏大学医学院,江苏 镇江 212013; 2. 江苏大学附属昆山第一人民医院肿瘤科,江苏 昆山 215300)
乳腺癌已成为女性最常见的恶性肿瘤[1-2]。乳腺癌转移是长期以来肿瘤基础和临床研究的重要癌症特征[3]。研究发现,在最初诊断和治疗后的几个月或几年内,乳腺癌细胞可以转移至其他部位[4-7],如肝脏[8]、大脑[9]、骨骼[10]或肺部[11]等。另有研究表明,伴有远处转移的乳腺癌患者预后差[12],复发率高[13],生存期短[14]。目前认为,多个促癌基因过度表达及活化是发生乳腺癌浸润、转移和进展的主要原因[15-16]。
富含亮氨酸重复序列蛋白1(leucine-rich repeat protein 1, LRR1) 基因所编码的蛋白质含有一个富含亮氨酸的重复序列,对于肿瘤转移的调控具有重要作用[17]。临床研究表明,LRR1在侵袭性胃癌患者血清中呈高表达[18]。另有研究发现,LRR1长链非编码 RNA 可以促进胃癌侵袭[19]。目前,关于LRR1和乳腺癌转移间的相关性尚不清楚,本研究拟以乳腺癌 MDA-MB-231、HCC70 细胞株为研究对象,探讨LRR1对乳腺癌细胞的影响及相关机制。
1 材料与方法
1.1 细胞系、主要试剂及仪器
人乳腺上皮MCF-10A细胞系购于上海富衡细胞库;人乳腺癌MDA-MB-231、HCC70细胞系购于上海生命科学研究院细胞资源中心。PBS、胎牛血清(美国Hyclone公司);HitransG病毒感染试剂 (A/P) 购自上海吉凯基因科技有限公司;逆转录试剂盒(日本TaKaRa公司);四甲基乙二胺(碧云天生物技术有限公司);MEM、1%青霉素/链霉素、胰酶、溴酚蓝、二甲基亚砜、Triton X-100 (美国Sigma公司);BCA蛋白定量试剂盒、离心机、CO2恒温培养箱(美国Thermo公司);超净工作台(山东博科生物产业有限公司);凝胶成像仪(美国Analytikjena公司);电泳上样缓冲液、TEMED(碧云天生物技术有限公司);脱脂奶粉(美国BD公司);PVDF 膜(美国Millipore公司) ;兔抗人LRR1、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, m-TOR)、β-肌动蛋白一抗,羊抗兔二抗(英国Abcam 公司)。转染序列均由吉凯基因公司合成。
1.2 细胞培养、分组及慢病毒转染
1.2.1 细胞培养 在培养基中加入100 ng/mL霍乱毒素配制成完全培养基,于37 ℃、5% CO2细胞培养箱中培养人乳腺上皮MCF-10A 细胞;用含 10% 胎牛血清、100 U/mL 青霉素和100 U/mL 链霉素的 DMEM,于37 ℃、5% CO2细胞培养箱中培养人乳腺癌 HCC70 和 MDA-MB-231 细胞。
1.2.2 细胞分组及转染 取“1.2.1”乳腺癌MDA-MB-231和HCC70细胞,分为干扰对照组、LRR1干扰组、LRR1过表达组和空载体对照组,分别转染LRR1干扰对照序列(TTCTCCGAACGTGTCACGT)、LRR1干扰序列(GTGGTCTTAGTAGATAATT)、LRR1过表达序列(AGGTCGACTCTAGAGGATCCCGCCACCATGAAGCTACACTGTGAGGTGGAG)和空载体序列(TCCTTGTAGTCCATACCCTTTAACATATCAGAGGAATT-AACATAAC)。每孔加入适量完全培养基,接种于6孔板,每孔细胞数5×105个,培养12 h左右;取1.5 mL无酶EP管,加入100 μL无血清培养基,再加入2 μL Lipofectamine 2000并轻轻混匀配置成a液;取无菌1.5 mL EP管,加入100 μL无血清培养基,加入LRR1干扰序列或者干扰对照序列,混匀配置成b液;再加入LRR1过表达序列或者空载体对照序列,混合配置成c液,将a、b液以及a、c液混合,室温放置20 min形成转染复合物;当细胞密度达30%~50%时,每孔加入200 μL转染复合物,置于细胞培养箱中培养48 h。
1.3 Transwell 实验检测乳腺癌细胞迁移能力
取“1.2.2”4组转染细胞接种于24孔板,培养过夜;每孔加入0.6 mL含10%胎牛血清的 DMEM, 37 ℃孵育过夜;胰酶消化并离心;取0.2 mL细胞混悬液沿着Transwell 小室的侧壁匀速注入标记好的相应24孔板中,静置2 min;37 ℃培养24 h;10%甲醇固定15 min;0.1%结晶紫染色30 min;光镜下观察膜背面侵袭细胞数。
1.4 Transwell 实验检测乳腺癌细胞侵袭能力
取“1.2.2”转染细胞接种于24孔板,培养过夜;每孔加入0.6 mL预热的含有10%胎牛血清的DMEM, 37 ℃孵育过夜;每孔用预冷的枪头吸取0.03 mL Matrigel 胶沿着小室侧壁缓慢注入Transwell 小室;37 ℃孵育2 h;胰酶消化并离心;加入4 mL含有1%胎牛血清的DMEM进行重悬,取细胞混悬液加入Transwell小室底部,静置2 min;于37 ℃孵育24 h ;PBS清洗2次;每孔加入1 mL细胞固定液常温固定30 min;PBS清洗2次;每孔加入1 mL结晶紫常温染色30 min;PBS清洗3次;小室自然风干;刮除小室上层未穿过小室孔膜的乳腺癌细胞;光镜下观察膜背面侵袭细胞数。
1.5 蛋白免疫印迹法检测乳腺癌细胞LRR1和m-TOR蛋白表达
1.5.1 LRR1蛋白表达检测 取“1.2.1”乳腺癌MDA-MB-231和HCC70细胞和人乳腺上皮MCF-10A细胞,接种于6孔板,保证细胞数>1×106个,置于冰上,每孔按照细胞数加入0.09 ~ 0.15 mL细胞裂解液,裂解细胞15 min;12 000 r/min离心15 min,BCA法蛋白定量;行10% SDS-PAGE,80 V电泳,当蛋白条带至分离胶时换成110 V,电泳2 h左右;110 V转膜2 h至PVDF膜;10%脱脂牛奶4 ℃封闭120 min;分别加入兔抗人LRR1抗体、β-肌动蛋白抗体(内参),均 1 ∶1 000稀释,4 ℃孵育过夜;1% PBST洗膜3次;4 ℃孵育二抗(1 ∶1 000稀释)2 h;ECL液曝光和显影,Image J软件进行灰度扫描,计算目的条带的相对灰度值。
1.5.2 m-TOR蛋白表达检测 取“1.2.2”转染细胞,检测m-TOR蛋白表达,其中兔抗人m-TOR蛋白1 ∶1 000稀释,其余方法同“1.5.1”。
1.6 统计学分析
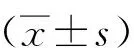
2 结果
2.1 LRR1在人乳腺癌细胞中呈高表达
蛋白免疫印迹结果显示,人乳腺癌MDA-MB-231、HCC70细胞中LRR1表达显著高于人乳腺上皮MCF-10A细胞(t=-13.472,-12.270,P均<0.01)。见图1。
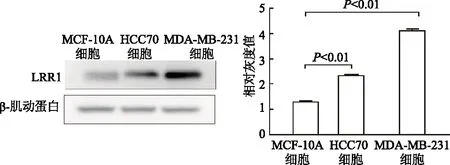
图1 蛋白免疫印迹法检测不同乳腺细胞中LRR1表达
2.2 LRR1对乳腺癌细胞迁移能力的影响
在乳腺癌MDA-MB-231、HCC70细胞中,与干扰对照组相比,LRR1干扰组细胞迁移数明显减少(t=18.939,10.070,P均<0.01);与空载体对照组相比,LRR1过表达组细胞迁移数明显增加(t=-22.840,-33.954,P均<0.01)。见图2。
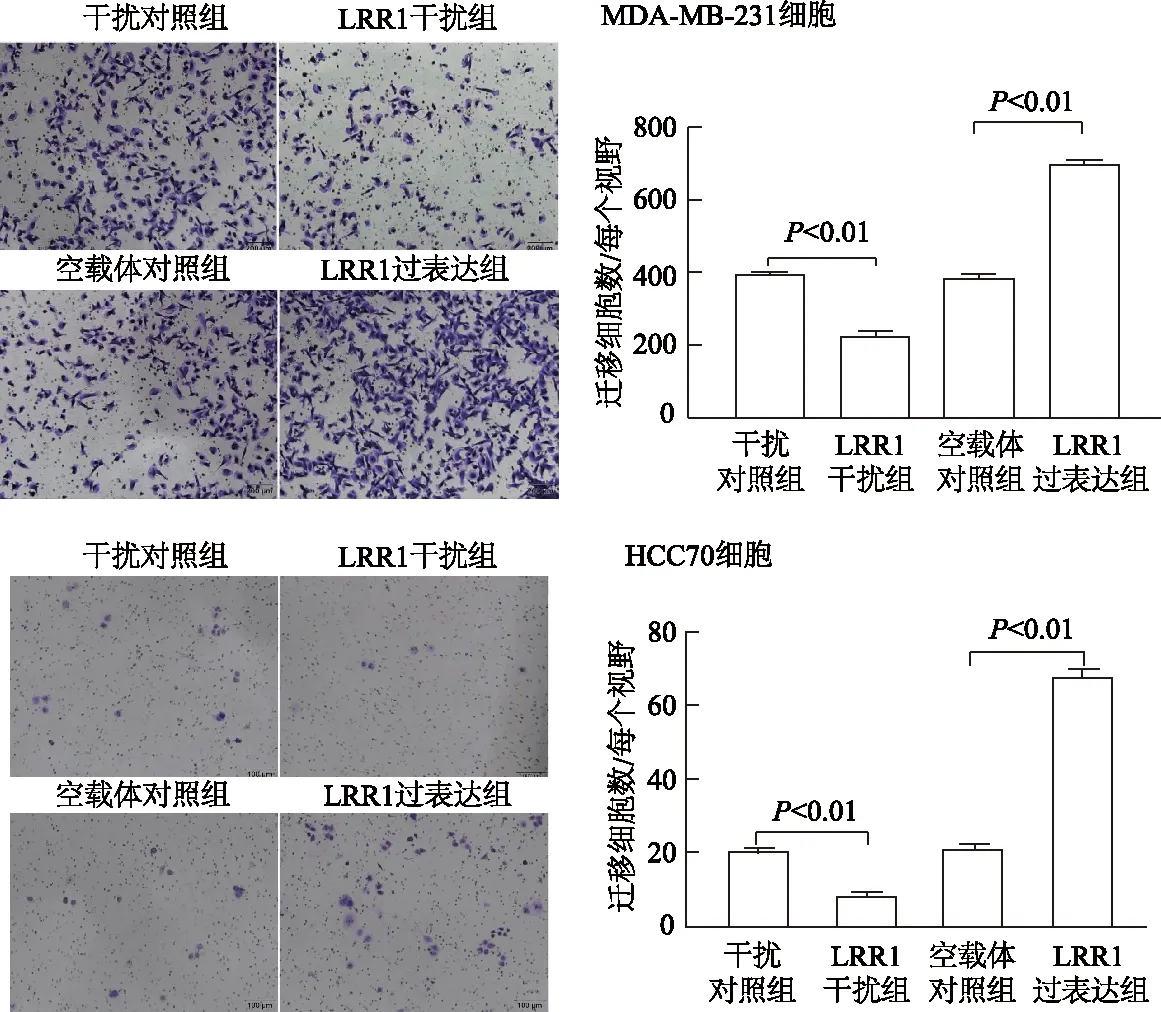
图2 各组乳腺癌细胞迁移能力比较(×100)
2.3 LRR1对乳腺癌细胞侵袭能力的影响
在乳腺癌MDA-MB-231、HCC70 细胞中,与干扰对照组相比,LRR1干扰组细胞侵袭数明显减少(t=18.059,6.860,P均<0.01); 与空载体对照组相比,LRR1过表达组细胞侵袭数明显增加(t=-24.050,-12.072,P均<0.01)。见图3。
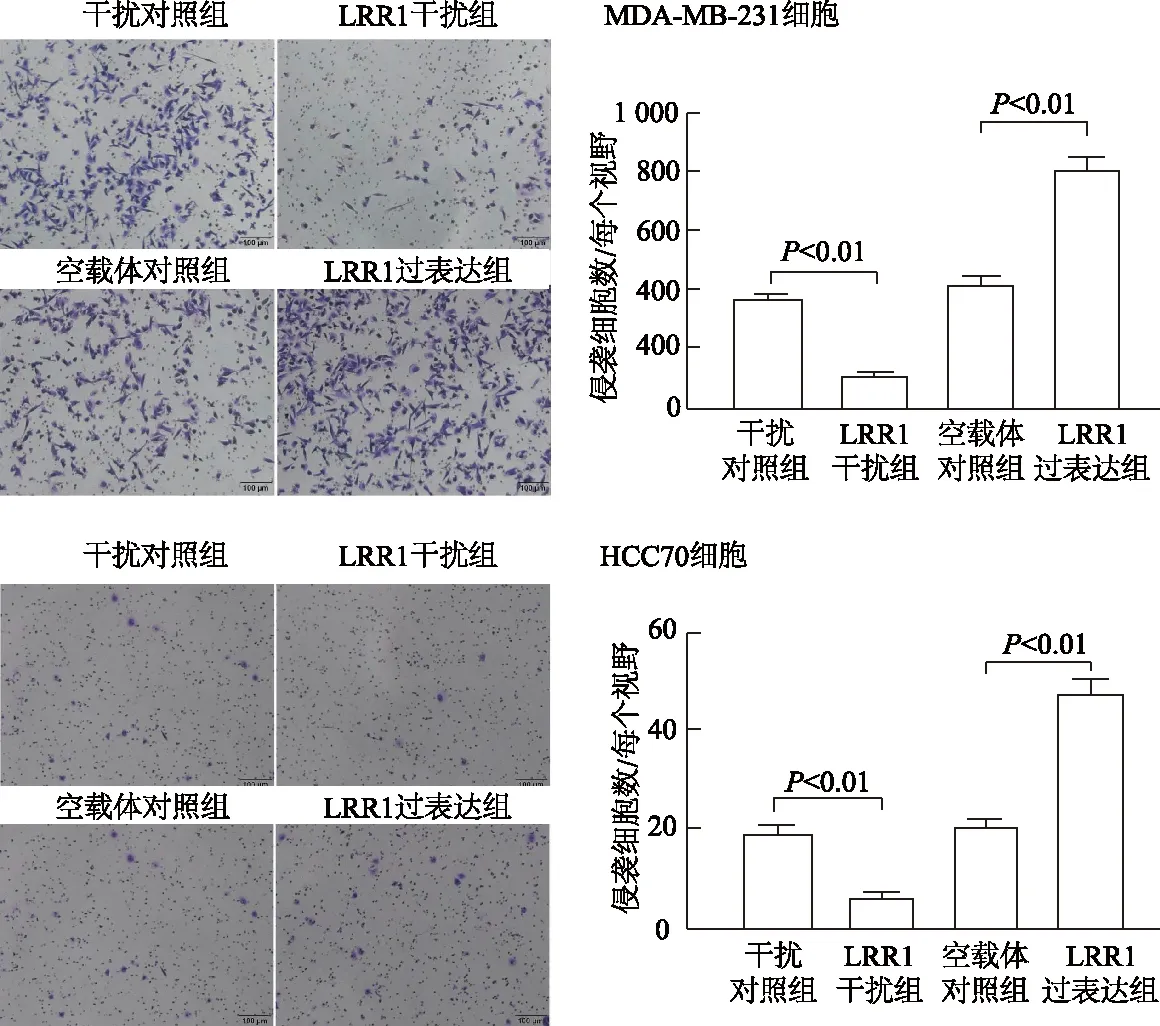
图3 Transwell实验检测各组细胞侵袭能力(×100)
2.4 LRR1对乳腺癌细胞m-TOR 表达的影响
在乳腺癌MDA-MB-231、HCC70细胞中,与干扰对照组相比,LRR1干扰组m-TOR表达水平显著降低(t=7.804,7.496,P均<0.01);与空载体对照组比较,LRR1过表达组m-TOR表达水平明显增高(t=-10.405,-7.031,P均<0.01)。见图4。
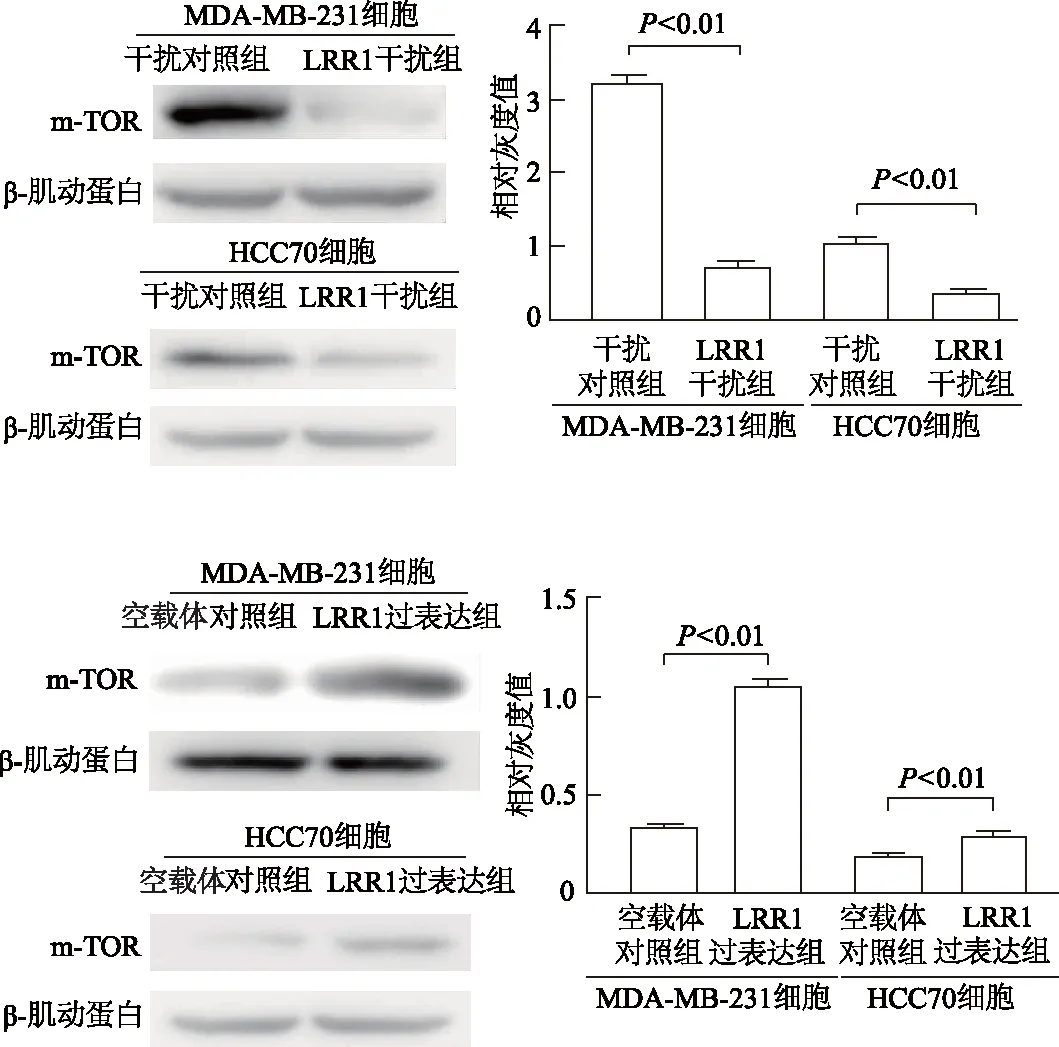
图4 蛋白印迹实验检测各组细胞m-TOR蛋白表达
3 讨论
以往研究发现,LRR1高表达与乳腺癌患者不良预后相关[20]。本研究结果发现,LRR1在乳腺癌细胞中呈高表达,与之前报道一致[21]。由此提示,LRR1可能作为乳腺癌新的诊断分子标志物,其高表达极有可能参与调控乳腺癌的发生发展。此外,本研究结果显示, LRR1高表达可促进乳腺癌细胞迁移和侵袭,由此提示,在乳腺癌进展中,LRR1可能作为促癌因子发挥作用。然而,在肾细胞癌中LRR1高表达则抑制肿瘤进展[22],这可能与肿瘤的异质性以及不同的分子调控机制有关。
LRR1可通过参与蛋白质的泛素化过程和蛋白酶体降解[23-24],进而影响细胞的生物学功能。本研究发现,LRR1干扰后m-TOR表达显著降低;而过表达则相反;由此提示LRR1可能通过调节m-TOR表达促进乳腺癌侵袭和转移。既往研究发现,m-TOR异常活化可促进前列腺癌细胞转移[25];另有研究表明激活细胞外调节蛋白激酶(ERK)/m-TOR信号通路可以促进肝癌细胞转移[26]。然而,LRR1是否直接靶向调节m-TOR表达促进乳腺癌的转移尚未明确,具体机制有待后续深入研究。
综上所述, LRR1可能作为促癌因子通过调节m-TOR表达进而调控乳腺癌细胞的迁移和侵袭。但是,本研究仅在体外乳腺癌细胞中进行,后续有待在临床样本中研究LRR1对乳腺癌的诊断价值。此外,LRR1与m-TOR在乳腺癌中的生物学功能以及相关信号转导通路的激活有待后续进一步研究。

