慢性食物蛋白诱导性小肠结肠炎综合征患儿的临床特征与早期识别
龙云, 秦臻, 卓琳, 吴成
(安徽省儿童医院消化内科,安徽 合肥 230051)
60%的儿童食物过敏累及消化系统[1],其中食物蛋白诱导性小肠结肠炎综合征(food protein-induced enterocolitis syndrome,FPIES)多发生于婴儿期,也有报道在出生后的数小时内即可出现,是非IgE介导的一种食物过敏性胃肠病[2]。FPIES患儿发病率逐年升高[3],多种食物都可能触发FPIES,包括牛奶[4]、大豆[5]、鸡蛋[6]、谷物[7]、鱼类[8]及母乳[9]等,可以是一种或多种食物过敏。慢性FPIES临床表现为间歇性呕吐、腹泻、脱水、低血压、低血容量性休克等症状,其中低白蛋白血症和体重增长不良是慢性型FPIES的独立预测因素[10-11];临床上常被误诊为病毒、细菌感染的胃肠炎、败血症,胃食管反流或肠旋转不良等外科急腹症,甚至是代谢、神经系统疾病[12],其诊断延迟中位时间可达4~7个月[13]。有学者对慢性FPIES患儿进行了回顾性分析,研究多探讨发病率[13]、常见过敏食物[14]及FPIES持续存在可能的独立危险因素[15]等,但缺乏对慢性FPIES患儿中炎性指标等相关研究。因此,本研究回顾分析安徽省儿童医院消化内科13例慢性FPIES患儿的临床资料,通过对临床特征及炎性指标(中性粒细胞、CRP、IL-6等)的分析,探讨慢性FPIES患儿的早期识别指标。
1 病例与方法
1.1 研究对象
选择2017年9月至2020年7月在安徽省儿童医院消化内科住院的慢性FPIES患儿13例,首次发病年龄为2~60 d,另选择同期15例急性FPIES患儿作为对照,首次发病年龄为22~480 d。
本研究获得安徽省儿童医院伦理委员会审核批准(审批号:EYLL-2020-025)并获得患儿父母知情同意。
1.2 纳入与排除标准
参照2017年美国变态反应、哮喘和免疫学会颁布的FPIES诊断的共识指南[12],所有患儿均符合FPIES诊断标准。FPIES临床表型依据发病年龄、病程以及是否伴发相应IgE介导的食物过敏反应等划分。其中,急性FPIES主要标准:呕吐发生在摄入可疑食物1~4 h后,并且缺乏典型的IgE介导的皮肤或呼吸道过敏症状;次要标准:在进食同样的可疑食物后,第2次(或更多次)重复性呕吐发作;进食不同的食物1~4 h后反复出现呕吐;有极度嗜睡症状者;有面色苍白症状者;发病时需要去急诊科就诊者;需要静脉液体支持治疗者;进食后24 h内出现腹泻(通常为5~10 h);低血压;低体温。满足主要标准和3个以上的次要标准即可临床诊断为急性FPIES。慢性 FPIES诊断标准:患者规律进食致敏的食物,引起间歇性发作但逐渐加重的呕吐和腹泻症状,在剔除致敏食物后几天内症状缓解,重新摄入致敏食物发生急性FPIES反应(摄入后1~4 h呕吐,24 h内腹泻),重症者脱水、代谢性酸中毒和休克。排除标准:患感染性胃肠炎、胃食管反流、嗜酸细胞胃肠炎、炎症性肠病、乳糜泻等疾病。
1.3 研究方法
1.3.1 资料采集 收集慢性与急性FPIES两组患儿的基本情况、治疗前的临床特征、常规实验室检查、内镜及影像学检查、组织病理分析、口服耐受年龄,并进行比较。
1.3.2 实验室检查 本院实验室采用光检测器法及流体聚焦法分析白细胞、红细胞、血小板、血红蛋白等的计数;采用化学发光法检测IL-6、TNF-α水平。
1.3.3 口服耐受年龄 采用开放式口服食物激发试验(oral food challenge testing, OFC)明确过敏原和口服耐受时间,其中所有牛奶蛋白过敏患儿均接受了针对牛奶蛋白的开放性OFC,以30 min间隔分别给予0.1、1、3、10、30、100 mL。留观4~6 h,以观察其临床表现,并记录牛奶口服耐受时间,确定口服耐受年龄;采用固体食物进行OFC时,则在30 min内分3次将激发食物平均分给患儿,总量约0.3 g/kg食物蛋白[12],记录口服耐受时间。
1.3.4 治疗方案 急、慢性FPIES患儿均回避过敏食物,部分患儿给予深度水解或氨基酸配方粉。对合并严重感染、中重度脱水的慢性FPIES患儿,给予抗生素、白蛋白、丙种球蛋白静脉滴注和补液治疗;对合并中重度脱水的急性FPIES患儿给予静脉补液治疗,合并轻度脱水的患儿采用口服补液纠正脱水。
1.4 随访
所有患儿均接受门诊或电话随访,随访至2021年6月,随访时间13~42个月。出院后每隔1个月随访1次,3个月后改为每3~6个月随访1次,监测体重并根据开放性OFC记录牛奶口服耐受年龄。
1.5 统计学方法
2 结果
2.1 急、慢性FPIES患儿一般情况比较
13例慢性FPIES患儿中,男7例,女6例;母乳喂养3例,人工喂养7例,混合喂养3例;特应性家族史阳性3例,其中1例父亲过敏性鼻炎,1例姐姐牛奶蛋白过敏,1例母亲芒果过敏;特应性疾病史4例,均为湿疹;顺产6例,剖宫产7例;过敏原均为牛奶;均为早发型,重度9例,轻中度4例;不典型者(均为牛奶sIgE阳性)3例;5例先后误诊为败血症、化脓性脑膜脑炎、胃食管反流、急性坏死性小肠结肠炎。15例急性FPIES患儿中,男8例,女7例;母乳喂养5例,人工喂养6例,混合喂养4例;顺产9例,剖宫产6例;2例过敏原为鸡蛋,余13例为牛奶。
两组患儿性别、出生方式、喂养方式、特应性疾病史、家族史及牛奶sIgE阳性比较,差异无统计学意义(P均>0.05);慢性FPIES患儿首次发作中位年龄与诊断时中位年龄明显早于急性FPIES患儿(P均<0.05)。见表1。
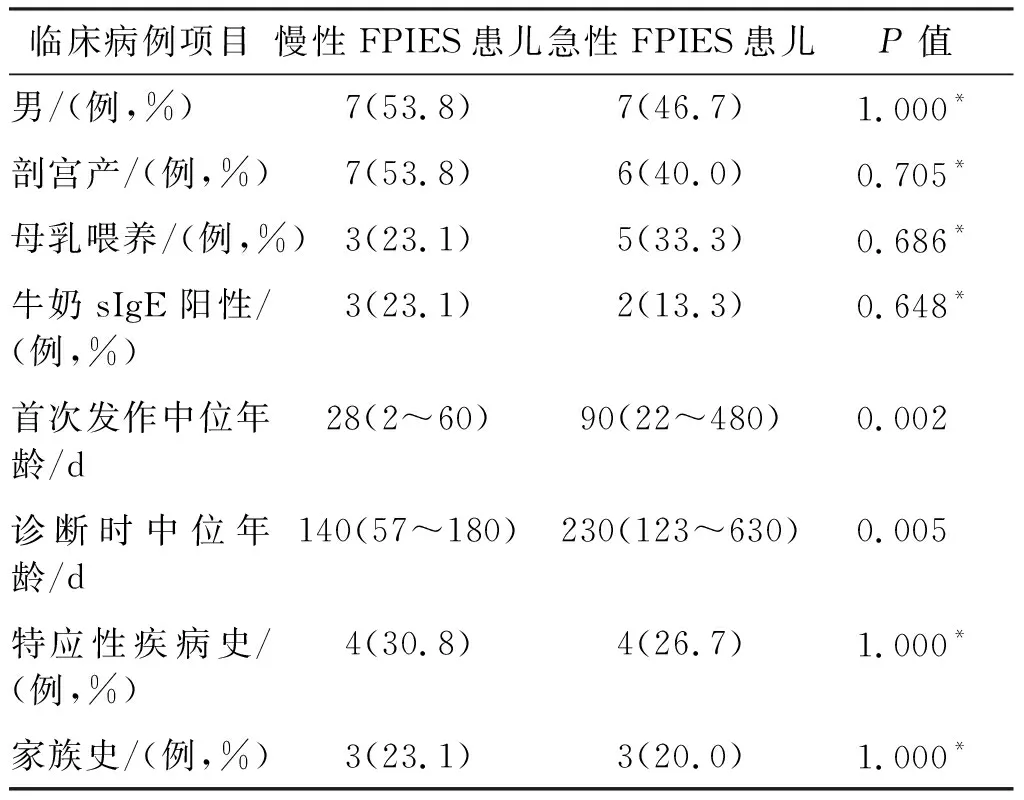
表1 两组FPIES患儿一般情况比较
2.2 急、慢性FPIES患儿临床表现比较
根据Fisher精确检验的结果可知,与急性FPIES患儿比较,慢性FPIES患儿更多表现为腹泻、血便、发热、营养不良,差异有统计学意义(P均<0.05),而呕吐、腹胀、嗜睡、低体温、面色苍白、低血压、脱水差异无统计学意义(P均>0.05),见表2。
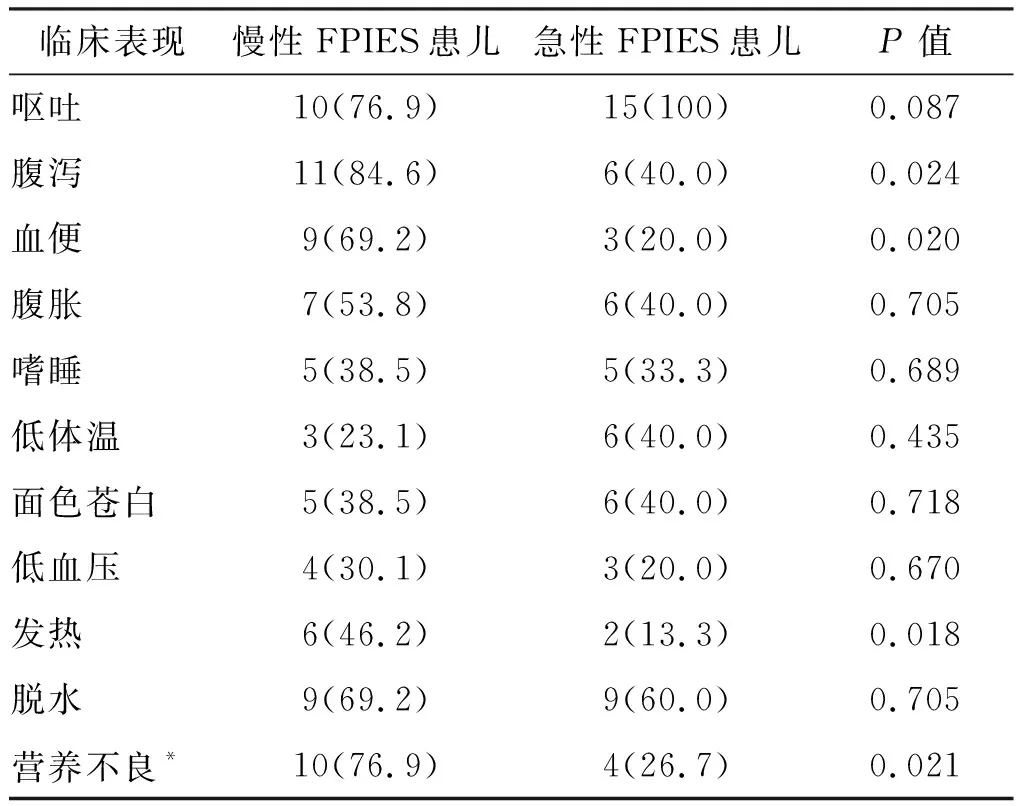
表2 两组FPIES患儿临床表现比较 例/%
2.3 急、慢性FPIES患儿治疗前实验室检查数据比较
慢性FPIES患儿中,白细胞升高8例;中性粒细胞计数升高7例;嗜酸细胞绝对值升高5例;血红蛋白下降7例;二氧化碳结合率下降6例;血清总IgE升高7例;CRP升高7例;总蛋白下降11例;白蛋白下降6例;4例低钠血症;5例代谢性酸中毒(重度2例);2例行骨髓细胞学检查,示红系增生活跃,外周血涂片未见寄生虫;1例腰椎穿刺检查,脑脊液常规和生化未见异常;1例染色体核型:47,XY,+21。急性FPIES患儿中,白细胞升高6例;中性粒细胞计数升高4例;嗜酸细胞绝对值升高5例;血红蛋白下降4例;二氧化碳结合率下降2例;血清总IgE升高4例;CRP升高4例;总蛋白下降3例;白蛋白下降3例;1例低钠血症;2例代谢性酸中毒(轻度2例)。
与急性FPIES患儿比较,慢性FPIES患儿中性粒细胞计数及CRP、IL-6水平明显升高(P均<0.05),血清总蛋白、白蛋白、二氧化碳结合率、血红蛋白明显降低(P均<0.05);而嗜酸细胞绝对值、血小板计数、总IgE、TNF-α水平两组间差异无统计学意义(P均>0.05)。见表3。
2.4 急、慢性FPIES患儿内镜、病理和影像学检查
慢性FPIES患儿2例行胃镜检查,1例上消化道黏膜未见异常,1例十二指肠球部黏膜粗糙,颗粒样隆起;1例行胃镜联合结肠镜检查示十二指肠球、降部黏膜红斑、糜烂;降结肠、乙状结肠黏膜可见浅凹溃疡灶,触之易出血。黏膜组织病理检查示胃窦黏膜固有层内少量淋巴细胞和嗜酸性粒细胞浸润,降结肠、乙状结肠浅表黏膜活动性炎。2例心脏彩超,其中1例心包少量积液,1例心影卧位饱满;6例行腹部立位片检查,3例未见异常,3例肠管积气扩张,其中2例可见多个小液平,部分肠管皱襞增厚。2例头颅CT脑实质内未见异常密度影。4例上消化道造影未见异常。
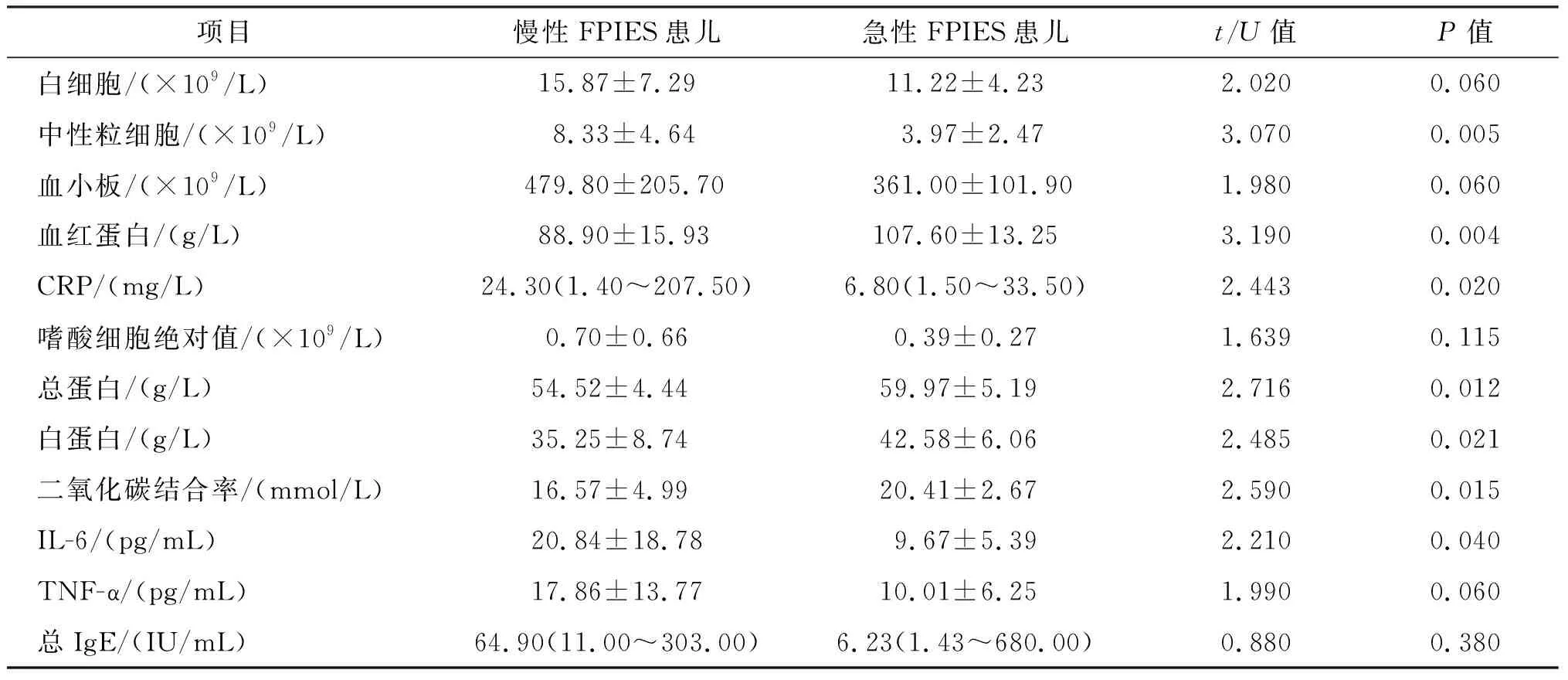
表3 两组FPIES患儿治疗前实验室数据比较
急性FPIES患儿1例行胃镜检查,上消化道黏膜未见异常;1例行胃镜联合结肠镜检查示十二指肠球部黏膜粗糙、乙状结肠及直肠黏膜可见糜烂灶,黏膜组织病理检查示乙状结肠黏膜慢性活动性炎;5例行腹部立位片检查,4例未见异常,1例肠管积气明显,可见多个小液平。
2.5 急、慢性FPIES患儿治疗前外周血CRP与IL-6水平相关性分析
慢性FPIES患儿外周血CRP水平与IL-6水平呈正相关(r=0.90,P<0.001),见图 1,而急性FPIES患儿无相关性。
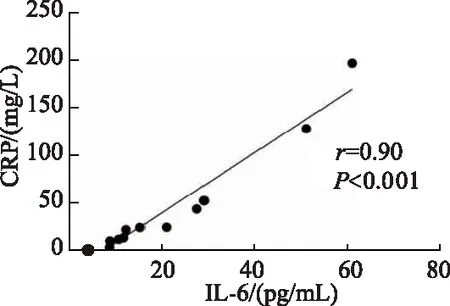
图1 慢性FPIES患儿外周血CRP水平与IL-6水平相关性分析
2.6 急、慢性FPIES患儿治疗及转归
慢性FPIES组中2例母乳喂养患儿在乳母严格回避牛奶蛋白相关饮食后,症状缓解;其余11例均给予氨基酸配方治疗,1例入院时接受了头孢哌酮抗感染治疗,1例入院时接受了亚胺培南抗感染治疗,2例接受了白蛋白和人丙种球蛋白治疗,出院时均临床缓解,未再呕吐,腹泻缓解。所有患儿均接受了开放性OFC,慢性FPIES患儿中2例OFC目前仍阳性,其余11例牛奶口服耐受中位年龄为20(11~32)个月,其中2例在1岁内牛奶口服耐受,6例1至2岁内,3例2至3岁内。
急性FPIES组中4例母乳喂养患儿在乳母严格回避牛奶蛋白相关饮食后,症状缓解;4例予深度水解配方治疗,5例给予氨基酸配方治疗,2例鸡蛋过敏患儿回避鸡蛋类相关饮食;同时6例接受口服补液治疗,5例给予静脉补液治疗。
3 讨论
本研究结果显示,慢性FPIES患儿首次发作中位年龄为28(2~60)d,均为早发型,与相关报道慢性FPIES患儿发病均小于4月龄一致[16]。研究发现,治疗前慢性FPIES患儿血清白蛋白、二氧化碳结合率、血红蛋白较急性FPIES明显降低(P<0.05),且更多表现为腹泻、血便。
目前研究表明,固有免疫参与FPIES的发病,而自主神经内分泌通路的激活可促进固有免疫稳态的破坏,导致单核细胞、嗜中性粒细胞、嗜酸性粒细胞和淋巴细胞活化[16];其中单核细胞产生的细胞因子如IL-6、TNF-α等促进肠道炎症反应的发生,引起肠黏膜通透性增加,肠腔内液体渗出增加[17]。已经证实这些细胞因子可诱导中性粒细胞增多和血清CRP水平升高;CRP升高不仅与FPIES患儿症状的严重程度相关,也与疾病活动度、耐受性延迟相关[18-19]。本研究发现,与急性FPIES患儿相比,慢性FPIES患儿多表现为发热,且CRP达(51.99±67.72) mg/L,但是与Lee等[20]研究显示CRP仅有轻度升高(均<20 mg/dL)不同,相关差别机理尚待进一步研究。此外,本研究同时发现慢性FPIES患儿治疗前IL-6水平与CRP 水平呈正相关(r=0.90,P<0.001),提示细胞促炎因子参与慢性FPIES的抗原特异性免疫反应。
研究报道,唐氏综合征患者更易伴有FPIES,其免疫失调导致TNF-α水平增高和IL-10 水平降低,而IL-10水平降低与FPIES病程延长相关[21-22]。本研究中有1例系21-三体综合征患儿,至23个月龄时牛奶口服耐受,是否延长病程还需更多样本研究。
本研究中3例慢性FPIES患儿行内镜检查,镜下见黏膜红斑、糜烂、溃疡,组织学检查提示少量淋巴细胞浸润、活动性炎。急性FPIES患儿内镜表现无特异性,故内镜检查不建议作为常规检查[23],但是对病程迁延、营养不良者,需与嗜酸细胞胃肠炎、炎症性肠病、小肠淋巴管扩张症、乳糜泻等疾病相鉴别时,可行消化内镜和组织学检查。
OFC是诊断FPIES的金标准。如果病史典型可进行诊断,尤其是对于有两次或多次 FPIES 反应的患者,则无需通过OFC确认。OFC更常用于评估过敏食物一段时间内的口服免疫耐受。本研究中慢性FPIES患儿过敏原均为牛奶,其中2例牛奶sIgE阳性的患儿牛奶蛋白OFC目前仍阳性。研究发现2%~25% FPIES 患儿同时存在IgE介导的过敏反应,也是FPIES持续存在且口服耐受时间延迟的独立危险因素[24]。
FPIES的治疗主要为严格回避过敏食物。对于牛奶诱导的慢性FPIES婴儿,鼓励母乳喂养或使用深度水解配方,对有生长迟缓和多种食物过敏的慢性FPIES患儿应考虑使用氨基酸配方[25]。慢性FPIES患儿中11例均接受了氨基酸配方的饮食治疗,故建议早期使用氨基酸配方可以更迅速缓解症状,尽早改善低白蛋白血症、体重增长不良和贫血。
总之,对有慢性腹泻、间歇性呕吐、血便的患儿伴外周血中性粒细胞计数、IL-6、CRP升高者,以及贫血、低白蛋白血症、体重增长不良,应考虑慢性FPIES的可能。

