基于人工智能与全球上市药物数据探寻抗垂体腺瘤药物及体外实验验证
吕婷婷, 张子睿, 李尚, 孙岚, 杜冠华
(中国医学科学院北京协和医学院药物研究所药物筛选中心,北京 100050)
垂体腺瘤约占所有颅内肿瘤的15%~25%,其发病率在颅内肿瘤中排名第二[1-2]。垂体腺瘤是一种罕见病,缺乏有效的治疗药物,因此目前的一线治疗方式是手术切除。然而高达20%的垂体腺瘤,尤其是巨腺瘤在术后会出现肿瘤快速生长及肿瘤复发[3-4]。更严重的是,0.2%的垂体腺瘤很有可能发展为垂体癌[5]。Almutairi等[6]报道,垂体腺瘤的完全切除率仅为66%~78%。高复发率和低生存率成为垂体恶性肿瘤治疗的主要障碍[5]。
目前已上市的垂体腺瘤治疗药物只能缓解激素异常分泌引起的部分症状,而不能抑制肿瘤生长,只能作为手术的辅助用药或需长期服药,对患者的生理和心理都造成极大的负担。因此,本研究希望寻找可以在抑制激素分泌的同时能够控制肿瘤生长甚至能杀灭肿瘤的药物。
信号转导与转录激活因子6(signal transducer and activator of transcription 6, STAT6)是转录因子家族,涉及多种生物过程,如免疫反应、细胞存活和细胞生长,且与多种癌症的发展和进展有关[7]。STAT6蛋白高度参与了与致癌作用相关的炎症过程的调节[8],例如,STAT6调节精氨酸酶1(Arg1)、甘露糖受体C型1(Mrc1)、Retnla(Fizz1)和chil3(Ym1)等巨噬细胞M2样相关特定基因的表达[9-10]。STAT6在前列腺癌的发展和转移中也起着关键作用[11]。此外,对68例垂体腺瘤患者的全基因组DNA甲基化和mRNA微阵列分析表明,STAT6的表达和甲基化与垂体腺瘤的侵袭性相关[12]。研究提示STAT6可能是垂体腺瘤的一个有希望的治疗靶点。创新药物的研发周期长、经济投入大、风险高[13]。药物重定位是指在现有药物的原始医学适应范围之外寻找其新用途的过程,能够大幅度降低药物的总体开发成本,缩短研发周期[14]。因此,本研究联合人工智能技术与基于STAT6靶点的药物重定位策略,从全球上市药物数据库中寻找垂体腺瘤治疗药物,旨为垂体腺瘤的治疗研究提供有力证据。
1 材料与方法
1.1 细胞
小鼠垂体腺瘤AtT-20细胞、大鼠垂体腺瘤GH3细胞均保存在中国医学科学院药物研究所筛选中心。AtT-20细胞培养于含体积分数10%胎牛血清,1%青链霉素(100 kU/L青霉素、0.1 g/L链霉素)的DMEM培养基中;GH3细胞培养于含体积分数15%马血清,2.5%胎牛血清,1%青链霉素(100 kU/L青霉素、0.1 g/L链霉素)的Ham′s F-12K培养基中,均置于37 ℃、含体积分数5%的CO2细胞培养箱中常规培养。
1.2 主要药品与试剂
他莫昔芬、吉非替尼购自上海皓元生物医药科技有限公司,细胞计数试剂盒-8(CCK8)、Annexin V-EGFP 细胞凋亡检测试剂盒购自南京凯基生物公司。促肾上腺皮质激素(adreno corticotropic hormone, ACTH)和生长激素(growth hormone, GH)的ELISA试剂盒购自武汉华美生物工程有限公司。逆转录试剂盒购自莫纳生物公司, qRT-PCR试剂盒购自Vazyme公司。qRT-PCR引物合成自北京奥科鼎盛生物科技有限公司,引物序列如下,β-肌动蛋白引物:上游5′-TCTGTGTGGATTGGTGGCTCTA-3′,下游5′-CTGCTTGCTGATCCACATCTG-3′;STAT6引物:上游5′-TTCTGCCAAAGACCTGTCCAT-3′,下游5′-CTGTCCTCTACCATAGTCACA-3′。RIPA裂解液、BCA蛋白定量试剂盒、ECL超敏发光液购自北京普利莱基因技术有限公司。磷脂酰肌醇3-激酶(PI3K)、磷酸化-PI3K、蛋白激酶B(AKT)、磷酸化-AKT、p53蛋白、Bcl-2相关X蛋白(Bax)等抗体购自美国Cell Signaling Technology公司。B淋巴细胞瘤-2基因(Bcl-2)和甘油醛-3-磷酸脱氢酶(GAPDH)抗体购自艾博抗(上海)贸易有限公司(英国Abcam公司)。
1.3 微阵列数据的获取及分析
在基因表达数据库(Gene Expression Omnibus,GEO)中通过检索“pituitary adenoma”获取垂体腺瘤相关基因表达谱,采用GEO2R在线分析工具对基因表达谱进行分析,筛选差异表达基因(differentially expressed genes, DEGs),筛选条件为|log2(fold change,FC)|>1,校正后P值<0.05。运用R语言实现垂体腺瘤基因表达谱的可视化。而后运用DAVID数据库(the database for annotation, visualization and integrated discovery)对DEGs进行基因本体(Genome ontology, GO)及京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes, KEGG)信号通路富集分析,P值<0.05为差异有统计学意义。此外,运用STRING数据库(search tool for the retrieval of interacting genes)对DEGs进行蛋白-蛋白相互作用(protein-protein interaction, PPI)网络分析,相互作用得分(interaction score)>0.4为有统计学意义。
1.4 Hub基因的筛选与验证
通过cyto-Hubba插件中的MCC算法筛选出PPI网络中的前10个Hub基因,并运用qRT-PCR通过mRNA表达水平验证Hub基因在巨腺瘤与微腺瘤组织中的差异表达。垂体腺瘤模型为本课题组前期构建,待肿瘤直径达3~5 mm后,将模型动物随机分为巨腺瘤与微腺瘤组。巨腺瘤组灌胃给予0.5% 羧甲基纤维素钠(CMC-Na),微腺瘤组灌胃给予治疗药物蓓萨罗丁,给药21 d后获取瘤组织。
1.5 上市药物的富集及相互作用验证
1.5.1 基于靶点的药物重定位 针对垂体腺瘤靶点的全球上市药物从Drugbank数据库 (https://www.Drugbank.ca/)和国家人口与健康科学数据共享平台药学数据中心的全球上市药物数据库(http://pharmdata. ncmi. cn/globaldrugs/index. asp)中富集。
1.5.2 基于人工智能平台反向找靶 通过Pubchem化合物数据库下载他莫昔芬(CAS:10540-29-1)的三维结构,并上传至SwissTargetPrediction、TargetNet、PharmMapper、ChEMBL等多个靶点预测数据库。通过人工智能算法识别、预测可与他莫昔芬结合的蛋白靶点。
1.5.3 分子对接验证 将美国食品药品监督管理局(FDA)批准的靶向“STAT6”的药物他莫昔芬通过CDOCKER的分子对接分析得到确证。靶点蛋白STAT6的晶体结构来自PDB数据库,为了保证分子对接的可靠性,选择分辨率<2.5 Å且具有配体复合物的蛋白晶体结构(ID: 3ZEP)建立分子对接模型。对接程序使用Discovery Studio 2018(美国BIOVIA),化合物和靶点蛋白的制备均由小分子配体模块完成。首先去除PDB结构中的水分子,对接的活性口袋由原始配体分子进行定义。设置对接参数后,将晶体结构中的配体分子抽取出来并重新对接至预先定义好的活性口袋,同时计算对接后的配体分子构象与晶体结构中的初始构象之间的均方根差值(root-mean square deviation, RMSD),若RMSD值<2.5,则认为分子对接结果可靠。
1.6 垂体腺瘤细胞实验
1.6.1 CCK8检测细胞存活率 将对数生长期的AtT-20细胞、GH3细胞以每孔1×104个的密度接种至96孔板,37 ℃培养至细胞贴壁后,用完全培养基稀释他莫昔芬母液至1、4、8、12、15、20和30 μmol/L并分别加至各孔,并设置0.1%的二甲基亚砜为对照组。细胞培养箱中培养24 h后,根据说明书使用CCK8试剂盒检测细胞存活率。
1.6.2 流式细胞仪检测细胞凋亡 将AtT-20细胞、GH3细胞在含有0、5、10和15 μmol/L他莫昔芬的6孔板中培养24 h后,与Annexin V-EGFP和PI染液在室温下孵育30 min。然后用流式细胞仪检测细胞凋亡率。
1.6.3 ELISA检测GH和ACTH的分泌 GH3和AtT-20细胞以5×105个细胞的密度接种于60 mm培养皿中,并与不同浓度(1、5、10 μmol/L)的他莫昔芬或10 μmol/L吉非替尼共同培养24 h。使用ELISA特定试剂盒检测细胞上清液中GH和ACTH的水平。
1.6.4 蛋白质印迹法检测PI3K-AKT通路相关蛋白 收集并提取吉非替尼或不同浓度他莫昔芬(1、5、10 μmol/L)处理24 h后的AtT-20细胞、GH3细胞中的蛋白,加入上样缓冲液后,100 ℃处理10 min进行变性。采用SDS-PAGE电泳,电泳后将蛋白转印至PVDF膜,室温封闭2 h。分别加入特异性的一抗(PI3K 1 ∶1 000,p-PI3K 1 ∶500,AKT 1 ∶1 000,p-AKT 1 ∶500,p53 1 ∶1 000,Bax 1 ∶1 000,Bcl-2 1 ∶1 000,GAPDH 1 ∶1 000),4 ℃孵育过夜后,TBST洗膜4~5次,再加入HRP标记的二抗(1 ∶3 000)室温孵育2 h,洗膜。ECL显色,显影,定量,使用Image J软件分析蛋白条带,以目的蛋白与内参GAPDH灰度值的比值表示蛋白的相对表达量。
1.7 统计学方法
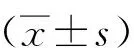
2 结果
2.1 垂体腺瘤基因表达谱分析
检索得到垂体腺瘤数据集GSE 93825(GPL18281, Illumina HumanHT-12 WG-DASL V4.0 R2 expression beadchip),该数据集中共收集11例巨腺瘤患者和29例微腺瘤患者的新鲜神经内分泌组织标本。通过GEO2R在线工具筛选得到96个DEGs,其中,表达上调的基因25个,表达下调的基因71个。垂体腺瘤数据集的基因表达火山图、热图如图1所示。DEGs的GO功能和KEGG信号通路富集结果见图2,其主要富集于调节酶催化活性、调节磷酸化和磷酸盐代谢、细胞增殖、细胞生物合成和大分子代谢作用等相关的生物过程。此外,DEGs构建的PPI网络如图3所示。
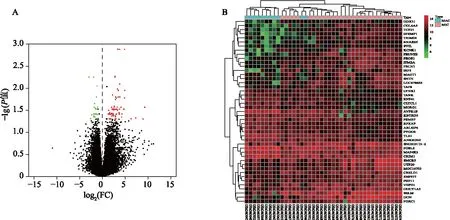
图1 巨腺瘤和微腺瘤差异表达基因的火山图(A)和热图(B)
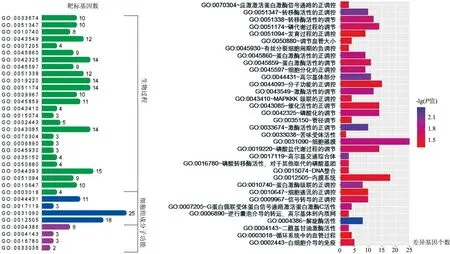
图2 差异表达基因的GO功能和KEGG信号通路富集分析

图3 差异表达基因的PPI网络图
2.2 STAT6是垂体腺瘤的潜在治疗靶点
基于cyto-Hubba的MCC算法筛选出前10个Hub基因LEP、PTGS2、STAT6、CXCL12、ITPKB、CCR7、LPAR2、CXCR5、ADCY3和TAS2R14(表1),通过文献检索选择其中已报道的6个癌症相关基因并根据校正P值和log2(FC)进行排序(表2)。最终选择差异倍数最大的STAT6基因进行进一步的mRNA表达水平量化验证。结果表明(图4),STAT6的表达水平与垂体腺瘤的大小相关,其可能成为垂体腺瘤的潜在治疗靶点。
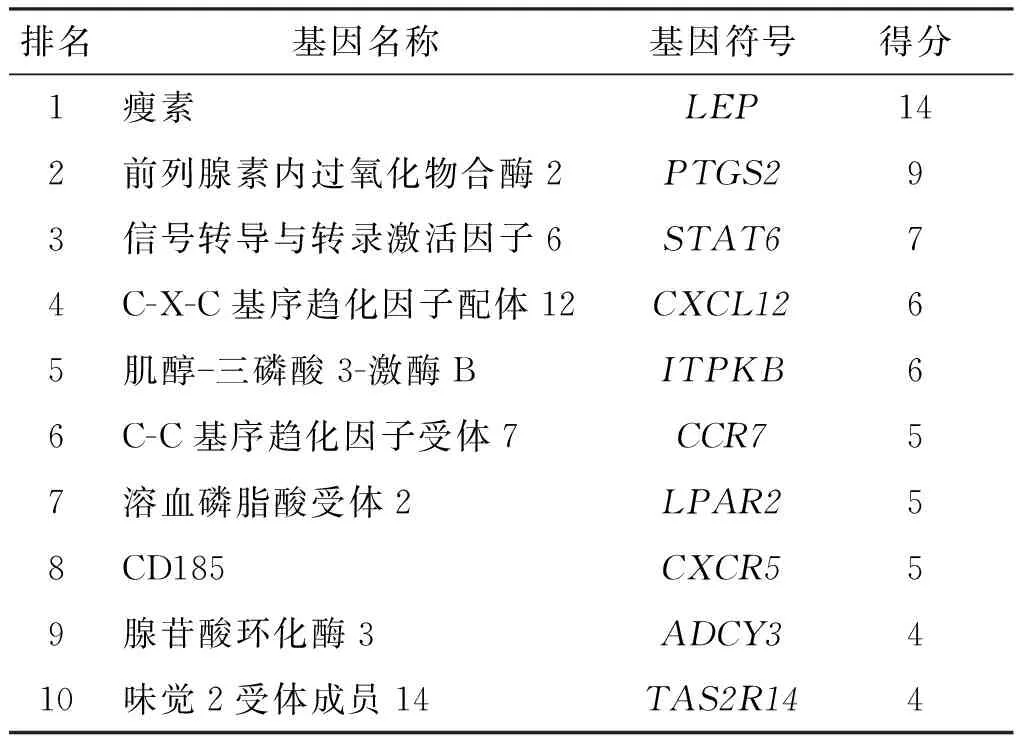
表1 PPI网络中的前10位Hub基因
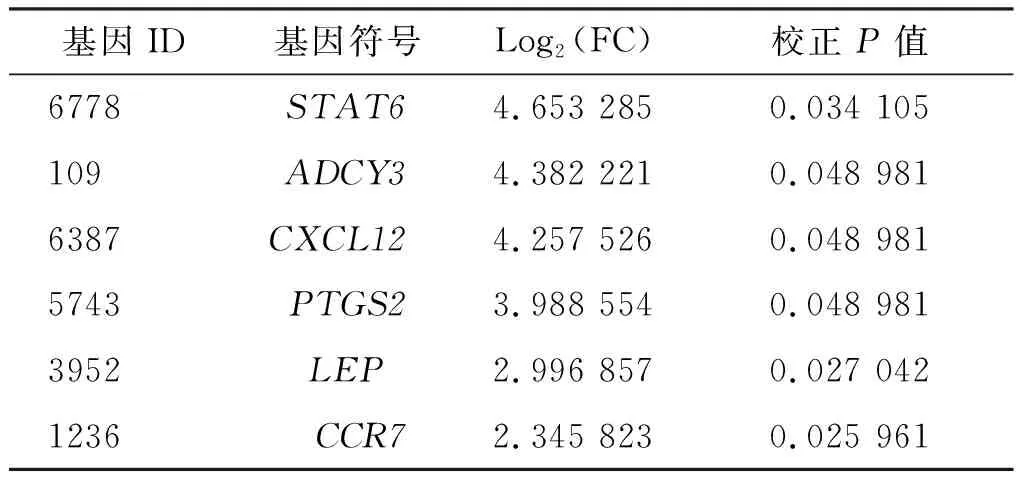
表2 基于校正P值和 log2(FC)值的基因排名
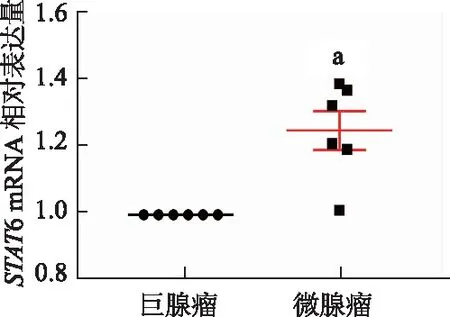
a: P<0.01,与巨腺瘤组比较
2.3 他莫昔芬是垂体腺瘤治疗的候选药物
将关键蛋白“STAT6”通过全球上市药物数据库进行药物富集,如表3所示,他莫昔芬是STAT6的抑制剂,杜匹鲁单抗是STAT6的拮抗剂。通过文献调研发现,他莫昔芬目前用于乳腺癌、卵巢癌、胰腺导管腺癌等多种激素依赖性癌症的治疗,而杜匹鲁单抗目前仅用于治疗中重度特应性皮炎。因此,选取他莫昔芬作为候选药物进行进一步研究。
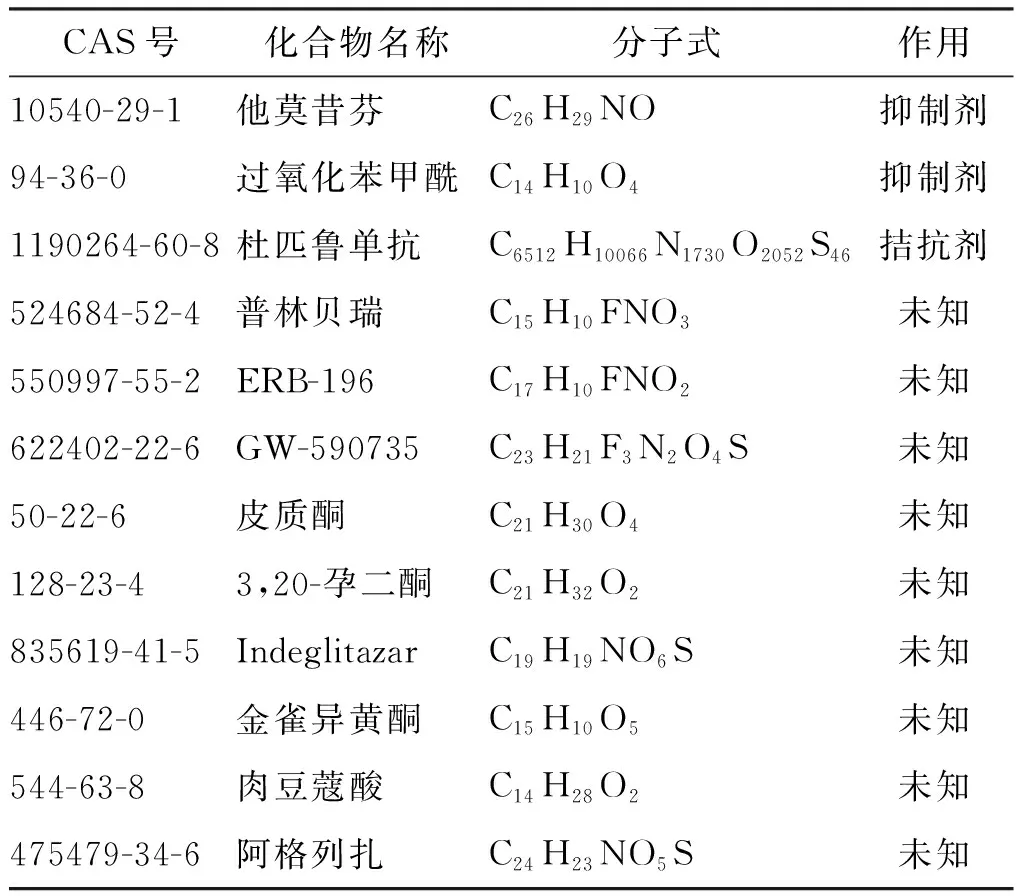
表3 批准的靶向STAT6的化合物
2.4 他莫昔芬靶向STAT6的验证
分子对接预测相互作用:首先,计算对接后配体—他莫昔芬与晶体中的原配体的空间坐标的RMSD值为0.319 9,小于2.5,表明此次分子对接计算结果可靠。其次,用CDOCKER精准分子对接方法验证他莫昔芬与STAT6靶点蛋白的相互作用,CDOCKER energy指示配体与靶点蛋白间的结合能力,其值越高提示结合能力越强。结果显示,他莫昔芬的CDOCKER energy值为14.392 1,原始配体的CDOCKER energy值为6.938 7,说明他莫昔芬与STAT6的结合能力超过该靶点蛋白的原配体。他莫昔芬可以通过氢键、Pi键、离子间的引力等多种方式与靶点蛋白结合(图5),证明了他莫昔芬与STAT6靶点蛋白相互作用预测结果的可靠性。
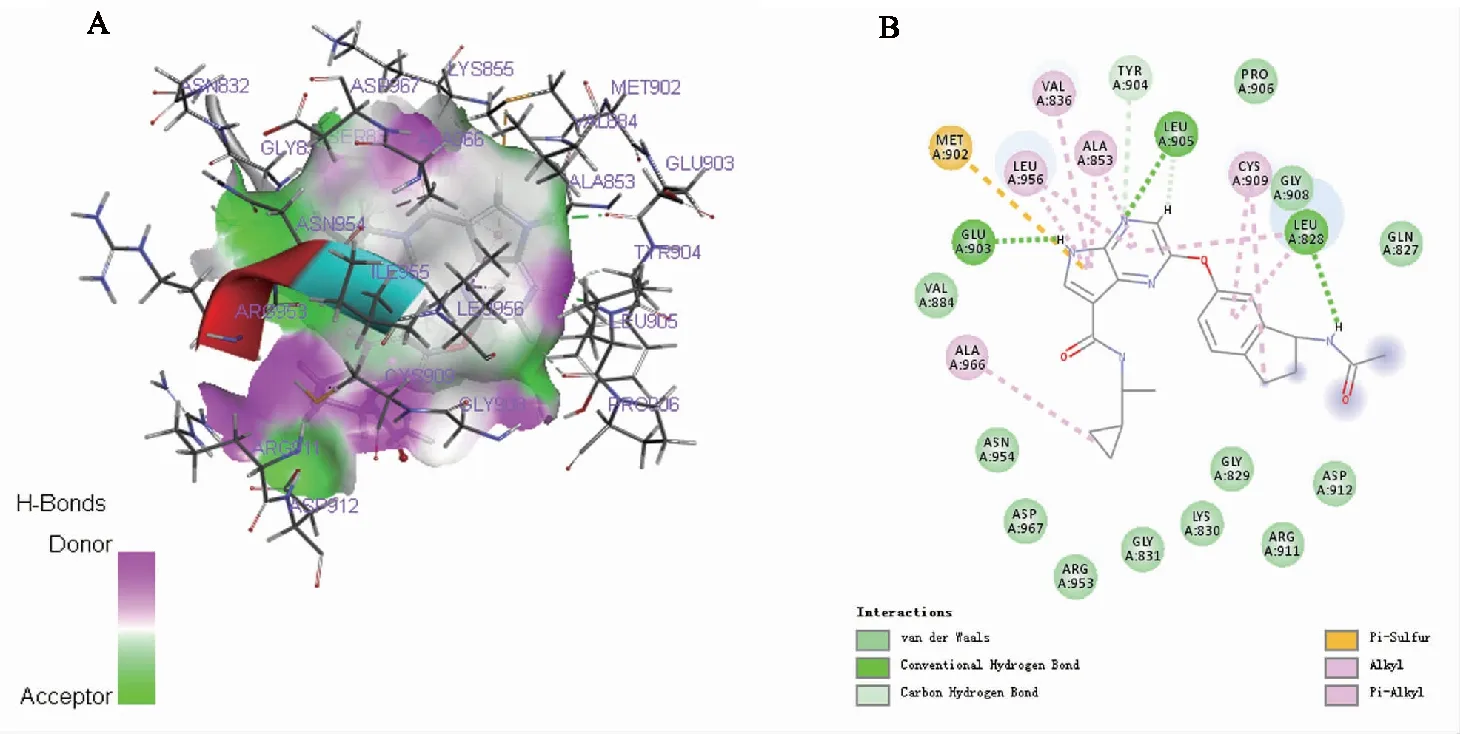
A:他莫昔芬与STAT6相互结合;B:他莫昔芬与STAT6的相互作用方式
人工智能反向找靶:通过人工智能平台对409个蛋白与他莫昔芬的结合进行预测,预测评分达到99.9分以上的靶点蛋白有19个(表4),其中STAT6排在第12位。因此,初步认为他莫昔芬通过靶向STAT6而发挥垂体腺瘤治疗作用。
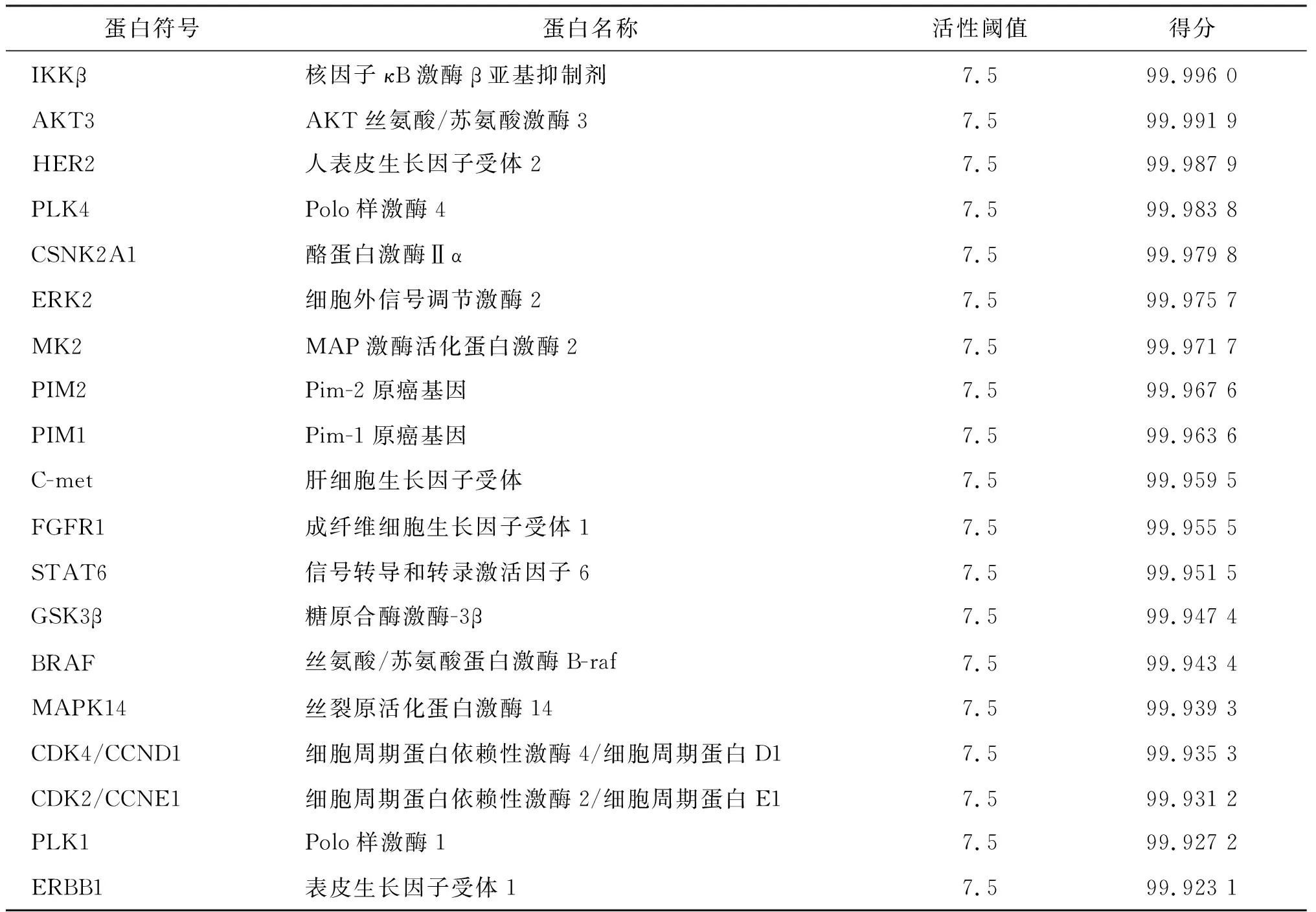
表4 预测的与他莫昔芬相互作用的前19个蛋白
2.5 他莫昔芬对垂体腺瘤细胞的作用
2.5.1 他莫昔芬抑制垂体腺瘤细胞增殖,促进细胞凋亡 CCK8检测结果表明,他莫昔芬在培养24 h后能够抑制垂体腺瘤细胞GH3和AtT-20的增殖(图6)。流式分析结果表明,他莫昔芬剂量依赖性增加了GH3和AtT-20细胞的凋亡率(图7)。
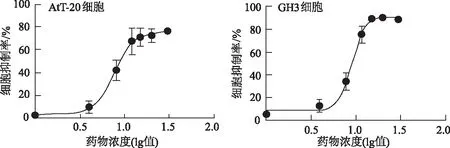
图6 CCK8法测定他莫昔芬处理后AtT-20和GH3细胞的存活率
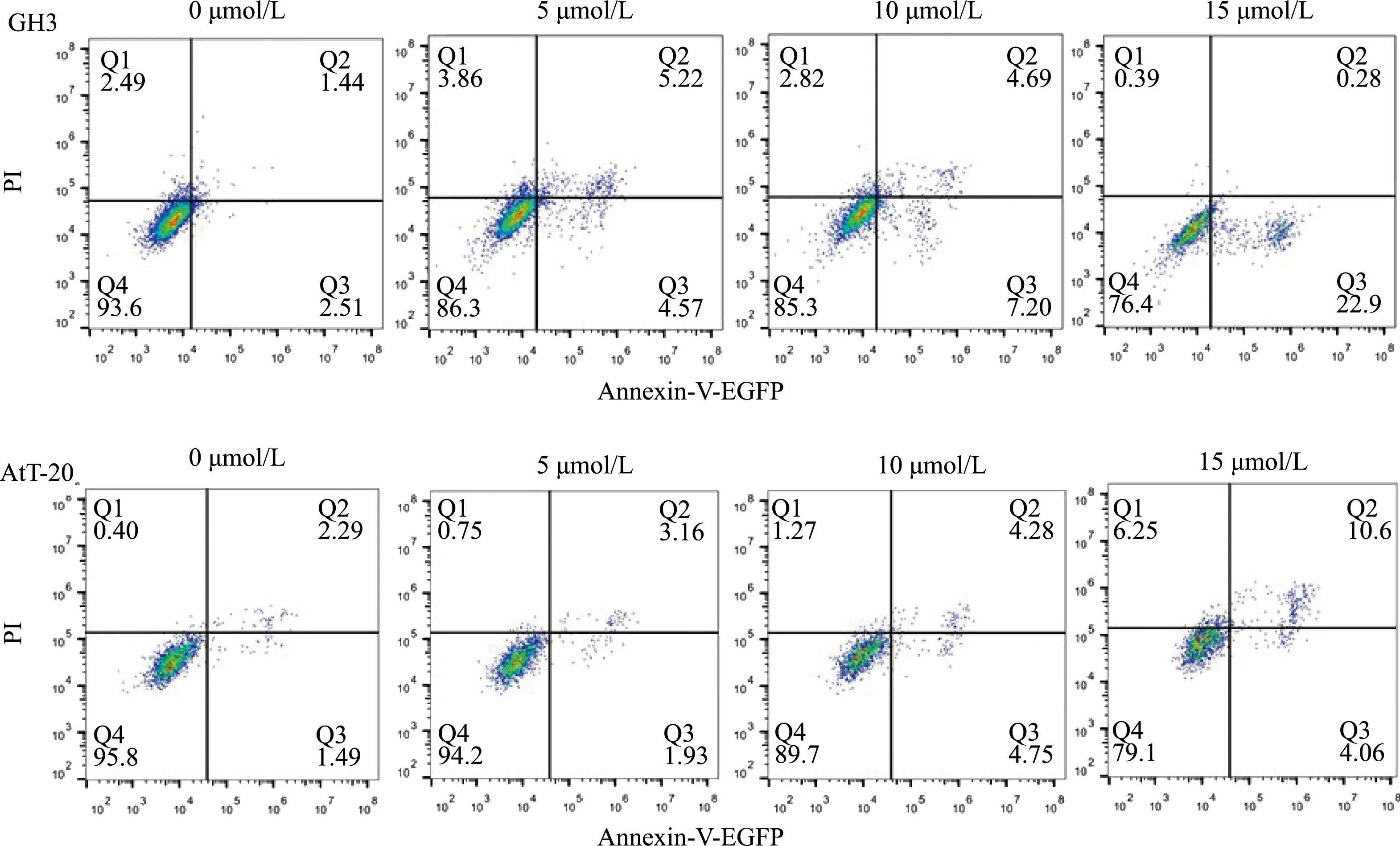
图7 流式细胞术分析他莫昔芬处理后GH3和AtT-20细胞的凋亡率
2.5.2 他莫昔芬抑制垂体腺瘤细胞分泌ACTH和GH ELISA检测结果表明,他莫昔芬处理后显著降低了分别由垂体腺瘤细胞GH3和AtT-20分泌的GH和ACTH的水平(图8),但吉非替尼治疗并未显著影响激素分泌。
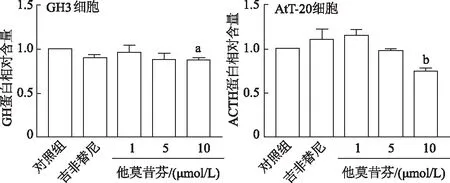
a: P<0.05, b:P<0.001,与对照组比较
2.5.3 他莫昔芬对垂体腺瘤细胞PI3K/AKT信号通路及凋亡相关蛋白的影响 蛋白质印迹结果显示,与未处理的对照组相比,他莫昔芬处理垂体腺瘤
GH3和AtT-20细胞24 h后,可以下调p-PI3K、p-AKT的活性,降低抗凋亡蛋白Bcl-2的表达,并上调促凋亡蛋白p53和Bax的表达(图9)。而吉非替尼能下调AtT-20细胞中p-PI3K的活性,增加Bax蛋白的表达,并能降低GH3和AtT-20细胞中Bcl-2蛋白的表达;对两种细胞中其他凋亡相关蛋白的表达水平没有显著影响。

a:P<0.05, b:P<0.01, c:P<0.001,与对照组比较
3 讨论
虽然垂体腺瘤被定义为罕见病,但在中国人口基数庞大的情况下,我国每年确诊的垂体腺瘤患者数量实际上并不少。然而,随着确诊人数的增多,不能接受手术或手术失败的病例也逐渐增多。研究人员希望药物不仅能起辅助作用,也能够“独当一面”成为一线治疗方式,让患者摆脱手术带来的风险和精神压力,同时也减轻垂体腺瘤对患者、家庭以及社会带来的经济负担。为了节约药物研发的时间成本和经济成本,本研究选择通过药物重定位策略来寻找已上市药物中有垂体腺瘤治疗潜力的药物,并对其进行药效验证以及机制的初步探索。
本研究首先通过生物信息学工具分析垂体腺瘤巨腺瘤与微腺瘤之间的差异基因表达谱,共筛选得到96个DEGs,包括25个表达上调的基因和71个下调基因。然后从DEGs的PPI网络中筛选出得分最高的前10个Hub基因,结合文献调研以及log2(FC)值,最终选择表达倍数变化最大的STAT6基因进行mRNA水平验证。qRT-PCR结果表明,STAT6的mRNA表达水平与垂体腺瘤的大小相关,其可能成为诊断和治疗垂体腺瘤的潜在新靶点。
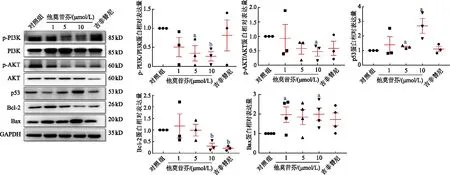
a:P<0.05, b:P<0.01, 与对照组比较
在药物重定位中,基于网络的重定位是最常用的方法之一,常用的网络分为DTI (drug target interaction) 网络、基因调控网络、代谢网络等[15],其中的集合包括PPI、药物-疾病网络、药物-靶点-疾病网络、疾病-基因网络、疾病-蛋白质-基因网络等[16]。本研究通过全球上市药物数据库对垂体腺瘤靶点“STAT6”进行药物富集得到垂体腺瘤的潜在治疗药物他莫昔芬。他莫昔芬由英国的ICI制药公司研制,在1977年由美国FDA批准上市用于晚期乳腺癌的治疗。目前他莫昔芬已用于胶质瘤、肝癌、子宫内膜癌等多种癌症的临床试验[17]。他莫昔芬不仅抑制细胞增殖,还能促进细胞周期停滞、细胞凋亡和抗血管生成[18]。值得注意的是,他莫昔芬也是一种具有免疫刺激特性的抗增殖药物。例如,他莫昔芬通过阻断M2型小胶质细胞的极化和增强免疫功能来抑制雌激素受体缺陷型乳腺癌的脑转移[19]。研究还发现他莫昔芬减少了胰腺导管腺癌组织的纤维化,其作为炎症和免疫反应的潜在调节剂来调控肿瘤相关巨噬细胞的极化[20]。近日有相关文献报道他莫昔芬能够抑制GH3细胞的增殖,但其作用靶点是雌激素受体[21]。然而本研究的分析结果表明STAT6可能是调控垂体腺瘤生长的潜在靶点,为了证实STAT6是他莫昔芬的作用靶点或靶点之一,本研究对STAT6对他莫昔芬功能的介导作用进行了验证。
首先利用分子对接方法,验证他莫昔芬与靶点蛋白STAT6的结合情况,从CDOCKER对接的结果来看,STAT6可与他莫昔芬结合,且STAT6蛋白与他莫昔芬结合的得分值超过了蛋白的原配体。然后,基于包含409个蛋白的靶点预测数据库,通过人工智能算法将可与他莫昔芬结合的蛋白靶点进行排序,发现STAT6是他莫昔芬的高评分结合位点。最后体外实验结果表明,他莫昔芬能够抑制垂体腺瘤细胞的增殖和激素分泌,蛋白质印迹结果显示他莫昔芬可抑制垂体腺瘤细胞中PI3K-AKT的活性,降低抗凋亡蛋白Bcl-2的表达,并上调促凋亡蛋白p53和Bax的表达,诱导垂体腺瘤细胞凋亡。PI3K-AKT信号转导通路在细胞中广泛存在,并在细胞生长、增殖、凋亡等过程中扮演重要角色。研究发现,在许多类型的癌症中PI3K/AKT信号通路异常激活[22-23]。AKT是PI3K下游的关键信号分子,在肿瘤的发生发展过程中,AKT的磷酸化可以促进肿瘤的侵袭和迁移,并调节其下游靶基因p21、p27、Bax和Bcl-2的表达,促进肿瘤的生长[22,24]。肿瘤抑制因子p53是一种转录因子,AKT也可以磷酸化p53结合蛋白鼠双微粒体2(murine double minute 2,MDM2),从而影响p53的活性[24]。
综上所述,本研究通过人工智能技术和药物重定位在全球上市药物中寻找有垂体腺瘤治疗潜力的候选药物,并验证了他莫昔芬在体外对垂体腺瘤细胞增殖和激素分泌有抑制作用,为垂体腺瘤的新药研发与临床用药提供了新思路,也为其他上市药物的重定位提供借鉴。

