常规超声联合声触诊组织成像定量技术诊断三阴性乳腺癌的价值
王 珏 陈赛君 詹锦勇 徐开颖 魏秀芝 刘亚辉 贲志飞
近年来,乳腺癌发病率逐年上升且呈年轻化趋势,严重危害广大女性的身体健康。随着乳腺癌筛查技术的发展,乳腺癌的检出率虽然明显增高,但晚期患者的长期生存率仍不佳,故乳腺癌的生物学指标越来越受到关注。三阴性乳腺癌(triple negative breast cancer,TNBC)是特指在免疫组化检测中 ER、PR、HER-2 表达均为阴性的一种特殊类型的乳腺癌,其好发于年轻女性,具有高侵袭性、高复发率、高病死率及对内分泌治疗和靶向治疗均不敏感的特点[1],但其对术前新辅助化疗较为敏感,因此早期鉴别TNBC 对制定合理的治疗方案尤为重要。声触诊组织成像定量(virtual touch tissue imaging quantification,VTIQ)技术是近年兴起的超声新技术,其利用短周期脉冲声压在组织内部产生局部位移,能较准确地检测病灶的横向剪切波的速度,已成为诊断乳腺癌的重要超声辅助手段[1]。本研究通过多因素Logistic 回归分析构建常规超声联合VTIQ 技术诊断三阴性乳腺癌的预测模型,旨在为临床制定更合理的治疗方案提供参考。
资料与方法
一、研究对象
选取2017 年9 月至2019 年9 月我院经手术病理确诊的乳腺癌女性患者170 例,年龄24~84 岁,平均(52.23±10.91)岁;肿块最大径 0.67~5.25 cm,平均(2.36±1.06)cm。其中TNBC患者36例(TNBC组),平均年龄(51.88±12.32)岁,肿块平均最大径(2.60±1.21)cm;非TNBC 患者134例(non-TNBC 组),平均年龄(52.32±10.54)岁,肿块平均最大径(2.30±1.01)cm。两组年龄、肿块最大径比较差异均无统计学意义。纳入标准:①双侧乳腺均同时接受常规超声及VTIQ 检查;②所有患者为单发病灶,或多发病灶中仅其中一个确诊为恶性;③所有病灶检查前未进行放化疗及内分泌治疗。排除标准:①超声、病理及免疫组化检查资料不齐全者;②肿块以囊性成分为主;③病灶内存在大片钙化;④病灶最大径≥8 cm;⑤多发性或弥漫性乳腺癌。本研究经我院医学伦理委员会批准,所有患者术前均签署知情同意书。
二、仪器与方法
使用西门子Acuson S 3000 彩色多普勒超声诊断仪,9L4 探头,频率 4~9 MHz;配备 VTIQ 成像软件。患者取仰卧位或对侧后斜卧位,并将手臂上抬,先行常规超声观察乳腺肿块形态、边缘、边界、内部回声、微钙化、后方回声、血流情况等特征;然后在乳腺肿块最大切面进行VTIQ 检查,先观察图像质量控制模式,如目标区域为均匀绿色或少许黄色,则在速度成像模式下于病灶内随机测量4~6 次剪切波速度(SWV),测得肿块的SWV 最大值、平均值、最小值,同时在远离肿块周边获取正常乳腺组织的SWV 值,计算肿块SWV 平均值与正常乳腺组织SWV 比值(SWV 平均值/正常值);均重复测量2~3 次取其均值。
三、统计学处理
结 果
一、两组常规超声特征比较
两组肿块形态、边缘、微钙化、后方回声比较差异均有统计学意义(均P<0.05)。见表1和图1,2。

表1 两组常规超声特征比较 例
二、两组VTIQ各参数比较
两组 SWV 最大值、SWV 平均值、SWV 最小值、SWV 平均值/正常值比较差异均有统计学意义(均P<0.01)。见表 2 和图 1,2。SWV 最大值、SWV 平均值、SWV 最小值及 SWV 平均值/正常值鉴别 TNBC 的曲线下面积分别为 0.784、0.766、0.703、0.751,其中SWV最大值的诊断效能最佳,当SWV最大值<6.98 m/s时诊断敏感性为73.1%,特异性为83.3%。见图3。
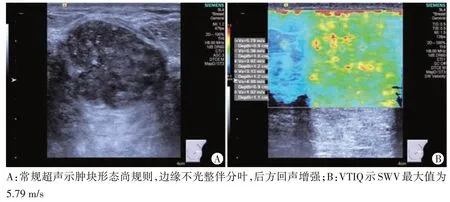
图1 TNBC组常规超声及VTIQ图
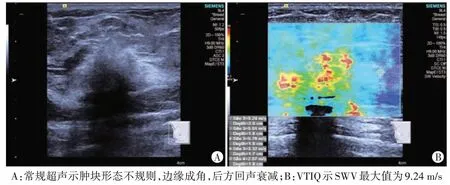
图2 non-TNBC组常规超声及VTIQ图
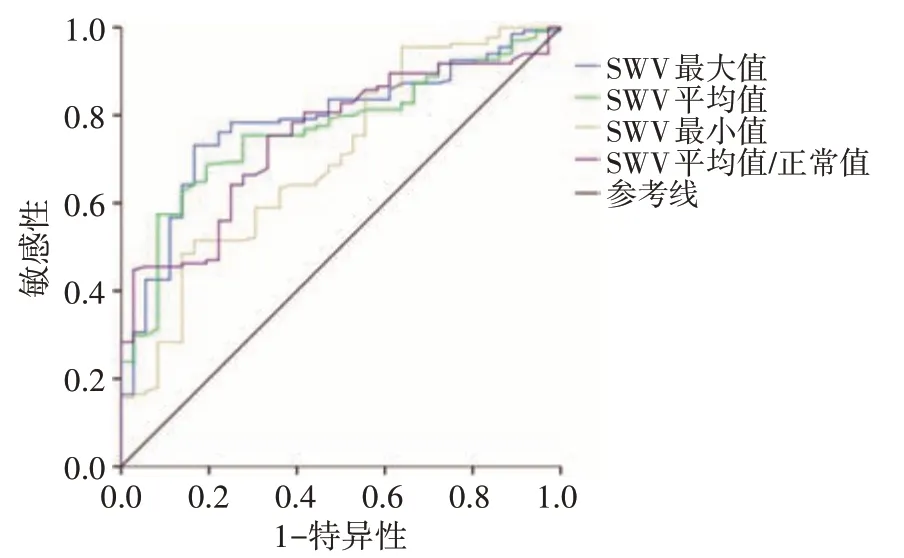
图3 VTIQ 各参数鉴别TNBC的ROC曲线图
表2 两组VTIQ各参数比较()
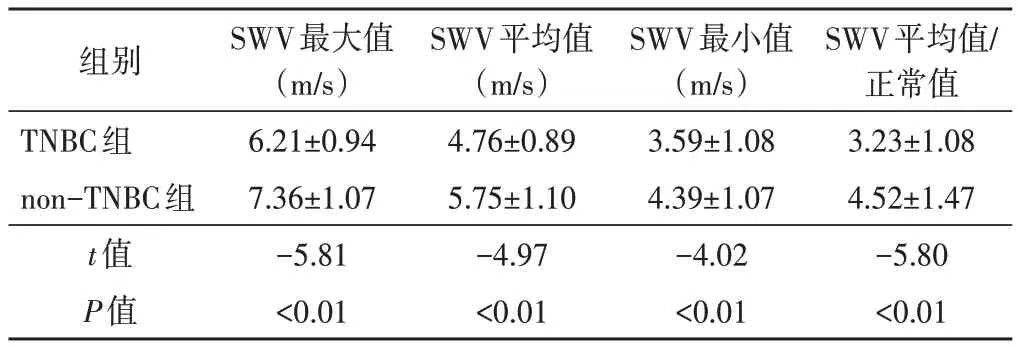
表2 两组VTIQ各参数比较()
SWV:剪切波速度
组别TNBC组non-TNBC组t值P值SWV最大值(m/s)6.21±0.94 7.36±1.07-5.81<0.01 SWV平均值(m/s)4.76±0.89 5.75±1.10-4.97<0.01 SWV最小值(m/s)3.59±1.08 4.39±1.07-4.02<0.01 SWV平均值/正常值3.23±1.08 4.52±1.47-5.80<0.01
三、预测模型的建立及其鉴别TNBC的诊断效能
将单因素分析中差异有统计学意义的4种常规超声特征及SWV 最大值纳入多因素Logistic 回归分析,结果显示,SWV 最大值<6.98 m/s、形态规则、边缘不光整伴分叶和后方回声增强均是鉴别TNBC 的 独 立 影 响 因 素(OR=0.321、3.874、6.828、6.525)。建立的预测模型为:Logit(P)=3.764-1.137*SWV最大值<6.98 m/s+1.354*形态规则+1.921*边缘不光整伴分叶+1.876*后方回声增强。ROC 曲线分析显示,该预测模型鉴别TNBC 的敏感性、特异性、阳性预测值及阴性预测值分别为80.6%、85.7%、72.0%、87.6%,曲线下面积为0.869。
讨 论
TNBC 是乳腺癌中预后较差的一类,其病理分化程度低,侵袭性和转移率高,且对内分泌和靶向药物治疗敏感度欠佳。研究[2-3]表明新辅助化疗可缩小TNBC 原发肿瘤的体积,降低其分期,改善患者的预后,故术前早期诊断对于TNBC 患者治疗方案的选择及预后预测具有重要意义。
本研究对常规超声特征行单因素分析显示,病灶形态、边缘、微钙化、后方回声对鉴别TNBC 有临床价值。TNBC 病灶形态规则、边缘成角/毛刺少可能与TNBC肿瘤细胞生长方式有关。有学者[4-5]认为肿块形态规则是因为TNBC 生长迅速导致其尚未产生癌周反应,也可能与其边缘呈膨胀性生长方式有关,本研究结果与之相符。研究[5]表明,TNBC 病灶边缘成角/毛刺较少是因为其主要造成Cooper 韧带的移位(而非破坏),对周边组织呈“推挤式”或“膨胀性”生长。本研究结果显示TNBC 内部微钙化较少见,与刘瑾瑾等[1]、魏晏平等[6]研究结果一致,但也有文献[7]报道TNBC 与非TNBC 微钙化方面比较差异无统计学意义,这可能是因为超声对部分微钙化的显示欠佳,检出重复性较差。本研究结果显示TNBC 后方回声以增强为主,分析原因为TNBC 内部易出现坏死、液化、淋巴细胞浸润,再加上其为富细胞、少纤维组织的肿瘤,当病灶较均一时,反射较少,后方回声衰减较轻。
TNBC 常规超声多表现为形态规则、边缘不光整伴分叶、后方回声增强等,与部分乳腺良性肿块(不典型的纤维腺瘤、腺病等)难以鉴别。在常规超声基础上结合超声弹性成像综合分析有助于减少TNBC 的误诊。VTIQ 技术是新一代弹性成像技术,具有客观、可重复性较好、受操作者影响较小等优点,已被广泛应用于乳腺癌的筛查。本研究结果显示,TNBC 组SWV最大值、SWV 平均值、SWV 最小值、SWV 平均值/正常值均小于non-TNBC 组(均P<0.05);且SWV 最大值<6.98 m/s 的诊断效能最高,与刘瑾瑾等[1]研究结果一致。研究[8]表明ER、PR 的阳性表达与乳腺癌内部的微钙化形成呈显著正相关,而微钙化是导致病灶硬度增加的重要因素。HER-2 过表达时原癌基因激活,导致肿块向腺体外浸润范围增大,最终引起肿块周围胶原结缔组织的增生和聚集,胶原组织的增加在肿块的硬度变化上发挥了关键作用[8-9],TNBC 患者 ER、PR、HER-2均为阴性,故肿块硬度较低。另外,TNBC 生长速度快,影像学上易呈现良性肿块的特征,诊断时常已处于晚期,肿瘤内部出现出血、液化、坏死等表现亦可导致其硬度减低。
由于TNBC 与非TNBC 的超声表现存在一定的交叉重叠性,目前多以检查者的主观经验定性分析为主,尚无统一的定量预测方法。本研究对两者进行多因素Logistic回归分析,成功筛选出差异有统计学意义的超声参数,即SWV 最大值<6.98 m/s、形态规则、边缘不光整伴分叶和后方回声增强,并建立了回归模型,该模型的敏感性、特异性、阳性预测值及阴性预测值分别为80.6%、85.7%、72.0%、87.6%,曲线下面积为0.869,表明该预测模型对TNBC 有较高的鉴别诊断效能。
本研究的局限性:①未考虑肿瘤的病理类型、组织学分级、临床分期等因素对结果的影响,需进一步细化分组研究;②由于VTIQ 对较大病灶采用多组随机然后取平均值的测量方法,测量位置不同可能导致测值有差异;③样本量小;后期需扩大样本量进一步完善。
综上所述,SWV 最大值<6.98 m/s、形态规则、边缘不光整伴分叶和后方回声增强是TNBC 的独立预测因素;常规超声联合VTIQ 参数建立的Logistic 回归模型对TNBC有较高的诊断效能,可为预测TNBC提供重要参考。

