NH2-MIL-101(Cr)材料对甲醛的吸附性能研究*
谢书淇 董子恂 刘 燕
(四川农业大学环境学院,四川 成都 611130)
甲醛是挥发性有机物(VOCs)的代表物质之一,具有致癌性和致畸性,长时间接触高浓度甲醛会对人体健康产生威胁[1-2],因此开发一种高效、经济的除甲醛方法已引起人们的广泛关注。近年来,吸附、光催化氧化、盆栽植物土壤系统等除甲醛技术已被广泛应用[3-5]。其中,吸附法具有脱除率高、能耗低、无二次污染、操作简便等优点,是一种很有前途的除甲醛方法[6-8],而开发具有高比表面积、可调节孔隙率的甲醛吸附材料是该技术的关键所在。
金属有机骨架材料(MOFs)是一类具有规则纳米孔道的三维周期性网络结构的新型多孔晶体材料,具有比表面积大、孔道多样、结构和性能可设计等优势,受到众多学者的关注与青睐[9-10]。MOFs作为新兴的多孔材料,在吸附分离、膜分离、荧光等应用领域具有传统材料无法比拟的优势,具有广阔的潜在应用前景[11-12]。
本研究以硝酸铬为金属盐,以对苯二甲酸(H2BDC)、2-氨基对苯二甲酸(NH2BDC)为有机配体,通过水热合成法制备两种MOFs,对两种材料的物化性质进行表征,考察了其对甲醛的吸附性能和吸附特征,并对吸附机理进行分析,研究结果可为除甲醛材料的研发生产提供基础数据。
1 实验方法
1.1 仪器与试剂
仪器:V-1100D型分光光度计、HJ-4A型磁力搅拌器、101-0A型恒温鼓风干燥箱、HH-6型数显恒温水浴锅、TDZ4-WS型离心机、100 mL水热合成反应釜、JCY-4型接触角测定仪、Zeiss Sigma 300扫描电子显微镜(SEM)、NanoStart SAXS X射线衍射仪(XRD)、Nicolet 6700傅立叶红外光谱仪(FTIR)。
试剂:硝酸铬、NH2BDC、H2BDC、N,N-二甲基甲酰胺(DMF)、甲醛、无水乙醇,所有试剂均为分析纯。
1.2 MOFs的制备
参考文献[13]中的方法,将一定硝酸铬溶于60 mL DMF中,在50 Hz超声条件下溶解10 min形成均匀溶液。分别以H2BDC、NH2BDC为有机配体加入到上述溶液中,控制硝酸铬与有机配体的摩尔比为1.0∶2.5,用磁力搅拌器搅拌30 min。将获得的悬浮液倒入含特氟隆内衬的不锈钢高压釜中,在烘箱180 ℃下反应10 h,反应结束后自然冷却到室温,获得的产物依次经过DMF、无水乙醇、蒸馏水离心洗涤各两次,将洗涤干净的产物转移至培养皿中,60 ℃下干燥2 h后研磨,获得两种粉末状MOFs材料,分别命名为MIL-101(Cr)、NH2-MIL-101(Cr)。
1.3 MOFs材料的表征
使用SEM观察MOFs材料的表面形貌特征;采用XRD测试MOFs材料的晶相结构;利用FTIR对MOFs材料的官能团进行研究;使用接触角测定仪检测MOFs材料的水接触角。
1.4 甲醛吸附实验
甲醛吸附实验在密闭吸附装置(见图1)中进行,吸附装置主体为直径21 cm 的玻璃干燥器,将10 mL质量浓度分别为200~1 000 mg/L的甲醛溶液置于玻璃干燥器底部;称取0.05 g NH2-MIL-101(Cr)于称量瓶中,放置在玻璃干燥器的干燥隔板上;自制小风扇用于装置内部空气循环。将该玻璃干燥器密封后放入水浴锅中,一定温度下吸附一定时间,吸附结束后用纯净水充分浸取吸附有甲醛的NH2-MIL-101(Cr),定容后利用《水质 甲醛的测定 乙酰丙酮分光光度法》(HJ 601—2011)测定甲醛浓度,计算NH2-MIL-101(Cr)对甲醛的吸附量。
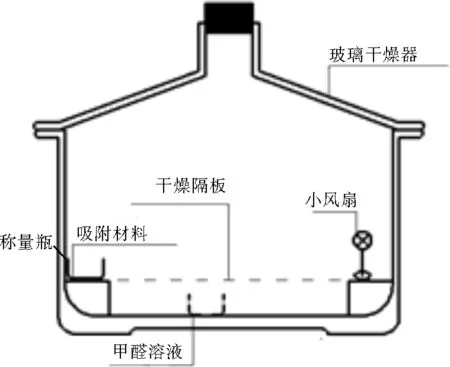
图1 甲醛吸附装置Fig.1 Methanal adsorption device
2 结果与讨论
2.1 MOFs材料的表征结果
2.1.1 表面形貌分析
通过SEM对2种MOFs材料进行表面形貌分析,结果见图2。由图2(a)可见,MIL-101(Cr)呈相对规整的立方体结构,具有良好的结晶度,与前人报道的形貌结构相似[14]。与其相比,NH2-MIL-101(Cr)有明显的纳米粒子聚集(见图2(b)),这是由于氨基引入导致,使得其表面更加疏松、多孔,比表面积更大,更有利于对甲醛的吸附。

图2 MIL-101(Cr)和NH2-MIL-101(Cr)的SEM图Fig.2 SEM images of MIL-101(Cr)and NH2-MIL-101(Cr)
2.1.2 XRD分析
通过XRD对两种MOFs材料进行晶相结构分析。由图3可见,两种材料结晶度均很高,且主要特征峰与QIU等[15]、SHARMA等[16]合成的改性MIL-101(Cr)材料一致,可见NH2-MIL-101(Cr)同属于MIL-101(Cr)结构,氨基的引入未破坏材料的原有结构。此外,MIL-101(Cr)在25.18°、27.85°处有衍射峰出现,这是因为材料合成过程中使用的H2BDC在离心洗涤的过程中未去除干净造成[17]。

图3 NH2-MIL-101(Cr)和MIL-101(Cr)的XRD图谱Fig.3 XRD spectrum of NH2-MIL-101(Cr) and MIL-101(Cr)
2.1.3 FTIR分析
两种MOFs材料的FTIR图谱见图4。两种材料均在3 000~3 500、1 625 cm-1处出现较宽吸收峰,是由水分子中—OH的伸缩振动引起;在576 cm-1附近出现的吸收峰与材料中Cr—O振动带有关。MIL-101(Cr)在751、883、1 013、1 103 cm-1处的吸收峰是由芳香环中C—H基团振动引起,1 510 cm-1处的吸收峰与C=C基团的振动有关[18],1 395 cm-1附近的明显吸收峰为—COOH的对称伸长峰[19];1 662 cm-1附近的短峰是由材料气孔中少量未反应的NH2BDC导致。NH2-MIL-101(Cr)的FTIR图谱与MIL-101(Cr)相比存在一定差异,首先在751、883、1 013、1 510 cm-1处的吸收峰分别移动到766、894、970、1 501 cm-1处,这些峰与芳香环的C—H基团和C=C基团有关,因此推测—NH2的引入对C—H和C=C等基团的键长有一定影响,从而造成吸收峰的漂移;其次材料出现较多新峰,如3 363、3 460 cm-1附近出现了—NH2的不对称和对称伸缩振动峰[20],在1 250、1 433 cm-1附近出现C—N键的伸缩振动和—COOH的不对称伸缩振动峰。
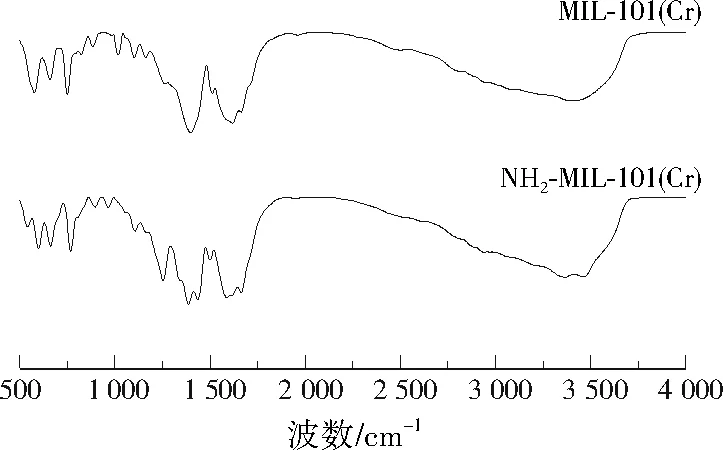
图4 NH2-MIL-101(Cr)和MIL-101(Cr)的FTIR图谱Fig.4 FTIR spectra of NH2-MIL-101(Cr) and MIL-101(Cr)
2.1.4 材料疏水角研究
使用压片机在30 MPa 条件下对两种MOFs材料压制30 s形成片状,测定两种材料的疏水角。测定结果表明NH2-MIL-101(Cr)的水接触角为(36±1)°,是MIL-101(Cr)水接触角((5±1)°)的近6倍,说明NH2-MIL-101(Cr)疏水性增强。传统MOFs材料的水稳定不好,是因为水分子会在金属中心产生团簇,使金属配位键受到攻击,从而出现崩塌。而NH2-MIL-101(Cr)通过引入氨基改变了材料的水稳定性,推测是因为水分子和氨基都属于极性基团,氨基对水分子有较强的吸引力,从而攻击金属配位键的水分子减少,导致材料水稳定性增强[21]。
综上分析可知,与MIL-101(Cr)相比,氨基功能化的NH2-MIL-101(Cr)材料在表面形貌结构与功能基团上均有所改善,水稳定性也有一定增强,因此后续实验选择NH2-MIL-101(Cr)作为吸附材料进行甲醛吸附性能研究。
2.2 NH2-MIL-101(Cr)吸附甲醛实验
2.2.1 吸附温度的影响
控制甲醛溶液初始质量浓度为1 000 mg/L,吸附时间为6 h,调节吸附温度分别为20、30、40、50、60 ℃,考察吸附温度对甲醛吸附性能的影响,结果见图5。总体看来,NH2-MIL-101(Cr)对甲醛的吸附量随着吸附温度的升高而增大,当吸附温度升至60 ℃时,甲醛吸附量有所下降。这是因为随着吸附温度的升高,甲醛分子挥发增大,单位体积内甲醛分子数量增大,与NH2-MIL-101(Cr)表面吸附位点碰撞概率增大,因此吸附量呈现上升的趋势。但是随着吸附温度的继续升高,被吸附的甲醛分子与未被吸附的甲醛分子碰撞的概率增大,甲醛分子容易获得更多的能量,从而很难被稳定吸附在NH2-MIL-101(Cr)表面[22],导致吸附量稍有下降。

图5 吸附温度对NH2-MIL-101(Cr)吸附甲醛的影响Fig.5 Effect of adsorption temperature on methanal adsorption by NH2-MIL-101(Cr)
2.2.2 甲醛溶液初始浓度的影响
控制吸附温度为50 ℃,吸附时间为10 h,调节甲醛溶液初始质量浓度分别为200、400、600、800、1 000 mg/L,考察甲醛溶液初始浓度对其吸附性能的影响,结果见图6。由图6可见,甲醛溶液初始质量浓度从200 mg/L提高到1 000 mg/L,NH2-MIL-101(Cr)对甲醛的吸附量呈先上升后下降的趋势,甲醛溶液初始质量浓度为600 mg/L时,吸附量达到最大值92.29 mg/g。这是因为当甲醛溶液初始浓度较低时,NH2-MIL-101(Cr)表面吸附活性位点多于甲醛分子,从而存在较大的吸附容量,随着甲醛初始浓度的增加,提高了浓度梯度的驱动力,导致NH2-MIL-101(Cr)对甲醛的吸附量逐步增大[23]。当甲醛初始质量浓度达到600 mg/L时,材料表面吸附位点被占据,吸附逐渐达到饱和[24]。当初始质量浓度超过600 mg/L后,甲醛吸附量开始下降,推测是因为吸附体系中挥发出的甲醛数量增多,导致未被吸附的甲醛分子与被吸附在NH2-MIL-101(Cr)表面及孔道内的甲醛分子发生碰撞,导致甲醛不能稳定吸附在材料表面,从而产生了脱附的现象。
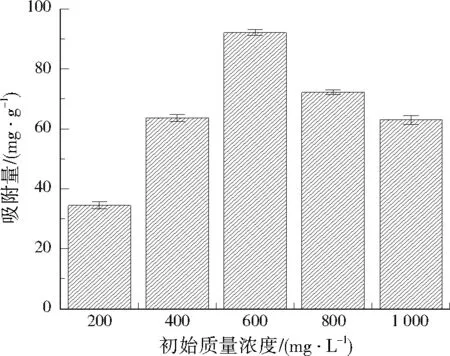
图6 甲醛溶液初始质量浓度对NH2-MIL-101(Cr)吸附甲醛的影响Fig.6 Effect of initial mass concentration of methanal solution on methanal adsorption by NH2-MIL-101(Cr)
2.3 NH2-MIL-101(Cr)吸附性能研究
为了解NH2-MIL-101(Cr)对甲醛的吸附动力学,控制吸附温度为50 ℃,甲醛溶液初始质量浓度为600 mg/L进行吸附实验,分别采用拟一级动力学模型(见式(1))和拟二级动力学模型(见式(2))对吸附数据进行拟合,拟合结果见图7、表1。
lg(qe-qt)=lgqe-k1t
(1)
(2)
式中:qe为吸附平衡状态下的吸附量,mg/g;qt为吸附t时刻的吸附量,mg/g;k1为拟一级吸附速率常数,min-1;t为吸附时间,min;k2为拟二级吸附速率常数, g/(mg·min)。

表1 吸附动力学拟合参数Table 1 Adsorption kinetic equation parameters
由图7可见,两种模型的拟合曲线对吸附数据的拟合度均较高,说明NH2-MIL-101(Cr)对甲醛的吸附既有内外扩散的作用,也有化学吸附的作用。由表1拟合数据可知,拟二级动力学模型的R2为0.986,高于拟一级动力学模型的0.967,且该模型计算出的qe为94.88 mg/g,与实验数据(92.29 mg/g)更为接近,说明NH2-MIL-101(Cr)对甲醛的吸附主要以化学吸附为主,这可能与改性引入的—NH2有关。
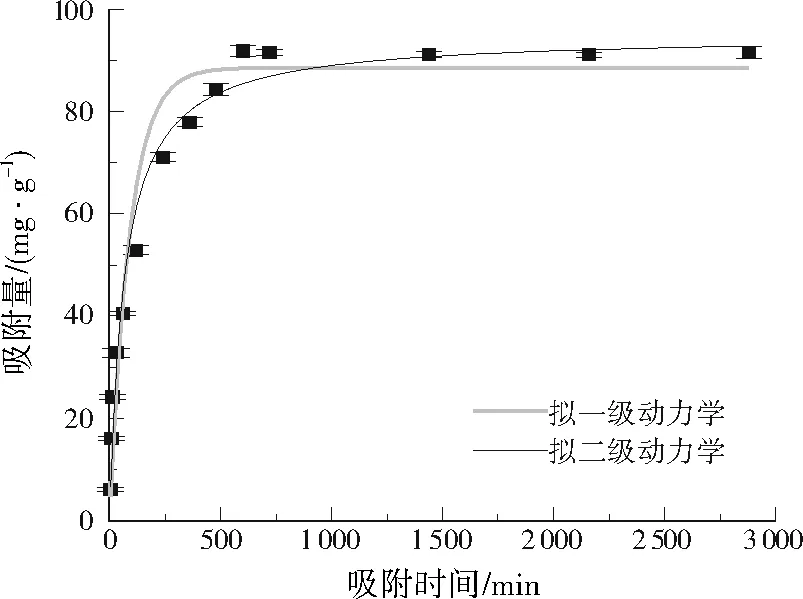
图7 NH2-MIL-101(Cr)对甲醛的吸附动力学拟合曲线Fig.7 Adsorption kinetics curves of NH2-MIL-101(Cr) for methanal
2.4 吸附机理研究
为了研究NH2-MIL-101(Cr)对甲醛的吸附机理,对NH2-MIL-101(Cr)吸附甲醛前后的官能团变化进行分析。由图8可见,吸附甲醛后NH2-MIL-101(Cr)在1 250 cm-1附近的C—N键及3 400 cm-1附近的—NH2吸收峰峰强都有降低,说明C—N键和—NH2基团都参与了甲醛的吸附反应。此外,吸附甲醛后的NH2-MIL-101(Cr)在3 500 cm-1附近的—COOH吸收峰明显变宽,说明—COOH也参与了吸附过程。根据前期实验结果,NH2-MIL-101(Cr)对甲醛的吸附性能与MIL-101(Cr)相比有了较大提升,说明—COOH不是参与甲醛吸附的主要基团,由此可以推断引入的—NH2基团及C—N键对甲醛的吸附起主导作用。
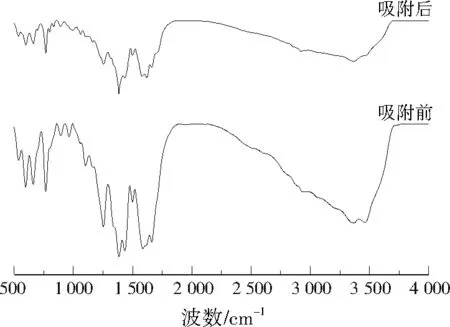
图8 NH2-MIL-101(Cr)吸附甲醛前后的FTIR图谱Fig.8 Comparison of the FTIR spectra for NH2-MIL-101(Cr) before and after methanal adsorption
3 结 论
通过水热合成法制备MIL-101(Cr)、NH2-MIL-101(Cr),与MIL-101(Cr)相比,NH2-MIL-101(Cr)表面更加疏松、多孔,比表面积更大,表面官能团也更加丰富多样。NH2-MIL-101(Cr)通过引入氨基使材料的水稳定性显著增强,水接触角为MIL-101(Cr)的6倍左右。NH2-MIL-101(Cr)对甲醛表现出较强的吸附性能,当吸附温度为50 ℃,吸附时间为10 h,甲醛溶液初始质量浓度为600 mg/L时,NH2-MIL-101(Cr)对甲醛的吸附量可高达92.29 mg/g。NH2-MIL-101(Cr)对甲醛的吸附更符合拟二级动力学模型,说明吸附过程主要受化学吸附主导。其中—NH2基团、C—N键等在吸附过程中起着主导作用。

