CD19靶向CAR T细胞于亲缘半相合干细胞移植前后2次挽救治疗复发Ph+ B-ALL 1例并文献复习
余先球,费小明,王丽霞,雷芳,陆雯萍,曹江,汤郁
费城染色体阳性(Ph+)的B细胞急性淋巴细胞白血病(B-ALL)多见于成年人,其发生率随着年龄的增大而相应提高。尽管随着酪氨酸激酶抑制剂如伊马替尼、达沙替尼的出现,Ph+B-ALL的预后较以往有了较大的改善,但较高的复发率与对治疗的耐药仍然是临床面临的挑战。对于复发的Ph+B-ALL患者,异基因造血干细胞移植(HSCT)是重要的挽救治疗方法,但是仍有相当高比例的患者在HSCT后复发,对于这类移植后复发的患者治疗非常困难。
以B淋巴细胞表面抗原CD19作为靶点的嵌合抗原受体T 细胞( chimeric antigen receptor T cells,CAR T细胞)自临床应用以来,被证实对难治/复发B-ALL有很高的治疗有效率。目前临床多采用患者自体的T淋巴细胞来制备CAR T细胞;而对于接受异基因HSCT后复发的患者,则一般采集供者T淋巴细胞来制备CAR T细胞。本文报道1例Ph+B-ALL患者在第1次复发后,经自体CD19靶向CAR T细胞挽救治疗后达分子生物学缓解,并桥接半相合HSCT,移植后患者再复发,用采集于患者来源的淋巴细胞,再次制备与第1次完全相同构建的CAR T细胞,成功挽救移植后复发的病例。
1 病例资料
1.1 CAR T细胞治疗前诊疗过程 患者男性,45岁。2015年10月因“乏力、发热、皮肤出血”起病。骨髓涂片示原幼淋细胞比例95%,免疫分型示B细胞-ALL,染色体核型分析费城染色体阳性,融合基因BCR-ABL-190阳性,诊断Ph+B-ALL。给予伊马替尼联合VDCP方案诱导化疗后获 CR,两疗程化疗后BCR-ABL-190转阴。缓解后继续口服TKI并接受MA、CAM、HD-MTX等方案巩固/强化治疗,并接受伊马替尼+6-MP+MTX、间断COATD方案维持治疗,期间定期复查骨髓BCR-ABL-190融合基因均阴性,长期口服伊马替尼维持治疗。2019年7月患者ALL复发,骨髓原幼淋细胞比例85%,免疫表型 CD19 90%阳性,融合基因BCR-ABL-190/ABL:84.106%,ABL激酶突变未检出。予利妥昔单抗+HyperCVAD方案的A、B方案各一疗程诱导化疗后,复查骨髓示原幼淋4%,BCR-ABL-190/ABL:23.038%。
1.2 淋巴细胞采集及CD19-CAR-T制备 经科室讨论并由患者签署知情同意书后,患者纳入CD19靶向CAR T治疗复发/难治性B细胞恶性肿瘤临床试验(伦理审查批件号:XYFY2017- KL014-01)。患者在挽救化疗前已行自体外周血淋巴细胞单采,体外制备自体人源化CD19靶向CAR T细胞,以4-1BB和CD28作为共刺激分子,制作的详细过程参考文献[1]。
1.3 CAR T细胞治疗过程 患者在-5天始接受FC方案( 氟达拉滨25 mg/m2×3 d; 环磷酰胺250 mg/m2×3 d)预处理。第0天单次剂量输注制备的CD19靶向CAR T细胞,回输CAR T细胞总数为1×106/kg体质量。
1.4 CAR-T回输后CRS诊断及分级 将患者接受CAR-T治疗后并发的CRS参照文献[2]分成1~5级。脏器损害判断标准参照文献[3]进行,并给予对应处理。
1.5 亲缘半相合异基因造血干细胞移植治疗 患者在第1次CD19靶向CAR T细胞治疗缓解后口服伊马替尼维持治疗,CAR T后+157天桥接亲缘半相合移植(子供父,O供O),预处理方案:阿糖胞苷 4g/m2,-10、-9天;白消安 0.8 mg/kg q6h,-8、-7、-6天;环磷酰胺 1.8g /m2,-5、-4天;司莫司汀250 mg/m2,-3天。GVHD预防参照GIAC体系,并且在移植后+3及+4天给予小剂量的PTCY(环磷酰胺14.5 mg/kg体质量)。
1.6 干细胞移植后治疗 患者接受半相合移植后按流程撤减免疫抑制剂,在+4月起接受达沙替尼口服治疗,期间有皮肤慢性GVHD,加用糖皮质激素治疗后病情控制。
1.7 移植后复发治疗 单倍体移植后+386天患者复查骨髓示:骨髓增生活跃,粒系增生,红系减低,可见1.5%原幼淋,全片可见4个巨核细胞。染色体核型分析:46,XY, t(9;22)(q34;q11)[1]/46XY[11];融合基因BCR-ABL-190/ABL: 14.4462%,嵌合度STR降至88.7%,提示疾病复发。予单采患者外周血淋巴细胞,体外制备与之前CAR T相同构建的CD19靶向CAR T细胞,制备过程同前。淋巴细胞单采后予小剂量地西他滨(10 mg/d ×5 d)治疗,1月后复查骨髓涂片:见21%原幼淋;融合基因BCR-ABL-190/ABL:75.616%;染色体检查:46,XY,t(9;22)(q34;q11)[5] /46XY[15]。此时CD19靶向CAR T细胞制备成功,予FC方案(剂量用法同前)去T细胞后回输患者细胞来源CD19靶向CAR T细胞。输注前后未行GVHD预防。
2 结果
2.1 CAR-T治疗疗效 患者移植前接受自体CD19靶向CAR T治疗获分子生物学完全缓解,MRD持续阴性近半年并桥接半相合干细胞移植。移植后复发状态下再次接受自体细胞来源CD19靶向CAR T细胞治疗后21天复查血常规:白细胞计数1.3×109/L,中性粒细胞计数0.5×109/L,血红蛋白82 g/L,血小板计数61×109/L;骨髓细胞形态检查:此部位骨髓增生极度减低,粒系以成熟阶段为主,红系增生,巨核细胞未见;染色体核型分析:46,XY[8];融合基因BCR-ABL-190/ABL:0。第2次CAR T细胞治疗后55 d复查血常规:白细胞计数3.9×109/L,中性粒细胞计数1.5×109/L,血红蛋白93 g/L,血小板计数126×109/L;骨髓细胞形态检查:增生明显活跃,原幼淋0.5%,粒、巨两系增生,红系增生明显;染色体核型:46 XY[20];BCR-ABL-190:阴性;白血病免疫分型示未见免疫表型异常;ABL激酶突变阴性;嵌合度STR:98.5%。
2.2 CAR T细胞治疗不良反应 患者移植前接受自体CAR T细胞治疗没有观察到细胞因子释放综合征( CRS) 。移植后自体细胞来源CD19靶向CAR T治疗后第10天出现发热,同时伴有铁蛋白及IL-6水平明显上升,CRS 1级。予对症退热,接受2个剂量的妥珠单抗治疗后症状缓解,无CRES不良反应。2次CAR T细胞治疗情况及不良反应详见表1。
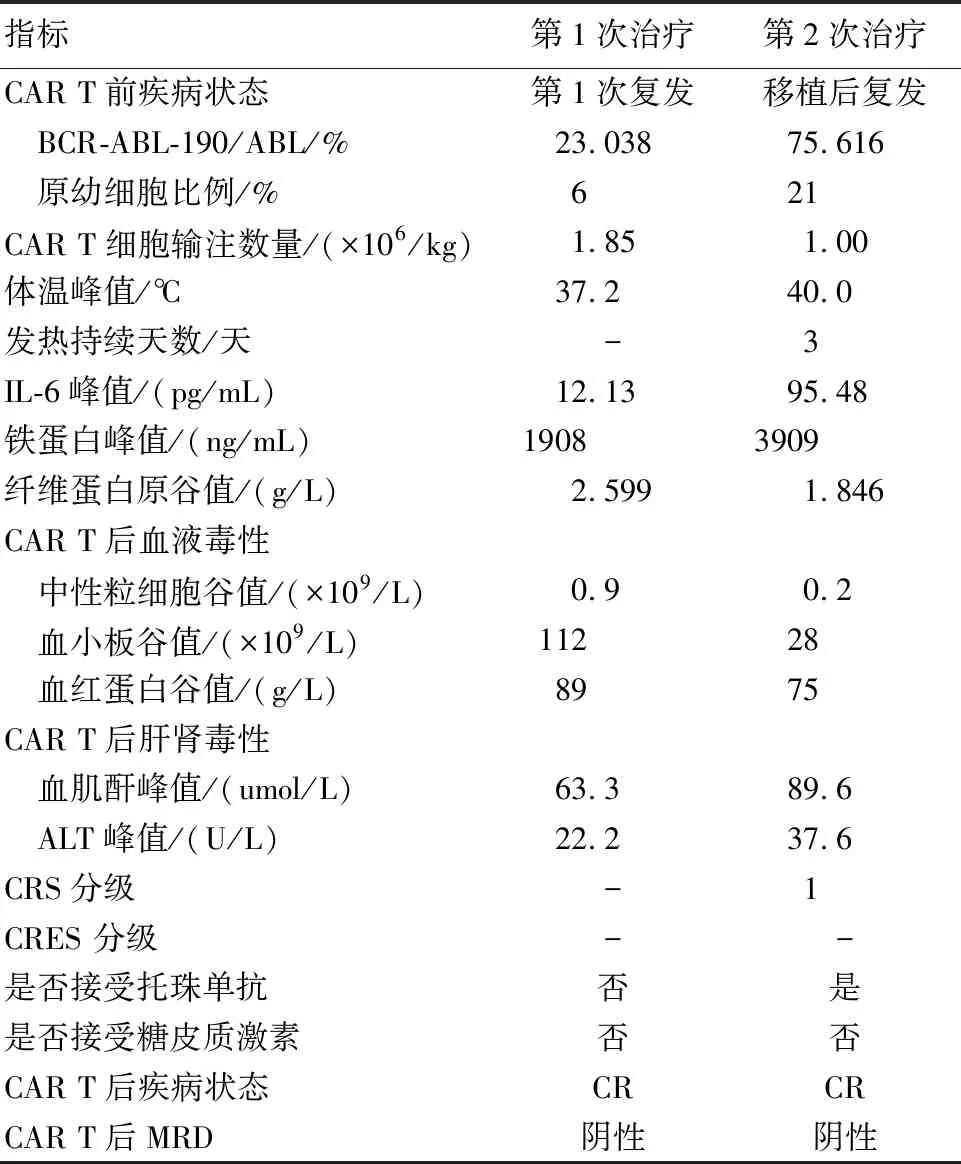
表1 2次CAR T治疗情况及治疗相关不良反应
2.3 半相合干细胞移植后接受自体CAR T细胞GVHD情况 半相合血干细胞移植后再次接受自体细胞来源CD19靶向CAR T细胞治疗过程中未行GVHD预防,回输CAR T细胞后随诊3月,未发生GVHD,慢性GVHD仍需更长随诊观察时间。
3 讨论
成人Ph+B-ALL作为ALL的一个特殊亚型,对传统化疗反应极差,绝大多数患者在诊断3年内死于原发疾病。虽然随着TKI的出现,尤其是新一代TKI普那替尼的运用,TKI+化疗的治疗模式明显地改善了Ph+B-ALL的预后,但疾病的复发率仍然较高,对于复发ALL患者,异基因HSCT是公认的以治愈为目的的挽救治疗。而复发患者如果移植前不能达到缓解,或者微小残留病变(MRD)阳性,均对异基因HSCT的结果有不利的影响。经TKI治疗的Ph+B-ALL复发后,可对白血病细胞的ABL激酸突变位点测序检测,如果发现已知位点的突变,则可根据突变位点类型进行TKI的选择,有利于提高挽救治疗的成功率。但本例患者在第1次复发后,并没有发现ABL突变位点,虽然更换了二代TKI达沙替尼+化疗治疗,患者并没有达到分子生物学完全缓解,如果此时进行HSCT则移植效果很差。
对于这种化疗和靶向药均耐药的Ph+B-ALL复发病例,CAR T细胞具有不同于传统化疗药物和TKI的白血病细胞杀伤机制,它可以靶向特异性抗原并杀灭体内肿瘤细胞,作为新型免疫疗法在复发难治性B-ALL取得了较高的缓解率,有效率达70%~90%[4-5],被认为是最有前景的肿瘤治疗方式之一。本病例在第1次复发后,经自体CD19靶向CAR T细胞治疗后,成功地达到了MRD阴性的完全缓解,使本例患者获得了HSCT的机会。患者在第1次CAR T细胞治疗后,并没有出现CRS等不良反应,考虑与患者当时体内的肿瘤负荷较低有关。因为既往有研究认为,CRS的发生率及严重程度,与患者接受CAR T细胞治疗时的肿瘤负荷呈正相关。
异基因HSCT移植后,虽然移植物抗肿瘤(GVT)效应有利于白血病的控制,但是移植后复发仍是主要死因。异基因造血干细胞移植后复发患者生存期常不足6个月[6]。虽然本例患者在移植后达到了供者细胞的完全嵌合,再加上达沙替尼维持治疗,并且进行MRD水平密切监测,但是其在移植后1年仍然复发,这提示患者体内极少数的Ph+白血病细胞仍然可以导致疾病复发。移植后复发挽救治疗方法通常包括撤减免疫抑制剂、干扰素、再诱导化疗、供者淋巴细胞输注(DLI)及2次干细胞移植等,但这些治疗方法疗效有限,同时撤减免疫抑制、DLI可能诱发严重GVHD[7]。Kochenderfer等[8]首次报道了供者来源CD19靶向CAR T细胞在治疗allo-HSCT后复发B细胞肿瘤患者中取得较好的疗效。Chen等[9]研究显示,移植后复发ALL患者接受CD19靶向CAR T细胞治疗后CR率达85.7%(30/34)。Zhang等[10]对32例allo-HSCT后复发的B-ALL患者进行CAR-T治疗,输注30天时缓解率为87.5%(28例CR,其中27例为MRD阴性)。但是通常情况下,经过CD19靶向CAR T细胞治疗过的B-ALL患者,在CAR T细胞治疗后复发时,CD19靶向CAR T细胞再次治疗往往无效。无效的机制包括白血病细胞表面CD19抗原的丢失、机体的免疫耐受等。本病例在移植后复发时,白血病细胞表面CD19抗原并没有丢失,其后再次给予相同构建的CD19靶向CAR T细胞治疗,患者又一次获得MRD阴性的完全缓解。对于这种在异基因移植前后,2次接受CD19靶向CAR T细胞挽救治疗,并获得成功的病例既往鲜有报道。这1病例的经验提示,对于CD19阳性复发的B-ALL,即使患者既往接受过CD19靶向CAR T细胞治疗,如果距上次治疗时间在1年以上且没有发生免疫逃逸,CD19靶向CAR T细胞仍然可能有效。
对于接受异基因HSCT后复发的B-ALL的患者,如果需进行CAR T细胞治疗,多数选择单采供者的淋巴细胞来制备CAR T细胞。采用供者细胞有多种优点:(1)供者本身健康,不像疾病复发的患者存在体能状态、合并症等限制,可以随时进行细胞采集;(2)患者经过反复化疗T淋巴细胞功能可能存在各种缺陷,影响CAR T细胞的效果;(3)采用供者细胞更能保证采集到足够数量的淋巴细胞。但是,采用供者细胞最大的缺点是有诱发GVHD的风险。Chen等[11]在对6例半相合移植后复发的B-ALL回输供者来源CAR T细胞挽救治疗时,其中3例发生了Ⅱ-Ⅲ度的急性GVHD。Anwer等[12]一项荟萃分析中纳入7项研究中72例接受异基因移植后复发的血液肿瘤患者,复发后接受供者来源CAR T的治疗,其中有5例(6.9%)诱发了GVHD。如果从HSCT患者体内采集淋巴细胞,虽然存在上述缺点,但是从理论上讲,制备的CAR T细胞回输后,引起GVHD的风险要远小于来自供者的CAR T细胞。同时有研究[13]报道显示,移植后复发患者接受CAR T细胞治疗时采用的CAR T细胞来源影响CAR T细胞治疗后OS及LFS,其中患者细胞来源组(17例)和供者细胞来源组(11例)的1年OS率分别为(87.5% vs 36.4%)(P=0.006),1年LFS率分别为(81.3% vs 36.4%)(P=0.017)。Hu等[14]报告接受异基因造血干细胞移植后供者CAR T在体内扩增能力低于自体CAR T细胞。不同于自体CAR T细胞只靠CAR起作用,供者CAR T通过CAR和T细胞受体(TCR)起作用,而两个系统可能存在相互作用而影响CAR T细胞的扩增[15-16]。本例患者移植复发后采用患者来源T细胞制备的CD19靶向CAR T细胞挽救治疗后再次让患者达分子生学缓解,虽然出现了I度的CRS反应,但临床并没有观察到GVHD。第2次CAR T细胞治疗后出现CRS,这可能与此时患者体内肿瘤负荷要高于第1次CAR T细胞治疗时有关。由此可见,异基因造血干细胞移植后患者来源的T细胞制备的CAR T细胞存在一定的疗效和副反应的优势。
综上所述,这1病例的经验提示:移植前接受过CD19靶向CAR T细胞治疗的Ph+B-ALL,移植后复发时再次接受同一构建的CD19靶向CAR T细胞治疗仍然可能有效;对于半相合移植后复发患者,采用患者来源的淋巴细胞制备CAR T细胞进行挽救治疗,是一个可行且低GVHD风险的挽救治疗方法。

