急性期视神经脊髓炎谱系病外周血IL-10水平与肢体伤残的相关性分析
李玉玉,马博,孙辉,许娟娟,许力,钱伟东
视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorder,NMOSD)是一种自身免疫性中枢神经系统脱髓鞘疾病[1],临床上多以反复发作的严重的视神经炎(optic neuritis,ON)和长节段脊髓炎(longitudinally extensive transverse myelitis,LETM)为特征性表现,核心临床症状包括极后区综合征、急性脑干综合征、间脑综合征、大脑综合征等。NMOSD病因尚不明确,发病机制主要与水通道蛋白4(Aquaporin4,AQP4)抗体相关。NMOSD可于各年龄段发病,青壮年起病多见,女性患者居多,男女比例可达到1:(4.7~11)[2];病程呈复发-缓解性,致残率高,严重影响患者生活质量。IL-10是一种经典的抗炎和免疫调节因子,主要通过抑制Th1、Th2介导的免疫应答而抑制其分泌相应的炎性因子,在多种炎症、自身免疫性疾病、肿瘤和神经退行性疾病等的发生发展中起重要的调控作用[3]。但IL-10在NMOSD急性期患者外周血的水平尚不明确,其参与发病具体机制不明。本研究旨在分析比较急性期NMOSD患者外周血IL-10水平表达及临床意义,并探讨其与NMOSD病程的发生发展及NMOSD患者的肢体伤残有无相关性。
1 资料与方法
1.1 一般资料 选取2019年10月—2021年5月在蚌埠医学院第一附属医院神经内科住院治疗的急性期NMOSD患者40例,根据水通道蛋白4(AQP4IgG)的检测结果,将患者分为AQP4(+)(18例)和AQP4(-)(22例)2个亚组,其中AQP4(+)组18例,男3例,女15例;年龄(47.87±13.95)岁;AQP4(-)组22例,男6例,女16例;年龄(51.23±14.91)岁。另选取同期健康对照组30例,男5例,女25例;年龄(47.87±13.95)岁。3组受试者一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经我院医学伦理委员会批准,所有受试对象均签署书面知情同意书。
1.2 入选标准 纳入标准:(1)年龄6~90岁的住院患者;(2)符合2015年国际视神经脊髓炎谱系疾病诊断共识[1];(3)接受腰椎穿刺检查;(4)近4周未使用过激素或免疫抑制剂;(5)患者知情同意;(6)无其他自身免疫性疾病史。排除标准:(1)其他中枢神经系统脱髓鞘疾病:如多发性硬化、临床孤立综合征、副肿瘤综合征、炎性假瘤等;(2)合并其他神经系统疾病:如脑血管病、神经系统变性疾病、肿瘤、中毒等;(3)合并心、肝、肾等重要脏器损害疾病;(4)CNS创伤或手术史者;(5)妊娠期及哺乳期女性;(6)伴有其他免疫疾病、炎症、恶性肿瘤等患者;(7)精神疾病患者。
1.3 方法 (1)评估临床资料。患者入院后即评估临床资料,包括患者的年龄、性别、此次发病的诱发因素如呼吸道感染或消化道感染等,记录患者临床症状包括视力障碍、肢体无力、躯体麻木及二便功能障碍等,完善头颅和脊髓MRI检查,阅片并判断CNS磁共振病灶部位及有无强化、新发脊髓受累节段数。(2)IL-10及AQP4抗体检测方法。清晨6:00空腹采集NMOSD组及HCs组外周静脉血3 mL,离心分离后血清全部于-80 ℃冰箱保存。所有标本收集完成后,同一时间使用联科生物技术有限公司提供的人IL-10酶联免疫吸附法(ELISA)试剂盒检测血清中IL-10水平;所有操作步骤均按试剂盒操作步骤进行检测。间接免疫荧光法定性检测血清AQP4抗体(用以指导NMOSD亚组分组:AQP4(+)组及AQP4(-)组2个亚组)。
1.4 观察指标 (1)比较急性期NMOSD患者与健康对照组之间、AQP4(+)组与AQP4(-)组2个亚组之间血清IL-10水平表达的差异;(2)比较急性期NMOSD患者2个亚组之间诱发因素、临床症状、脊髓受累节段、(视觉诱发电位)VEP异常方面有无差异;(2)采用扩展残疾状况量表(EDSS)评估患者肢体的伤残程度和疾病的严重程度,分别由2位高年资神经内科主治医师独立完成并校对,EDSS评分范围0~10分,评分越高表明神经功能缺损症状越严重。针对IL-10表达水平与扩展残疾状况量表(EDSS)评分进行相关性分析。

2 结果
2.1 AQP4(+)组与AQP4(-)组2个亚组临床资料比较 2个亚组患者在脊髓受累节段方面比较差异有统计学意义(P<0.05),在诱发因素、临床症状、VEP异常方面比较差异无统计学意义(P>0.05)。见表1。
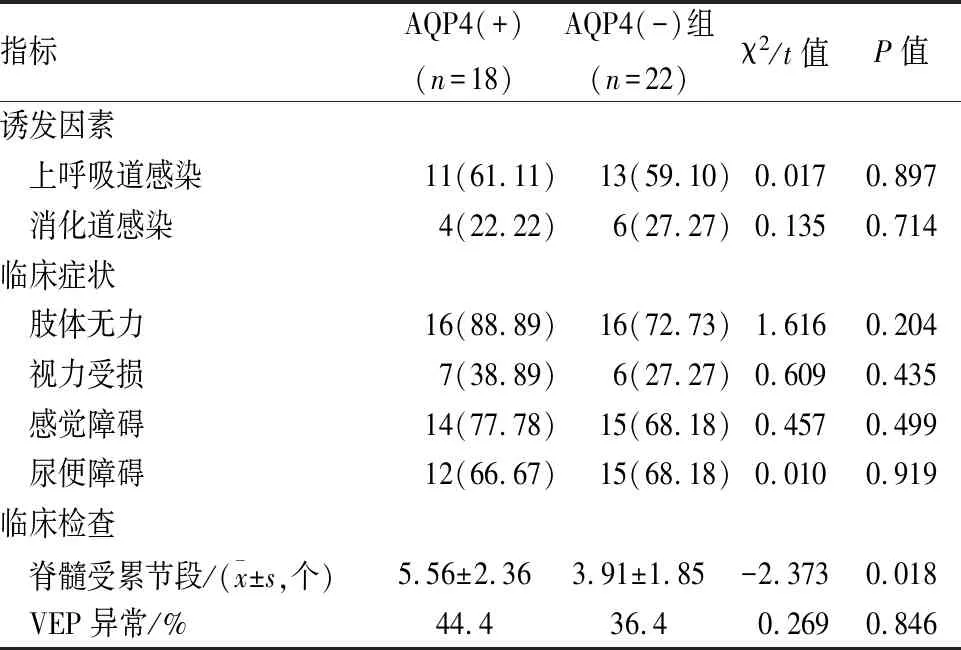
表1 AQP4(+)组与AQP4(-)组2个亚组临床资料比较
2.2 急性期NMOSD患者与健康对照组IL-10表达水平比较 急性期NMOSD组患者IL-10表达水平明显高于健康对照组,差异有统计学意义(P<0.05)。见表2。
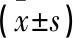
表2 急性期NMOSD患者与健康对照组IL-10表达水平比较
2.3 AQP4(+)和AQP4(-)2个亚组患者IL-10表达水平比较 AQP4(+)和AQP4(-)2个亚组IL-10表达水平比较,差异无统计学意义(P>0.05)。见表3。
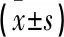
表3 AQP4(+)和AQP4(-)2个亚组患者IL-10表达水平比较
2.4 急性期NMOSD患者IL-10表达水平与EDSS评分的相关性 所有急性期NMOSD患者EDSS评分均由2名高年资神经内科主治医师独立评估完成并校对,40例急性期NMOSD患者外周血IL-10表达水平与EDSS评分均呈负相关(r=-0.360,P=0.023)。见图1。
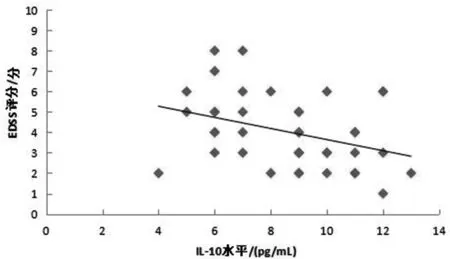
图1 急性期NMOSD患者IL-10表达水平与 EDSS 评分的相关性
3 讨论
视神经脊髓炎谱系病(NMOSD)是一种较为罕见的中枢神经系统自身免疫性炎性疾病,往往合并有其他自身免疫性疾病如类风湿关节炎、自身免疫性甲状腺炎、干燥综合征、系统性红斑狼疮及自身免疫性血小板减少症等[4-5]。AQP4-IgG作为其致病性抗体,可通过释放多种炎症因子如T细胞、巨噬细胞等诱发炎症反应,导致星形胶质细胞的破坏和功能障碍、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)丢失,并伴有继发性脱髓鞘,形成NMOSD的主要病理改变[6-7]。70%~80%的NMOSD患者可检测出AQP4-IgG阳性,AQP4-IgG阳性与高复发率及受损脊髓节段长度呈正相关[8]。本研究中AQP4(+)组患者累及的脊髓节段数更多、影像学表现更为严重。
Banko等[9]研究表明调节性B细胞(regulatory B cell,Breg)在NMOSD急性期起重要作用,其中IL-10被认为是鉴定Breg的特征性标志。IL-10是一种经典的免疫抑制分子,具有多细胞来源性,在外周系统,由调节性B细胞、调节性T细胞和Th1,Th2,Th17等细胞分泌;而在中枢神经系统中,IL-10则由神经元细胞和小胶质细胞、星形胶质细胞等分泌表达。IL-10作为一种抗炎细胞因子,在控制过度炎症和下调免疫反应方面发挥着至关重要的作用。本研究结果显示,急性期AQP4(+)组及AQP4(-)组NMOSD患者外周血IL-10较健康对照组明显升高,差异具有统计学意义。AQP4(+)组与AQP4(-)组亚组间外周血IL-10差异无统计学意义,与Clarice等[10]研究结果相一致。且急性期NMOSD患者IL-10表达水平与EDSS评分呈负相关性,这提示IL-10可能参与了NMOSD的病程发展及转归,并可能在其中起到一定的保护性作用。但目前机理尚不明确,考虑IL-10在NMOSD急性期的抗炎作用可能与以下机制有关:IL-10通过诱导Th0向Th2发育,增强了Th2的极化,同时抑制Th1转化,导致Th1/Th2失衡。通过抑制Thl、Th2介导的免疫应答,减少其分泌相应的炎性因子,从而阻止抗原提呈。IL-10通过抑制促炎因子IL-2,IL-3,TNF-α及IFN-γ等的产生,抑制Th1的反应,通过抑制致病性Th1/Th17细胞的表达,阻止疾病的发展[11]。此外,B细胞可通过分泌IL-10抑制巨噬细胞的活化并影响其迁移,M2极化的小胶质细胞可增强Breg细胞的比例,促进IL-10的生成,以保护机体免受过度活跃炎症反应[12]。同时,IL-10激活PI3K/Akt/Caspase-3通路,上调Bcl-2及Bcl-xl等抗凋亡基因的表达,促使小胶质细胞向M2型极化,增强精氨酸酶1、肝素结合凝集素等抗炎因子的表达,加速坏死组织的清除,并促进损伤神经元修复[13]。Khorooshi等[14]在研究中发现IL-10还可介导血管紧张素2受体(angiotensin-2 receptor,AT2R)兴奋剂C21对NMOSD大鼠模型起到治疗效果。然而,Eun等[15]研究却发现,急性期NMOSD患者IL-10水平较健康对照组明显升高,且升高水平与AQP4抗体滴度呈正相关,提示IL-10水平与疾病活动相关,似与其他研究结果相背,具体机制有待进一步阐明。
本研究结果表明,急性期NMOSD患者外周血IL-10水平越低,患者EDSS评分越高,肢体伤残程度越严重,两者之间存在线性相关且呈负相关性,提示IL-10可能参与了NMOSD的免疫调节和疾病的发展,具体机制及相关调节通路有待于进一步研究。限于本研究样本量较少,此结论尚需大样本、前瞻性队列研究进一步证实。尽管IL-10在除NMOSD以外的多种免疫性疾病中均有降低,对于疾病的诊断缺乏特异性,但本研究结果提示外周血IL-10水平可作为NMOSD患者发生肢体瘫痪和致残的预测因素,可作为病情评估及判断疾病预后的生物标志物运用到临床实践中。

