阴道微生态与高危型人乳头瘤病毒感染及宫颈病变的相关性
张俊娣 刘兆华 李云芳
宫颈癌是女性最常见的恶性肿瘤之一,高危型人乳头瘤病毒(high risk-human papillomavirus,HR-HPV)的持续感染已被公认为是宫颈上皮内瘤变和宫颈癌的重要原因[1]。阴道微生态由阴道解剖结构、阴道微生物群、局部免疫机制及内分泌调节等共同构成的复杂体系。阴道微生态受性活动、吸烟、激素水平、不良卫生习惯等多方面影响,当机体免疫力下降时导致阴道内乳酸杆菌功能下降,导致阴道微生态失衡。在阴道局部解剖结构中,宫颈与阴道结构毗邻,近年来相关研究显示阴道微生态失衡在一定程度上会影响宫颈微环境,除自身免疫系统异常可能是导致HR-HPV感染的原因外,阴道微生态异常也可能导致HR-HPV感染率增加[2-4]。宫颈癌的发生与HPV息息相关,病毒株和持续性、病毒载量和癌基因表达等都影响宫颈病变的发生。其他风险因素,如吸烟、使用口服避孕药、多伴、性活动过早以及与其他微生物的共同感染,也与宫颈癌发生密切相关[5]。因此,本研究对阴道微生态与HR-HPV感染及宫颈病变的相关性进行探讨。
1 资料与方法
1.1 一般资料 收集2019年1~6月在廊坊市人民医院妇科门诊同时行阴道微生态和HR-HPV检测及液基细胞学(thinprep cytologic test,TCT)的患者1 269例。
1.2 入选标准 (1)年龄20~45岁;(2)72 h内无性生活、局部用药、冲洗阴道;(3)既往无宫颈上皮内瘤变及宫颈癌病史。
1.3 方法
1.3.1 阴道微生态检测:用无菌棉拭子在阴道侧壁上1/3处采集阴道分泌物送检。采用阴道微生态检测试剂盒(江苏硕士生物科技股份有限公司)进行阴道微生态功能学指标检测。通过形态学检测及功能学检测进行诊断。如阴道pH值在3.8~4.5,菌群密集度Ⅱ~Ⅲ度、多样性Ⅱ~Ⅲ度,优势菌为乳酸杆菌,未检出滴虫、假菌丝、芽生孢子,特异性酶阴性诊断为阴道微生态正常,形态学检测和功能学检测指标任何一项异常诊断为阴道微生态失衡。
1.3.2 HPV检测:用棉拭子将宫颈过多的分泌物擦去,采用专用HPV采样刷,将采样刷置于宫颈口,轻轻搓动采样刷使其顺时针旋转3~5圈,取出采样刷,将其放入装有细胞保存液的样本管中送检。采用潮州凯普生物化学有限公司生产的检测试剂盒进行检测,操作及检验结果判定参照试剂盒说明书。对样本HR-HPV DNA的分型定性检测。
1.3.3 TCT检测:将宫颈表面分泌物拭净,将专用的“宫颈刷”置于宫颈管内,在宫颈转化区或宫颈口或有可疑病变部位,同一方向适当力度旋转5圈左右,旋转“宫颈刷”将附着于小刷子上的标本洗脱于保存液中。根据TBS(The Bethesda System)命名系统,读取结果时描述样本有无感染、反应性和修复性改变、上皮细胞异常及其他恶性肿瘤。宫颈细胞呈良性细胞改变诊为正常,宫颈细胞呈不典型细胞改变及以上或恶性改变诊为病变。
1.4 统计学分析 应用SPSS 20.0统计软件,计数资料以例数或百分率表示,采用χ2检验。通过logistic回归分析找到不同阴道微生态失衡类型对HPV感染及宫颈病变的影响,P<0.05为差异有统计学意义。
2 结果
2.1 2组间阴道微生态失衡发生率比较 HR-HPV组阴道微生态失衡发生率高于非HR-HPV组,差异有统计学意义(P<0.05),宫颈病变组阴道微生态失衡发生率高于宫颈正常组,但差异无统计学意义(P>0.05)。见表1。
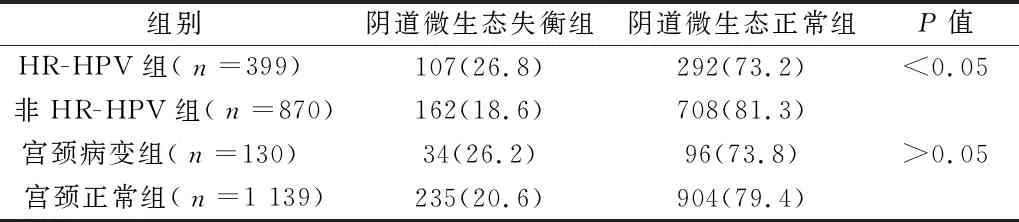
表1 2组间阴道微生态失衡发生率比较 例(%)
2.2 2组间阴道菌群阳性率比较 HR-HPV组细菌性阴道病(BV)、滴虫性阴道炎(TV)均高于非HR-HPV组(P<0.05),2组外阴阴道假丝酵母菌病(VVC)阳性率比较,差异无统计学意义(P>0.05)。宫颈病变组BV阳性率高于宫颈正常组,差异有统计学意义(P<0.05);TV、VVC阳性率均高于宫颈正常组,但差异无统计学意义(P>0.05)。见表2。

表2 阴道菌群阳性率比较 例(%)
2.3 阴道微生态异常对HPV及宫颈病变影响的多因素logistic回归分析 BV是影响HPV感染的危险因素[OR=1.55,95%CI(1.07,2.23),P<0.05],也是影响宫颈病变的危险因素[OR=2.45,95%CI (1.54,3.91),P<0.05]。TV与VVC对HPV感染和宫颈病变的影响均无相关性(P>0.05)。见表3。

表3 logistic回归分析
3 讨论
阴道正常的微生物菌落通过保持动态平衡从而达到对致病微生物的防御作用。当机体免疫力低下时,阴道微生态失衡,打破阴道酸性环境,对其他微生物的抑制作用下降,外源性及内源性致病菌沉积在阴道内定居、繁殖,增加了HR-HPV感染的可能性,也在一定程度上导致了阴道上皮组织病变的发生。有研究发现,阴道菌群异常可能会增加女性HR-HPV感染的风险[6],Lee等[7]的研究发现,HR-HPV阳性患者的阴道菌群多样性增加,且阴道乳酸杆菌减少。本研究结果显示阴道微生态失衡患者HR-HPV感染率明显升高,与上述研究结果一致,说明阴道微生态与感染HR-HPV间存在相关性。
在阴道微生态失衡中的菌群紊乱可导致阴道炎的发生,BV、TV、VVC是妇科常见阴道炎症,不同阴道炎与HR-HPV感染的关系的研究比较多。
BV是最常见的阴道炎,主要是加德纳菌混合其他一些厌氧菌感染所诱发,Mongelos等[8]研究发现BV可导致HR-HPV感染的易感性增加,Lewis等[9,10]的一项研究认为与BV有关的厌氧菌导致患者感染HPV的风险明显增加。陈平莲等[11]的一项回顾性分析显示,BV患者HPV发病率高于阴道微生态正常者,差异有统计学意义(P<0.05)。本研究结果显示,HR-HPV感染组BV感染率高于非HR-HPV组,差异有统计学意义(P<0.05),与上述研究结果一致。
TV主要通过性接触传播,并影响患者的泌尿生殖系统。TV与HPV感染的关系仍尚无一致定论。李新敏等[12]通过对同时进行阴道微生态和宫颈HPV检测的1 529例患者的资料分析显示,滴虫感染能增加HPV感染,但与HPV相关性宫颈病变关系不密切。Lazecby等[13]学者研究表明TV导致宫颈局部防御功能下降,增加HPV感染的风险。而孟龄婷等[14,15]认为TV与HPV感染之间不存在相关性。本研究结果显示,HR-HPV感染组TV感染率高于非HR-HPV组,差异有统计学意义(P<0.05),但因TV的样本量较少,需要进行大样本、多中心的病例对照研究。
VVC病是由条件致病菌白色念珠菌大量繁殖引起,被认为与长期应用抗生素、糖尿病、雌激素的应用等有关。它引起的阴道微生态改变与HPV感染是否存在相关性尚存在争议。一项包括2 960例女性的回顾性研究发现VVC患者HPV感染率增加,认为VVC是HPV感染的独立危险因素[16]。还有学者观点认为VVC可增加宫颈上皮内瘤变的发生风险,认为VVC与HR-HPV感染存在一定相关性[17]。另有学者持不同观点,他们认为VVC不增加HPV感染率[18,19]。本研究结果显示,HR-HPV感染组VVC感染率高于非HR-HPV组,但差异无统计学意义(P>0.05),这可能是因为样本量较少的缘故。
HPV是宫颈癌发生的重要病原体,部分被HPV感染的女性宫颈上皮内瘤变和宫颈癌的发生率明显升高。而与微生物共感染可能会使得 HPV 相关致癌作用,包括 HPV 复制和转录的修饰等的风险进一步增加[20]。此外,合并感染会加剧炎症和对作为 HPV 感染屏障的上皮细胞的损伤[21]。持续性 HPV 感染与阴道微生物群失衡有关,尤其是产乳酸菌减少。在阴道菌群缺乏乳酸菌的情况下,BV的风险增加,可能上调粘蛋白降解酶的产生,同时下调H2O2的产生,从而影响细胞因子的产生以及宫颈黏膜屏障的易感性[22]。研究宫颈炎症和细菌性阴道病的宫颈阴道微生物群的变化有助于发现宫颈高级别病变中 HPV 感染的进展[23]。
有研究发现与正常女性相比,患有宫颈上皮内瘤变和宫颈癌的女性阴道微生物群的多样性更高,宫颈疾病女性中乳酸杆菌种类的比例降低,而宫颈上皮内瘤变和宫颈癌女性中卷曲乳杆菌的丰度显着降低[24]。低丰度的乳酸杆菌属以 77.4% 的概率增加宫颈上皮内瘤变或宫颈癌的风险[25],据报道,与卷曲乳杆菌主导的阴道微生物菌群类型相比,低乳酸杆菌主导的阴道微生物菌群类型发生宫颈上皮内瘤变或宫颈癌的风险高出2~3倍[26],乳酸杆菌作为优势菌群的丧失促进了厌氧菌的定植,微生物多样性增加,并增加了宫颈阴道疾病的风险[27]。
本研究发现宫颈病变组BV阳性率增高,BV是影响宫颈病变的危险因素,这与上述研究结果结论一致。但本研究未发现其他菌群类型对宫颈病变的影响,这可能与宫颈病变组样本量较低有关,还需要大样本临床试验研究证实。
综上所述,阴道微生态失常可能会增加HR-HPV感染率及宫颈病变患病率。BV、TV可能导致HR-HPV感染率增加,其中BV是影响HR-HPV感染的危险因素,也是影响宫颈病变的危险因素。

