circ_0003645靶向miR-578调控胶质瘤U251细胞增殖、迁移和侵袭的分子机制研究
潘彦波 张春雷 马俊 王昶
恶性胶质瘤是临床常见的难治性中枢神经系统肿瘤,其恶性程度高、难治愈,目前靶向治疗可延长使患者的中位无进展生存期及中位总生存期[1,2]。因此,研究胶质瘤的分子机制,开发新的靶点以对胶质瘤的靶向治疗具有重要意义。研究表明,circRNA在肿瘤发生和转移中起重要作用,可抑制肿瘤发生,并可用作治疗靶标[3]。研究报道乳腺癌组织和细胞系中circ_0003645的表达明显增加,circ_0003645通过调节miR-139-3p/HMGB1轴促进乳腺癌的进展[4]。非小细胞肺癌患者组织中circ_0003645的过度表达与晚期TNM分期,阳性淋巴结浸润和不良预后有关;干扰circ_0003645表达可抑制非小细胞肺癌细胞的恶性生物学行为[5]。然而circ_0003645在胶质瘤中的作用,其对胶质瘤U251细胞增殖、迁移和侵袭的影响及机制尚不清楚。研究报道miR-578上调可抑制胶质瘤细胞增殖,促进细胞凋亡[6]。在线生物学软件预测发现circ_0003645与miR-578有结合位点,但circ_0003645与miR-578的关系及circ_0003645调控miR-578影响胶质瘤进展尚不清楚。本实验旨在研究circ_0003645对胶质瘤U251细胞增殖、迁移和侵袭的影响及机制是否与miR-578有关。
1 材料与方法
1.1 试验材料 选取2017年1月至2020年12月我院病理科存档且已确诊脑胶质瘤的组织标本35例,其中男18例,女17例;年龄18~72岁,平均(39.7±2.1)岁。通过内减压术获得正常脑组织标本35例作为对照,其中男19例,女16例;年龄18~56岁,平均(37.4±1.2)岁。所有患者术前无放化疗史。患者均知情且同意。
1.2 细胞与主要试剂 胶质瘤细胞株U251购自美国ATCC;RPMI-1640培养基购自美国Gibco公司;Trizol试剂、荧光定量试剂盒购自美国Progema公司;细胞计数试剂盒8(CCK-8)购自南京赛泓瑞生物科技有限公司;Transwell小室、Matrigel购自美国BD公司;蛋白提取试剂盒购自上海振誉生物科技有限公司;双荧光素酶报告基因检测试剂盒购自美国AAT Bioquest公司。
1.3 细胞转染与分组 胶质瘤细胞株U251用RPMI-1640培养基培养,将circ_0003645干扰表达载体质粒及阴性对照、miR-578模拟物及阴性对照转染至U251细胞中,记为si-circ_0003645组、si-NC组、miR-578组、miR-NC组;将circ_0003645干扰表达载体质粒分别与miR-578抑制剂及阴性对照转染至U251细胞中,记为si-circ_0003645+anti-miR-578组、si-circ_0003645+anti-miR-NC组。
1.4 实时荧光定量PCR(qRT-PCR)检测circ_0003645和miR-578的表达水平 提取胶质瘤组织、正常脑组织及各组细胞的总RNA,反转录成cDNA,以GAPDH和U6为内参进行PCR,相对表达量用2-ΔΔCt法计算。
1.5 CCK-8检测细胞活性 各组细胞培养48 h,按试剂盒说明加入 CCK-8试剂,培养2 h,用酶标仪检测450 nm处的吸光度值(OD)。
1.6 克隆形成实验检测细胞克隆形成数 将细胞制成1×104个/ml细胞悬液,以每孔200个细胞接种于6孔板,培养2周后用PBS清洗细胞,用甲醇固定细胞,用吉姆萨染色30 min,在光学显微镜下计数>50个细胞的集落。
1.7 划痕实验检测细胞划痕愈合率 各组细胞消化后接种于培养板,过夜细胞铺满后用枪头直线划痕,用PBS冲洗划下的细胞,换液后继续培养,在培养0 h和48 h后拍照观察,用Image-Pro Plus6.0软件计算划痕愈合率。
1.8 Transwell检测侵袭细胞数 Transwell小室上室加入100 μl稀释好的Matrigel,凝固后加100 μl细胞悬液,下室加500 μl含血清培养液,培养24 h,用0.1%结晶紫染色30 min,棉签擦拭掉上层未穿过基底膜的细胞,光学显微镜(×200)下随机选择5个视野,拍照并计数。
1.9 蛋白质印迹(Western blot)法检测蛋白表达 提取细胞总蛋白,取50 μl蛋白进行SDS-PAGE电泳,转至PVDF膜,用封闭液将膜封闭,将封闭后的膜置于含有一抗的杂交袋中置于4℃冰箱中过夜,然后经膜置于含有二抗的杂交袋中在室温下孵育1 h,显影、定影后用Image J分析蛋白条带灰度值,计算蛋白表达水平。
1.10 双荧光素酶报告实验 将circ_0003645的野生型和突变型荧光素酶载体分别与miR-NC或miR-578共转染至U251细胞,按试剂盒说明检测U251细胞的荧光素酶活性。将pcDNA、pcDNA-circ_0003645、si-NC、si-circ_0003645转染至U251细胞,采用qRT-PCR检测miR-578的表达水平。

2 结果
2.1 circ_0003645和miR-578在胶质瘤组织中的表达 胶质瘤组织中circ_0003645表达水平高于正常脑组织,而miR-578表达水平低于正常脑组织(P<0.05)。见表1。

表1 circ_0003645和miR-578在胶质瘤组织中的表达
2.2 干扰circ_0003645表达对胶质瘤U251细胞增殖、迁移和侵袭的影响 与si-NC组比较,si-circ_0003645组circ_0003645表达水平降低,细胞活性降低,细胞克隆形成数减少,划痕愈合率降低,侵袭细胞数减少,E-cadherin表达水平升高,N-cadherin表达水平降低(P<0.05)。见图1,表2。

图1 干扰circ_0003645表达后迁移侵袭相关蛋白的表达

表2 干扰circ_0003645表达对胶质瘤U251细胞增殖、迁移和侵袭的影响
2.3 miR-578过表达对胶质瘤U251细胞增殖、迁移和侵袭的影响 过表达miR-578后,miR-578表达水平升高,U251细胞的活性降低,细胞克隆形成数减少,划痕愈合率降低,侵袭细胞数减少,E-cadherin表达水平升高,N-cadherin表达水平降低(P<0.05)。见表3,图2。

表3 miR-578过表达对胶质瘤U251细胞增殖、迁移和侵袭的影响

图2 miR-578过表达后迁移侵袭相关蛋白表达
2.4 circ_0003645靶向调控miR-578的表达 Circular RNA Interactome预测显示circ_0003645与miR-578含有互补的核苷酸序列。WT-circ_0003645与miR-578共转染的U251细胞荧光素酶活性降低(P<0.05);过表达circ_0003645后,miR-578表达水平降低;抑制circ_0003645表达后,miR-578表达水平升高(P<0.05)。见表4、5,图3。

表4 circ_0003645野生型与突变型载体与miR-578或miR-NC共转染后的细胞荧光素酶活性

表5 circ_0003645调控miR-578的表达
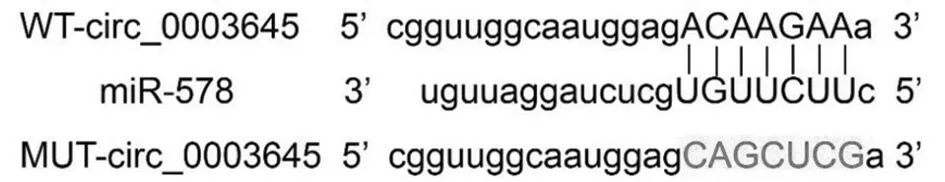
图3 circ_0003645的序列中含有与miR-578互补的核苷酸序列
2.5 下调miR-578表达逆转了干扰circ_0003645表达对胶质瘤U251细胞增殖、迁移和侵袭的作用 与si-circ_0003645+anti-miR-NC组比较,si-circ_0003645+anti-miR-578组miR-578表达水平降低,细胞活性升高,细胞克隆形成数增加,划痕愈合率升高,侵袭细胞数增加,E-cadherin表达水平降低,N-cadherin表达水平升高,组间差异均有统计学意义(P<0.05)。见表6,图4。

表6 下调miR-578表达逆转了干扰circ_0003645表达对胶质瘤U251细胞增殖、迁移和侵袭的作用

图4 迁移侵袭相关蛋白表达
3 讨论
胶质瘤是恶性脑肿瘤的最常见类型,分子靶向治疗可能是治疗胶质瘤的一种新颖策略[7,8]。研究表明多种circRNA参与调控胶质瘤的恶性生物学行为[9]。研究报道CircNFIX通过调节miR-378e/RPN2轴促进神经胶质瘤的进展[10]。Circ_0005075通过下调SIRT1刺激神经胶质瘤的增殖和转移[11]。circ_0008225通过使miR-890海绵化并促进ZMYND11表达来抑制神经胶质瘤的发生[12]。
本实验结果显示,胶质瘤组织中circ_0003645表达水平升高,提示circ_0003645可能在胶质瘤中起促癌作用。干扰circ_0003645表达后,U251细胞活性及划痕愈合率降低,细胞克隆形成数及侵袭细胞数减少,E-cadherin表达水平升高,N-cadherin表达水平降低;表明扰circ_0003645表达抑制了U251细胞的增殖、迁移和侵袭。
研究报道miR-578过表达可抑制乳腺癌细胞活力,集落形成,迁移,侵袭,并促进细胞凋亡[13]。本实验结果显示,胶质瘤组织中miR-578表达水平降低;过表达miR-578可降低U251细胞活性及划痕愈合率,减少细胞克隆形成数及侵袭细胞数。此外,研究报道circ_001621通过使miR-578海绵化并调节VEGF表达来促进骨肉瘤细胞增殖和迁移[14]。circ_0005785上调通过miR-578/APRIL轴促进肝癌细胞的细胞生长和转移[15]。说明circRNA可通过调控miR-578影响肿瘤进展。本实验发现circ_0003645可靶向调控miR-578的表达;而下调miR-578表达逆转了干扰circ_0003645表达对胶质瘤U251细胞增殖、迁移和侵袭的作用。
综上所述,干扰circ_0003645表达通过靶向上调miR-578抑制胶质瘤U251细胞增殖、迁移和侵袭。

