乳疾清合剂的质量标准提高研究*
梁欣健,姜倩娥,王叶茗
1 广州市中西医结合医院,广东 广州 510801;2 广州市天河区中医医院
乳疾清合剂是广州市中西医结合医院的医疗机构制剂,由延胡索、玄参、青皮、半夏、石菖蒲、鸡内金、全蝎、荠苨等25 味中药组成[1],具有行气活血、化痰散结的作用,临床主要用于治疗乳腺增生、乳腺肿瘤等乳腺囊性增生性疾病[2]。
乳疾清合剂已有近二十年的使用历史,由治疗乳腺增生疾病的民间经验方“宝丹化积方”开发而成,但乳疾清合剂现行的质量标准缺乏有效的质量控制指标,为提高乳疾清合剂的质量控制要求,课题组开展了乳疾清合剂的质量标准提高研究工作,建立采用薄层色谱鉴定法研究乳疾清合剂的定性鉴别方法,参考《中华人民共和国药典》2015 年版四部通则中的微生物限度检查方法进行验证性考察,并建立微生物限度检查方法,现报道如下。
1 材料
1.1 仪器SW-CJ 型系列洁净工作台(苏州安泰空气技术有限公司);RS-232 型精密电子天平[西特传感技术(天津)有限公司];HPX-9162 MBE 型数显电热培养箱(上海海迅实业有限公司医疗设备厂);ZRH-150B 型生化培养箱(广东省医疗器械厂);LRH-150-M 型霉菌培养箱(广东省医疗器械厂);立式压力蒸汽灭菌器(上海博迅实业有限公司医疗设备厂);PYX-DHS-35 型电热恒温水浴锅(上海跃进医疗器械厂);KQ-100DE 型数控超声波清洗器(昆山市超声仪器有限公司);RE-2000A 型旋转蒸发仪(上海左乐仪器有限公司)。
1.2 试药乳疾清合剂(广州市中西医结合医院制剂室,批号:160501,160502,160503);延胡索对照药材(批号:120928-201208)、延胡索乙素对照品(批号:110726-201213)、玄参对照药材(批号:121008-201308)、法半夏对照药材(批号:121172-201103)及青皮对照药材(批号:121155-200502)均购自中国食品药品检定研究院;金黄色葡萄球菌[批号:CMCC(B)26003]、铜绿假单胞菌[批号:CMCC(B)10104]、枯草芽孢杆菌[批号:CMCC(B)63501]、白色念珠菌[批号:CMCC(B)98001]、黑曲霉[批号:CMCC(B)98003]、大肠埃希菌[批号:CMCC(B)44102]、沙门菌[批号:CMCC(B)50094]均购自中国药品食品检定研究院。硅胶G 薄层层析板、硅胶GF254 薄层层析板购自青岛海洋化工有限公司;胰酪大豆胨琼脂培养基(批号:20160621)、胰酪大豆胨液体培养基(批号:20160702)、麦康凯琼脂培养基(批号:20160708)、麦康凯液体培养基(批号:20160624)、沙氏葡萄糖液体培养基(批号:20160711)、沙氏葡萄糖琼脂培养基(批号:20160224)、RV 沙门菌增菌液体培养基(批号:20160405)、木糖赖氨酸脱氧胆酸盐琼脂培养基(批号:20160408)、无菌氯化钠-蛋白胨缓冲液(批号:20160316)均购自青岛海博生物技术有限公司;聚山梨酯-80(批号:20160503)购自湖南尔康制药有限公司,浓氨水、乙醚、甲醇、甲苯、丙酮、正丁醇、三氯甲烷、香草醛、硫酸、乙酸乙酯、甲酸为分析纯,购自广州化学试剂厂,水为制剂生产用纯化水。
2 方法和结果
2.1 薄层鉴别
2.1.1 延胡索取乳疾清合剂60 mL,加浓氨水将其pH值调至11,加乙醚提取2次,每次30 mL,合并乙醚液,置水浴锅蒸干,残渣加甲醇2 mL 使溶解,作为供试品溶液。另取延胡索对照药材1 g,加甲醇50 mL,超声处理30 min,滤过,滤液蒸干,残渣加水10 mL 使溶解,加浓氨水将其pH 值调至11,用乙醚振摇提取3 次,每次10 mL,合并乙醚液,蒸干,残渣加甲醇1 mL 使溶解,制成延胡索对照药材溶液。再取延胡索乙素对照品,加甲醇制成每毫升含0.5 mg 的溶液,作为对照品溶液。吸取上述3种溶液各2 μL,分别点于同一硅胶G薄层板上,以甲苯-丙酮(9∶2)为展开剂,展开,取出,晾干,置紫外光灯(365 nm)下检视。供试品色谱中在与对照药材及对照品色谱相应的位置上显相同颜色的荧光斑点,阴性对照样品无干扰,见图1。
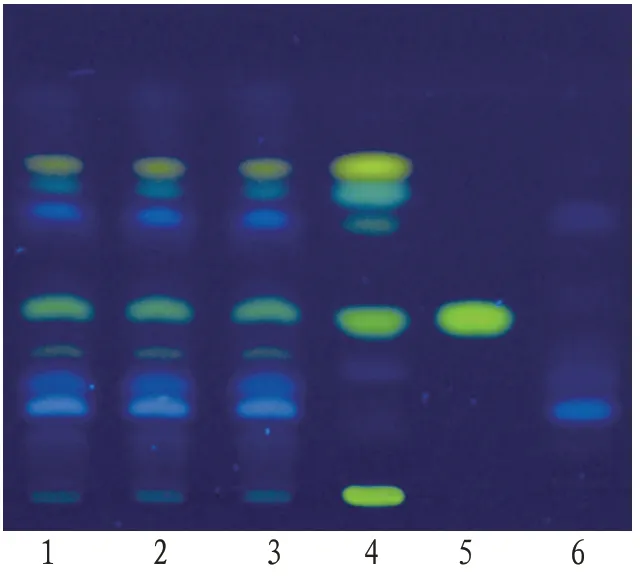
图1 乳疾清合剂延胡索在紫外光(365 nm)下的薄层色谱图
2.1.2 玄参取乳疾清合剂80 mL,加水饱和的正丁醇溶液振摇提取2 次,每次30 mL,合并正丁醇液,续用氨水洗涤2 次,每次20 mL,合并正丁醇部分的溶液,用正丁醇饱和的水溶液洗涤2 次,每次20 mL,合并正丁醇部分的溶液并置水浴锅蒸干,残渣加甲醇2 mL使溶解,作为供试品溶液。另取玄参对照药材1 g,加水饱和的正丁醇溶液20 mL,超声处理20 min,滤过,滤液用氨试液洗涤2 次,每次20 mL,合并正丁醇部分的溶液,用正丁醇饱和的水洗涤2 次,每次20 mL,合并正丁醇部分的溶液并置水浴锅蒸干,残渣加甲醇2 mL使溶解,作为玄参对照药材溶液。吸取上述两种溶液各2 μL,分别点于同一硅胶G 薄层板上,以三氯甲烷-甲醇(6∶1)为展开剂,展开,取出,晾干,喷以5%香草醛硫酸溶液,在105℃加热至斑点显色清晰,置日光下检视。供试品色谱中在与对照药材色谱相应的位置上显相同颜色的斑点,阴性对照样品无干扰,见图2。

图2 乳疾清合剂玄参在日光下薄层色谱图
2.1.3 青皮取“2.1.2”项下供试品溶液作为本项的供试品溶液。另取青皮对照药材0.3 g,加水饱和的正丁醇溶液20 mL,超声处理20 min,滤过,滤液用氨试液洗涤2 次,每次20 mL,合并正丁醇部分的溶液,用正丁醇饱和的水溶液洗涤2 次,每次20 mL,合并正丁醇部分的溶液并置水浴锅蒸干,残渣加甲醇2 mL使溶解,作为青皮对照药材溶液。吸取上述两种溶液各5 μL,分别点于同一硅胶G 薄层板上,以乙酸乙酯-甲醇-水(100∶17∶13)为展开剂,展至约3 cm,取出,晾干,再以甲苯-乙酸乙酯-甲酸-水(20∶10∶1∶1)的上层溶液为展开剂,展至约8 cm,取出,晾干,置紫外光灯(365 nm)下检视。供试品色谱中在与对照药材色谱相应的位置上显相同颜色的荧光斑点,见图3。
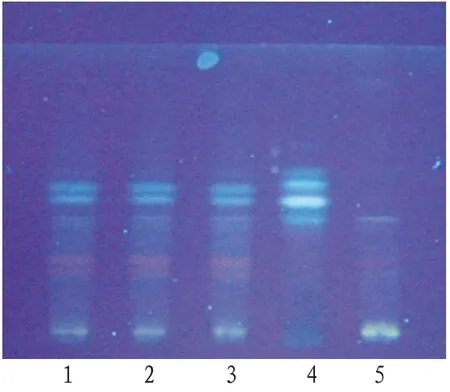
图3 乳疾清合剂青皮在紫外光(365 nm)下薄层色谱图
2.2 微生物限度检查
2.2.1 菌液制备参照《中华人民共和国药典》2015 年版四部通则中关于微生物限度检查方法,分别将金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌、沙门氏菌和枯草芽孢杆菌接种至胰酪大豆胨液体培养基上,在30~35℃下培养18~24 h,然后用pH 为7.0 无菌氯化钠-蛋白胨缓冲液将上述细菌培养液配制成适宜浓度的菌悬液。将黑曲霉接种至沙氏葡萄糖液体培养基,20~25℃培养5~7天,然后取3~5 mL 预先配好的含有0.05%聚山梨酯80的0.9%无菌氯化钠溶液,其中加入黑曲霉培养液,将孢子洗脱,吸出孢子菌液至灭菌试管内,制成适宜浓度的黑曲霉孢子悬液。将白色念珠菌接种至沙氏葡萄糖液体培养基,20~25℃下培养2~3天,然后将白色念珠菌培养液加入到0.9%无菌氯化钠溶液中,制成适宜浓度的菌悬液。
2.2.2 供试品溶液制备以乳疾清合剂作为供试液。
2.2.3 需氧菌总数、霉菌及酵母菌总数计数
2.2.3.1 对照组菌落数 取供试品溶液1 mL 注入平皿中,倾注加入培养基,待凝结后按照预设定的条件进行培养,计算对照组计数菌落数(A)。
2.2.3.2 试验组菌落数 取1 mL供试品溶液,分别加入小于100 CFU的铜绿假单胞菌、金黄色葡萄球菌、枯草芽孢杆菌菌液、白色念珠菌和黑曲霉菌菌液,混匀后在其中倾注加入培养基,待凝结后,按照预设定的条件进行培养,计算试验组菌落数(B)。
2.2.3.3 菌液组 分别取小于100 CFU的铜绿假单胞菌、金黄色葡萄球菌、枯草芽孢杆菌菌液、白色念珠菌和黑曲霉菌菌液直接注入培养皿中,然后倾注加入培养基,待凝结后,按照预设定的条件进行培养,计算菌液组菌落数(C)。
2.2.3.4 回收试验 3 批乳疾清合剂的回收试验结果表明试验组菌落数减去供试品对照组菌落数的值与菌液组菌落数的比值均在0.5~2 范围内,符合有关规定,见表1。

表1 乳疾清合剂的需氧菌总数、霉菌及酵母菌总数计数方法验证的回收试验比值
2.2.4 控制菌检查由于乳疾清合剂的处方中含有鸡内金、全蝎等动物组织,按照《中华人民共和国药典》2015 年版相关规定,控制菌检查需要检查大肠埃希菌和沙门菌。
2.2.4.1 大肠埃希菌检查 1)供试液组:取“2.2.2”项下供试品溶液10 mL,加入pH 为7.0 的无菌氯化钠-蛋白胨缓冲液稀释至100 mL,摇匀后取10 mL 稀释液加入到100 mL 胰酪大豆胨液体培养基中,30~35℃培养18~24 h。2)试验组:取“2.2.4.1”项下稀释液10 cm加入到100 mL胰酪大豆胨液体培养基后,再取小于100 CFU的大肠埃希菌菌液加入到培养基中,30~35℃培养18~24 h。3)菌液组:取小于100 CFU的大肠埃希菌菌液加入到胰酪大豆胨液体培养基中,30~35℃培养18~24 h。4)取上述3 个试验组的培养物1 mL 接种于100 mL 的麦康凯液体培养基中,42~44℃培养24~48 h。再将所得培养物划线接种于麦康凯琼脂培养基中,30~35℃中培养18~72 h,判断是否有大肠埃希菌生长。见表2。
2.2.4.2 沙门菌检查 1)供试液组:取“2.2.2”项下供试品溶液10 mL,加入胰酪大豆胨液体培养基稀释至200 mL,摇匀后,30~35℃培养18~24 h。2)试验组:取“2.2.2”项下供试品溶液10 mL,加入胰酪大豆胨液体培养基稀释至200 mL,摇匀后,再取小于100 CFU的沙门菌菌液加入到培养基中,摇匀,30~35℃培养18~24 h。3)菌液组:取小于100 CFU 的大肠埃希菌菌液加入到200 mL 胰酪大豆胨液体培养基中,30~35℃培养18~24 h。4)取上述3 组的培养物0.1 mL 接种于10 mL 的RV 沙门菌增菌液体培养基中,30~35℃培养18~24 h。再将所得培养物划线接种于木糖赖氨酸脱氧胆酸盐琼脂培养基中,30~35℃中培养18~48 h,判断是否有沙门菌生长。见表2。

表2 乳疾清合剂的控制菌检查方法验证结果
3 讨论
3.1 薄层鉴别乳疾清合剂的制作工艺较为简单,直接经过饮用水提取、浓缩、加入辅料后即得,因而使得乳疾清合剂含有多种化学成分。在本研究中建立的薄层色谱法[3]鉴别乳疾清合剂中的延胡索、青皮两种成分的方法,分别参考了《中华人民共和国药典》2015 年版中延胡索药材和青皮药材的薄层鉴别方法[4]。关于玄参的薄层鉴别方法,笔者曾试用过不同的展开剂:1)以三氯甲烷-甲醇-水(12∶4∶1)的下层溶液作为展开剂;2)以三氯甲烷-甲醇(6∶1)为展开剂。结果发现样品与对照药材在相同位置上均显相同颜色的斑点,且阴性均无干扰,但考虑到方法1)的Rf 较为适中,而且展开剂配制步骤略为简便,因此选择了三氯甲烷-甲醇(6∶1)为展开剂。
玄参主要含有环烯醚萜苷类化合物[5],而该类化合物偏于亲水性,易溶于水和甲醇,可溶于正丁醇,而且易被酸水解。而青皮的主要化学成分为橙皮苷,属二氢黄酮苷类化合物,微溶于甲醇,但可溶于乙醇和正丁醇[6],因此本研究建立的薄层鉴别法鉴定乳疾清合剂中的玄参、青皮两种成分的方法,采用相同的供试品溶液制备方法,简化了在实际检验操作中的步骤。
3.2 微生物限度检查在微生物限度检查方法学验证的过程中,为确认供试品中的微生物能被充分检出,首先应选择最低稀释级的供试液进行计数方法实用性检查[7]。而经实验发现,乳疾清合剂的需氧菌总数、霉菌及酵母菌总数计数方法和沙门菌检查方法中,可直接取乳疾清合剂原液进行检查。而大肠埃希菌的限量检查,则需要使用稀释10倍的乳疾清合剂进行检查。
实验结果表明,3 批乳疾清合剂的需氧菌总数、霉菌及酵母菌总数的计数方法可行,其回收试验结果显示试验组菌落数减去供试品对照组菌落数的值与菌液组菌落数比值在0.5~2 范围内,且控制菌检查方法可行,均未检出大肠埃希菌和沙门菌,符合《中华人民共和国药典》2015 年版中关于非无菌产品的微生物限度规定。
综上所述,本实验建立的乳疾清合剂中延胡索、玄参和青皮的薄层鉴别方法和微生物限度检查方法,专属性强,可作为该制剂质量标准的项目之一。

