离子液体的电导性质研究进展
付雪,陈婷婷,陈婷婷,许映杰
(绍兴文理学院化学化工学院,浙江绍兴 312000)
引 言
离子液体(ILs)是由有机阳离子和有机或无机阴离子组成的低温熔融盐[1],具有蒸气压低、导电性能优、结构可设计性强、热稳定性高等特点[2],广泛应用于有机合成和催化、分离与纯化及气体吸收等过程[3-9]。其中,ILs 优异的导电性能,使其作为新型电解质在电化学领域显示出了良好的应用前景[10-13]。例如,Ahmed等[14]比较了咪唑酰亚胺型锂盐ILs(LiFSMIPTFSI)+碳酸乙烯酯+二甲基亚砜溶液与四氟硼酸锂(LiBF4)+碳酸乙烯酯+二甲基亚砜溶液为电解质时锂离子电池的电化学性能,发现前者的电化学性能更加优异,认为这是由于LiFSMIPTFSI溶液中Li+的导电能力高于LiBF4溶液;Zhu 等[15]总结了ILs 作为电解质在铝、钠、镁等离子电池系统中的应用,重点讨论了ILs 与铝离子电池之间的界面反应对铝的储存机理的影响,认为ILs 的高导电能力和稳定化学性质使其非常适用于高能电池系统,但其高黏性和高成本则限制了大规模应用;Haque 等[16]将[Emim][Ac]作为超级电容器的电解质,发现其在60℃时仍具有优异的电容性能,自放电机理研究结果表明温度升高有利于提升离子的导电能力,从而改变电荷分布与扩散效应。上述结果充分表明,ILs的电导性质与其电化学性能密切相关[17]。因此,电导率(κ)作为衡量ILs 电导性质的重要物理特性之一,可为ILs 的电化学应用提供理论指导[18-19]。此外,Feng 等[20]采用分子动力学模拟和速度自相关函数(velocity-autocorrelation functions)分 析 研 究 了[Bmim][NTf2]中的离子传输机制,发现可能存在自由离子与结合离子两种相互交换的状态,且通过模拟获得的自由离子浓度和扩散系数结合Nernst-Einstein 方程理论预测得到的直流κ(恒定离子电流)与实验数据非常吻合,为此提出了[Bmim][NTf2]的“离子半导体”模型,其中离子的价和导“带”由能隙隔开,其值约为26 meV,能满足两种动态状态之间的互换,表明ILs 还可能具有半导体特性,这将进一步丰富ILs 电导性质的基础研究与实际应用。因此,研究ILs 的电导性质具有重要的理论意义和应用价值。
ILs 的电导性质可由实验测定、模型关联、理论预测、动力学模拟等方法获得[21-28]。其中,实验测定法主要是通过电导电极、电化学交流阻抗、宽频介电谱、脉冲场梯度自旋回波(PFGSE)核磁共振等获得电导性质,具有操作简单、精度高等优点。利用实验测定的ILs 电导性质如κ和摩尔电导率(Λ),结合溶液热力学理论还可获得ILs 的无限稀释摩尔电导率(Λ∞)、解离度(α)、阴阳离子缔合常数(KA)、离子迁移率、临界胶束浓度(CMC)等物理量[29-32],并用于分析离子-溶剂相互作用,这是ILs 电导性质在溶液热力学研究中的重要应用。例如,Wang 等[33]通过测量[Cnmim]Br 水溶液的κ,获得了体系的CMC、[Cnmim]Br 的KA和标准摩尔Gibbs 聚集能,并深入探讨了体系微观结构。此外,根据实验测定的ILs 体系κ,还可以表征ILs的催化性能。例如,Guo 等[34]研究发现卤化咪唑和卤化季铵等ILs 在水存在时催化环氧乙烷(PO)与CO2反应性能与ILs 水溶液的κ有关:当ILs 水溶液的κ增加时,体系中可自由移动的卤素阴离子数目也随之增加,从而增强卤素阴离子与PO 亲核作用使PO 开环形成中间体,最终提高反应性能。因此,实验测定法获得ILs 的电导性质得到了广泛关注与应用。模型关联和理论预测也是获得ILs 电导性质的重要手段[25],但在模型构建与预测精度评估中,都需要使用实验测定的电导性质作为评价依据[26]。此外,动力学模拟能提供极端条件下ILs 的电导性质,但由于受ILs 力场的影响,研究报道相对较少。
目前,实验测定法研究ILs 电导性质主要集中在纯ILs、ILs+溶剂和ILs+ILs 体系。与常规无机盐相比,ILs 结构相对复杂如离子体积大、具有极性或非极性的取代基等,体系中多种相互作用共存如静电、氢键、范德华力和π-π 相互作用等,体系中除了自由离子之外,还存在离子对和离子簇等聚集体,且它们的数目难以定量测定,使得纯ILs 及其溶液体系的导电机制比常规电解质溶液体系更加复杂[35]。已有研究结果表明,纯ILs 电导性质主要与离子的电荷数及流动性有关,受阴阳离子静电、氢键和范德华力等影响,而它们取决于阴阳离子种类与结构、电荷分散程度、温度等因素[36]。由于纯ILs的静电和氢键作用较强且黏度(η)较大,离子对和离子簇的形成使得自由导电离子数目减少,故其导电能力较弱[37];在纯ILs 中加入一定量溶剂后,通过离子-溶剂之间的静电-偶极作用和色散作用使离子溶剂化[38],促使ILs 中的离子对和离子簇解离成自由导电离子,有效降低了体系η和大幅度提高了导电能力,使ILs+溶剂体系作为电解质广泛应用于电化学过程[39-42];此外,采用ILs+ILs 体系代替ILs+溶剂体系,能有效克服常规溶剂沸点较低的问题,进一步拓展了ILs 的应用范围[43-47]。近年来,随着新型功能化ILs 或聚ILs 广泛应用于电化学领域,其电导性质也得到重点关注[48-49]。因此,本文总结了实验测定法在ILs 电导性质的研究进展,重点分析与归纳了ILs 电导性质的特征、变化规律和影响机制,并阐述了ILs 电导性质在体系微观结构研究中的应用,所涉及的ILs 的阴阳离子结构与缩写见图1。
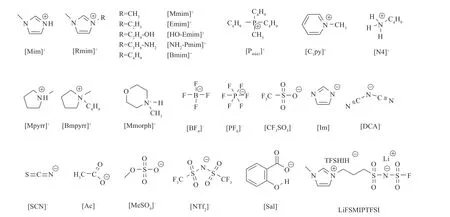
图1 本文采用的ILs的阴阳离子结构与缩写Fig.1 Structure and abbreviation of anion and cation of ILs
1 纯ILs的电导性质
纯ILs 的电导性质主要与阴阳离子结构、η、温度等因素有关。其中,阴阳离子结构差异会影响ILs静电作用、氢键作用和η,并最终影响其导电能力;温度变化则会改变阴阳离子的静电作用,影响离子动能和运输能力,进而影响ILs的电导性质。
1.1 阴阳离子结构的影响
Zhang 等[50]测定并比较了[Emim][Im]和[Bmim][Im]的κ,并考察了咪唑阳离子结构对纯ILs 电导性质的影响。结果显示,当温度相同时,前者的κ大于后者,表明增加咪唑阳离子侧链烷基碳链长度会减小离子传输速度,并导致ILs 导电能力下降。侯海云等[51]通过测量咪唑醋酸盐ILs 的κ,也得到了相同结论。Pandit 等[52]考察了阴离子结构对阳离子为[Bmim]+的ILsκ的影 响,κ顺序 为:[Bmim][SCN]>[Bmim][BF4]>[Bmim][MeSO4]>[Bmim][Ac]>[Bmim][Sal],表明ILs 的κ随阴离子体积的增加而减小,这与Yu等[53]的实验结论相一致。
ILs 中阴阳离子静电作用强弱与离子结构和电荷分散程度有关,是影响κ的另一个重要因素。Rodil 等[54]研究发现,当阴离子为[MeSO4]-时ILs 的κ随着阳离子体积增加而减小:[C1py][MeSO4]>[Bmim][MeSO4]>[P4441][MeSO4],这与Zhang 等[50]研究结果相一致;有趣的是,当阳离子为[P4441]+时ILs的κ大小如下:[P4441][NTf2]>[P4441][MeSO4]>[P4441][Cl],并未随阴离子体积的减小而增加,尤其是[P4441][Cl]的κ反而小于[P4441][NTf2]。他们认为这是由于Cl-体积较小且负电荷较为集中,与[P4441]+的静电作用较强,从而使Cl-倾向于黏附在阳离子上,导致κ下降;而随着阴离子体积增大和负电荷分散度增加,阴阳离子静电相互作用逐渐减弱,κ也随之逐渐增大。另外,Rodil等[54]还提出[C1py][MeSO4]具有较大的κ,是由于[C1py]+与[MeSO4]-之间的平均距离较大、静电作用较弱,从而使其具有较强的导电性能。Zheng 等[55]在研究1-烷基-3-甲基咪唑双氰胺盐ILs的κ随阳离子侧链烷基链长度变化的基础上,也提出了阴阳离子静电作用是影响κ大小的重要因素之一。因此,采用改变阴阳离子结构来调控ILs 电导性质时,需要同时兼顾阴阳离子体积和静电作用对ILs导电能力的影响。
1.2 黏度的影响
η反映了ILs内摩擦力大小,与离子移动能力相关,直接影响ILs 的导电性能。纯ILs 的η与静电作用、氢键作用和基团大小等因素有关。定性分析ILs电导性质随η的变化,并构建两者之间的定量关系,引起了研究者的兴趣。例如,Zhang 等[50]比较了[HO-Emim][Im]和[Emim][Im]的κ,发现阳离子的侧链存在羟基时,κ迅速下降,这归因于羟基易形成氢键作用,导致η增加和离子传导能力下降。目前,文献常采用Walden规则来描述ILs的η与Λ的关系[52]:

式中,k是与温度相关的常数。由式(1)可知,当温度一定时,ILs 的Λ与η呈反比例关系,表明η增加不利于提升ILs 的导电性能,这为调控ILs 的导电性能提供了理论依据。
1.3 温度的影响
一般而言,ILs 的κ随温度的升高而呈指数形式增加,其增幅与ILs 的种类相关[50,53-54,56]。Zhang 等[50]采用协同传输机制解释了ILsκ随温度升高的原因:温度升高减弱了阴阳离子间的相互作用,加速了导电离子的传输速率。采用理论模型关联κ与温度的关系,对于预测不同温度时的κ具有重要的意义[57]。目前,文献常采用Vogel-Tamman-Fulcher(VTF)方程来定量描述纯ILs的κ和温度的关系[52]:

式中,κ∞表示温度为无穷大时ILs 的κ;T0是与ILs熔点相关的物理量[58];B值与ILs阴阳离子克服缔合作用成为自由导电离子所需要的能量有关。κ∞、B、T0均是待定参数。利用式(2),Pandit 等[52]关联了5 种咪唑型ILs 的κ与温度的关系,标准偏差为0.19%~1.57%,但他们并未对参数κ∞、B和T0的意义展开讨论。宁汇等[58]采用VTF 方程关联了10 多种纯ILs 的κ随温度的变化,重点讨论了参数B值与ILs 结构的关系,发现阳离子侧链越长,范德华力越大,其B值也越大;阴阳离子形成氢键的作用力越强,其B值也越大。为此,他们提出了B值大小可以表征ILs中阴阳离子缔合作用的强弱[58],这不仅明确了参数B的物理意义,而且极大地丰富了VTF 方程的内涵。为进一步明确VTF 方程中参数的物理意义,人们将Arrhenius 型电导率方程与VTF 方程相结合,得到了改进型VTF方程[53,59-60]:

式 中,kB是Boltzmann 常 数;κ∞物 理 意 义 同式(2);Tg是玻璃化转变温度;Ea是电导活化能,表示离子跃迁至自由空隙所需的能量。对比式(2)和式(3),可得B=Ea/kB,表明VTF 方程中的B与Ea具有相似的物理意义,故式(3)常被用于分析温度变化引起纯ILsκ改变的内在原因[53,59]。
1.4 电导性质在研究纯ILs微观结构中的应用
结合模型分析纯ILs 的κ随η和温度的变化规律,是研究纯ILs 微观结构的有效手段之一。例如,将Walden 规则[式(1)]拓展,关联不同温度时纯ILs的lgΛ与lgη-1的关系,可定性分析纯ILs 中阴阳离子缔合程度[52]:
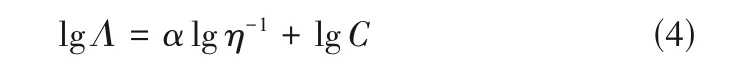
式中,C是可调参数。基于式(4),本文关联了293.15~343.15 K 时文献报道的部分咪唑阳离子非质子型ILs 的lgΛ与lgη-1(图2),并与KCl 溶液进行了比较。从图2 可知,非质子型ILs 的lgΛ与lgη-1能很好地遵循Walden 规则,其Walden 规则线一般处于理想线(KCl 的Walden 规则线)下方,且α值均小于1,表明ILs 实际η要低于Walden 规则所预测的η[61],这归因于ILs 中存在紧密离子对或离子聚集体等缔合体,不利于离子迁移。从图2 可知,[Bmim][Sal]的α值为0.890,低于其他ILs,认为这是由于其阴阳离子具有平面结构和π 电子云,容易通过π-π相互作用形成缔合离子对,导致α值下降。Liu 等[62]报道了[Cnpy][NTf2]的lgΛ与lgη-1也符合Walden 规则,且α值也小于1。
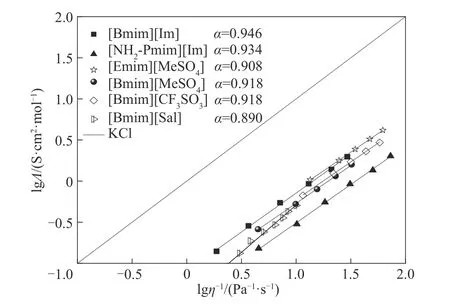
图2 293.15~343.15 K时纯ILs的Walden规则图[50,52,56]Fig.2 Walden plots for pure ILs at T=293.15 to 343.15 K[50,52,56]
除了定性分析ILs 的缔合程度,电导性质还可以定量计算纯ILs 的离子率[63]。离子率的定量计算可以采用Λimp/ΛNMR表示,Λimp为电化学交流阻抗测定法测得的摩尔电导率,取决于电场中带电粒子的迁移[64];ΛNMR为PFGSE 核磁共振测得的离子自扩散系数计算而得的摩尔电导率,与直接参与传导过程的离子数目有关。其中,ΛNMR与离子自扩散系数之间的关系可用Nernst-Einstein方程表示[56]:
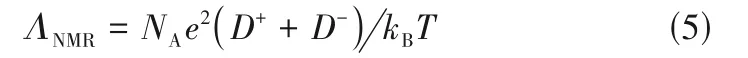
式中,NA是阿伏伽德罗数,e是每个离子载体上的电荷,D+和D-是离子的扩散系数。Mbondo 等[56]采用Λimp/ΛNMR计 算 了298~343 K 时[Emim][MeSO4]、[Bmim][MeSO4]、[Emim][CF3SO3]、[Bmim][CF3SO3]的离子率,其值介于0.37~0.68之间,证实ILs中存在离子缔合;而且离子率随阳离子链长增加和温度升高而下降,这与Walden 规则分析结果相一致,提出了ILs的离子率主要与阴阳离子静电作用和范德华作用相关。Tokuda 等[65]采用Λimp/ΛNMR研究了[Rmim][NTf2]的离子率,发现烷基链长增加导致范德华作用增强,促使离子对或离子簇等聚集体形成,导致ILs 离子率下降。电导性质除了可以定量表征非质子型ILs的离子率,还可以计算质子型ILs的离子率,这方面的工作见文献[64,66-67]。与红外和核磁共振等谱学方法相比[68-70],采用电导性质得到的离子率相对较低,MacFarlane 等[63]认为这可能是将带电离子对归属为中性组分所致。由于红外和核磁共振等谱学方法在研究纯ILs 离子率时往往存在吸收峰容易重叠和识别困难等问题,故电导性质将是一种很好的补充手段。
2 ILs+溶剂体系的电导性质
ILs+溶剂体系的电导性质与溶剂种类、ILs-溶剂相互作用、溶剂用量等因素紧密相关[71-72]。因此,掌握ILs+溶剂体系电导性质的变化规律,不仅可以获得体系的微观结构信息,而且还可以来调控体系的导电性能。
2.1 溶剂性质的影响
溶剂性质如介电常数(ε)、η、溶剂化能力等会影响ILs 微观结构,从而影响ILs+溶剂体系的电导性质。Boruń 等[73-80]系统比较了[Emim][BF4]和[Bmim][BF4]在正丁醇(1-BuOH)、异丙醇(2-PrOH)、正丙醇(1-PrOH)、N,N-二甲基甲酰胺(DMF)、N,N-二甲基乙酰胺(DMAc)、水(H2O)和二氯甲烷(DCM)中的Λ∞,其数值大小如下:DCM(ε=8.82,η=0.415 mPa·s)>H2O(ε=78.36,η=0.8903 mPa·s)>DMF(ε=36.81,η=0.8455 mPa·s)>DMAc(ε=38.75,η=0.9335 mPa·s)>1-PrOH(ε=20.45,η=1.957 mPa·s)>2-PrOH(ε=19.45,η=2.052 mPa·s)>1-BuOH(ε=17.58,η=2.5772 mPa·s),基本遵循随溶剂ε增加或η下降而增加,这是由于溶剂ε增加促进了ILs自身氢键网络或离子对的解离,而溶剂η下降则有利于导电粒子的移动,从而提高了体系的导电能力。反常的是,DCM 的ε远小于H2O,但ILs 在DCM 中Λ∞却大于在H2O 中的Λ∞,认为这是由于非质子型溶剂DCM 不易与ILs 的阴阳离子发生氢键或极化作用形成溶剂化离子,而质子型溶剂H2O 极易与阴阳离子发生氢键或极化作用并形成水化离子,使离子移动能力下降,从而导致ILs在H2O中Λ∞小于在DCM的Λ∞。
Li等[81]比较了[Bmim][BF4]和[Bmim][PF6]在丙酮、乙腈、氯仿和四氢呋喃中的Λ,发现Λ随溶剂ε增加而增加,并提出了一个经验模型来描述体系Λ与溶剂ε、摩尔分数(xs)和摩尔体积(Vm)的关系:

式中,Λ0为纯ILs的摩尔电导率,a是与溶剂ε和Vm相关的物理量,对于[Bmim][BF4]+溶剂和[Bmim][PF6]+溶剂体系分别表达为:
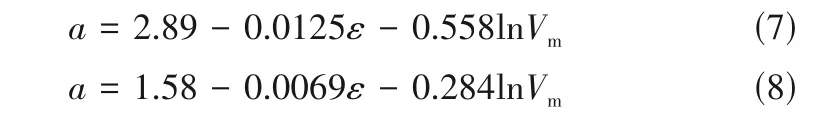
该模型的浓度适用范围较广(xs=0~0.8),尤其是在ILs 高浓度区域仍有良好的精度,优于传统模型如Debye-Hückel-Onsager 方程,这也为建立溶剂物理化学性质如ε和Vm与ILs+溶剂体系电导性质之间的定量关系奠定了基础。
虽然Li 等[81]提出的模型考虑了溶剂ε对ILs+溶剂体系电导性质的影响,但尚未包含体系η对电导性质的影响。为此,Wang 等[82]比较了[Bmim][PF6]在丙酮和丁酮中的κ和η随xs的变化趋势,发现体系η在富ILs区域随xs的增加而急剧减少,然后在富溶剂区域趋于平缓地减少;而体系κ在较宽浓度范围内随xs先增加后减少,并在xs=0.8 处出现最大值,且对于给定的ILs,其最大值随着溶剂ε的增加而增加。因此,采用Every 等[83]提出的模型定性分析ILs+溶剂体系κ随xs的变化规律:

式中,ni是i型电荷载流子的数量,qi是电荷;μi是离子迁移率,其值与溶液η相关。由式(9)可知,对于给定的ILs+溶剂体系,其κ值必定随着离子迁移率和/或电荷载流子数量的增加而增加。随着溶剂的加入,会引起纯ILs 静电作用下降,使离子缔合体或聚集体解离成自由离子,这不仅降低了体系η,而且增加了自由离子数目,从而导致体系κ增加;而当xs增加至0.8 时,体系η已经接近于纯溶剂,此时再进一步增加溶剂量会对单位体积的自由离子产生稀释作用,从而使体系κ下降,并出现极大值[82]。此外,他们还根据离子缔合理论[84-85],解释了[Bmim][PF6]在丙酮和丁酮中κ的最大值随溶剂ε增大的原因,认为这是由于ILs的KA随着溶剂ε的增加而降低所致[82]。最后,Wang 等[82]提出指数型方程来描述ILs+溶剂体系κ与η的乘积与溶剂质量分数(ws)的关系:

式中,B和C是待定参数,其中C值包含了离子迁移、黏性流动活化能和ILs-溶剂相互作用能的贡献。结合式(10)和最小二乘法,关联了[Cnmim][BF4]+溶剂和[Cnmim][PF6]+溶剂体系κη与ws的关系,发现B值非常接近纯ILs 的κη,故他们将式(10)改进为:
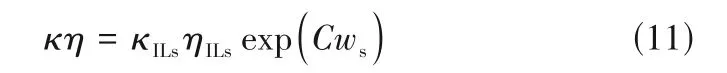
并采用式(11)关联了15 个ILs+溶剂二元或拟二元体系κη与ws的关系,相关系数大于0.99[82]。
2.2 溶剂用量的影响
ILs+溶剂体系中溶剂用量与ILs-溶剂相互作用、ILs 的解离程度直接相关,并影响体系的导电性能。Wang 等[82]详细地比较了η、ws对ILs+溶剂体系的κ影响,认为κ受溶剂浓度的影响比体系η更为敏感。Buchner 等[86]系统地研究了[Cnmim][BF4]、[Bmim][PF6]和[Bmim][DCA]非质子型ILs 在乙腈、水、甲醇、DCM 和碳酸丙烯酯(PC)等极性溶剂中κ随xILs的变化规律,发现随着溶剂用量增加,体系κ的变化情况大致可以分为三个阶段:(1)当少量溶剂加入ILs后,κ缓慢增加,这归因于少量溶剂仅使ILs 部分解离;(2)随着溶剂用量进一步增加,κ增加幅度明显提高,直到κ出现极大值,这归因于溶剂用量增加使得ILs 完全解离成自由离子,不仅增加了体系中导电粒子数目,而且降低了阴阳离子的静电作用和体系η,使体系κ显著提升;(3)继续增加溶剂用量,κ陡然降低,这是由于溶剂用量过大稀释导电离子所致。ILs+溶剂体系κ出现极大值时,xILs=0.1~0.25,具体数值与溶剂种类有关,一般随溶剂极性增加而减小。此外,他们还采用Casteel-Amis 方程[87]进一步描述ILs+溶剂体系κ与浓度的相关性,并使用溶质摩尔分数代替溶质摩尔量[86]:
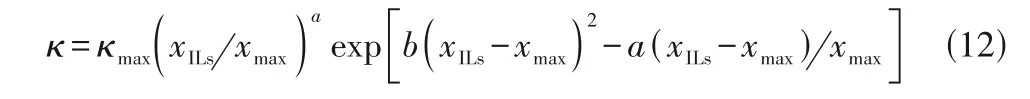
式中,κmax和xmax表示体系κ最大值及所对应的xILs,a和b是经验参数。Buchner 等[86]采用式(12)关联了ILs+溶剂体系全浓度范围内κ随xILs的变化,相关系数大于0.999。Zhang 等[88]将Casteel-Amis 方程推广至阴离子为[NTf2]-的疏水性非质子型ILs 与甲醇、乙醇、乙腈和PC 等组成二元体系,也获得了优良的结果。Xu等[89]将Casteel-Amis 方程应用于关联醋酸丁胺(N4Ac)和硝酸丁胺(N4NO3)质子型ILs 水溶液体系全浓度范围的κ,结果显示其变化规律与非质子型ILs+溶剂体系相似。Zhang 等[90]测定了金属螯合型ILs+醇体系的κ,并探究了其κ随浓度的变化规律,也观察到了类似的现象。上述结果表明,溶剂用量是影响ILs+溶剂体系电导性能的重要因素之一。
除溶剂用量之外,温度也会影响ILs+溶剂体系的κ。Xu 等[91]基于VTF 和Arrhenius 方程,提出一个同时关联ILs+溶剂体系κ与浓度、温度的模型:
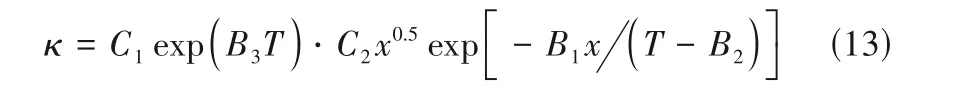
式中,B1、B2和B3是拟合参数,C1和C2是常数,且C1C2=eB4。Xu 等[91]通过对比Every 模型[式(9)],解释了新模型中参数的物理意义,认为式(13)中的第一项C1exp(B3T)表示离子迁移率,第二项C2x0.5exp[-B1x/(T-B2)]包含了电荷携带数(自由离子)和离子电荷数的影响。对于给定体系,离子的电荷是恒定的,所以第二项主要代表体系中自由离子或溶剂化离子的数量[91]。该模型适用于ILs+溶剂(特别是有机溶剂)体系κ的关联与预测,预测值与实验值吻合度很高。
2.3 电导性质在研究ILs+溶剂体系的微观结构中的应用
当溶剂与ILs 混合,溶剂分子与阴阳离子发生相互作用,破坏ILs 原有氢键网络和缔合作用,促使ILs 解离,从而改变体系的导电性能[92]。因此,电导性质被广泛用于研究ILs+溶剂体系的微观结构,尤其是ILs 缔合情况。目前,文献通常采用溶液热力学模型来关联实验测定的ILs+溶剂体系的电导性质,在获得KA的基础上,再结合经典热力学理论得到热力学性质如离子缔合Gibbs自由能[ΔG0A(T)]、离子缔合熵[ΔS0A(T)]和离子缔合焓[ΔH0A(T)]等,同时考察KA与溶剂性质之间的关系。例如,Shekaari等[93]采用lcCM 模型关联了Λ与ILs 浓度(c)的关系。该模型为:
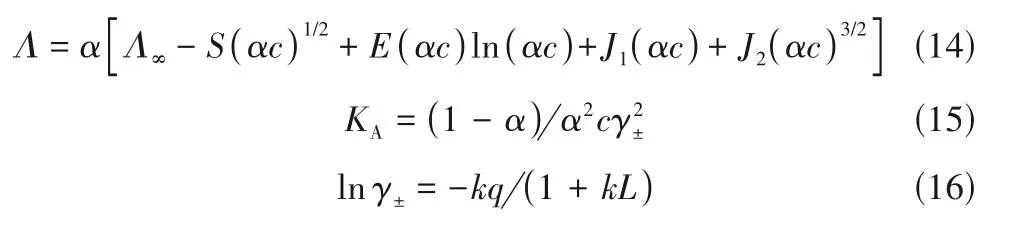
lcCM 模型共有Λ∞、KA和距离参数(L)三个待定参数。其余物理量意义如下:S是Debye-Hückel-Onsager 系数,E仅取决于溶剂的性质和离子的电荷,而J1和J2不仅与溶剂的性质和离子的电荷相关,而且还取决于距离参数L。γ±是自由离子的平均活度系数。lcCM 模型中的k和q可通过式(17)、式(18)计算:
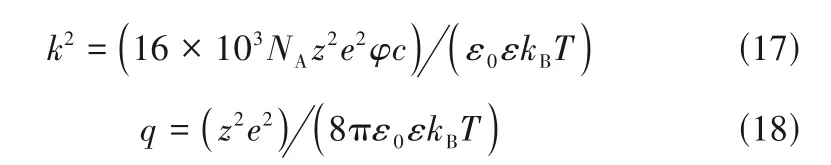
式中,NA、kB、e定义同式(5),ε0是真空介电常数,z是离子的电荷数。基于lcCM 模型,Shekaari等[93]通过非线性最小二乘迭代法拟合了[Rmim]X(X-=Cl-、Br-、I-)+水体系Λ与c的关系,获得了Λ∞、KA和L等参数。其中,KA值大小为:[Bmim]Cl>[Bmim]Br>[Bmim]I,随阴离子半径增大而下降,这是由于阴离子半径增大,其表面电荷密度降低,减弱了与[Bmim]+的亲和力及静电作用,从而使KA值下降;当阴离子为Br-时,KA值随着[Rmim]+烷基链长度增加而下降;此外,ILs 的KA值随着体系温度升高而增加,认为这是由于[Rmim]+的有机链通过占据冰状水结构的分子空腔与水分子发生“疏水性水合”或“笼缔合”,且阳离子不能与水分子发生供体-受体相互作用,因此水溶液中的离子对主要通过固有的冰状水结构来稳定,而ILs 中烷基部分的相互作用在水溶液中离子对的形成中发挥了非常重要作用,随着体系温度升高,离子溶剂化程度降低,进一步促使离子对形成,从而导致ILs 的KA值增加,这与Zhang等[94-95]报道结果相一致。基于ILs 的KA值,Shekaari等[93]计算了离子缔合Gibbs自由能ΔG0A(T):
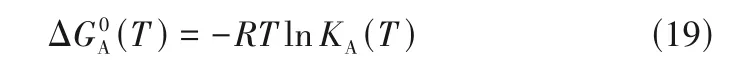
同时,还计算了ΔS0A(T)和ΔH0A(T)等性质。其中,ΔG0A(T)为负值,而ΔS0A(T)和ΔH0A(T)为正值。Boruń 等[73-80]系统比较了[Emim][BF4]和[Bmim][BF4]在不同溶剂中电导性质,并采用lcCM 模型拟合了体系Λ与c的关系,获得了Λ∞、KA和ΔG0A(T)等性质,结果显示[Emim][BF4]和[Bmim][BF4]在溶剂中KA顺序为[73-79]:DCM>1-BuOH>2-PrOH>1-PrOH>DMAc>DMF>H2O,表明KA随着溶剂ε增加而下降,归因于溶剂ε增加促进了ILs 解离,这与Wang 等[82]提出的观点相一致。因此,ILs 在溶剂中的KA可以用于衡量ILs+分子溶剂体系的导电能力。一般而言,ILs在溶剂中的KA值越大,表明阴阳离子缔合作用越强,离子自由迁移率则越低,那么体系的导电能力越弱。
此外,Boruń[17]还发现在大部分ILs+溶剂体系中,lgKA与1/ε呈线性关系,这表明离子缔合主要由阴阳离子间的静电作用所致,而溶剂主要通过与阴阳离子作用改变ILs 的缔合程度。通过比较[Emim][BF4]和[Bmim][BF4]在不同溶剂中的KA可知,ILs在强极性的H2O 中具有较小的KA值和较大的Λ∞值,这是由于水的羟基易与ILs 形成氢键,导致ILs 的解离。而ILs 在DCM 中同时具有较大的KA值与Λ∞值,Boruń[17]认为ILs 在DCM 中不仅会形成离子对,而且还会形成三重态离子。一般而言,在较高ILs 浓度或ε<10溶剂中,ILs能以离子对、三重态离子或离子簇的形式存在。如图3所示,在低浓度时,体系中以自由离子占主导地位,此时体系的Λ较大;随着ILs浓度的增加,阴阳离子形成中性离子对,使体系Λ降低;随着ILs 浓度进一步增加,溶液中出现三重态离子,则Λ会随之增加;ILs浓度增加直至形成离子簇,则体系的Λ迅速下降。Wang 等[33,96]在研究ILs 在水或分子溶剂中的聚集行为时也提出了三重态离子概念,他们认为当ε较小时,ILs 更易形成三重态离子的缔合现象,因其携带电荷,会使溶液导电性能增强,这也是ILs 在低ε的DCM 中同时具有较大KA和Λ的原因。
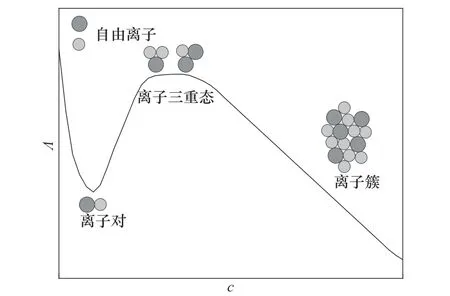
图3 不同浓度时ILs在溶液中可能的聚集结构[17]Fig.3 Possible structures of ionic liquids aggregates at different concentrated solutions[17]
3 ILs+ILs体系的电导性质
ILs+ILs 体系中存在着多重阴阳离子的静电作用,使得体系电导性质明显有别于纯ILs、ILs+溶剂体 系[45]。Thawarkar 等[47]测 定 了[Mim][Ac]与[Bmim][NTf2]、[Bmpyrr][NTf2]、[Mmim][MeSO4]、[Mpyrr][Ac]、[Mmorph][Ac]组成二元体系的κ,结果显示体系的κ随x[Mim][Ac]呈先增加后下降趋势。以[Mim][Ac]+[Mmim][MeSO4]体系为例,体系κ先随x[MimAc]增加,这是由于纯[Mmim][MeSO4]的η较大,加入η相对较低的[Mim][Ac]时,引起体系η下降和离子迁移率增加,导致κ增大;此外,随着x[Mim][Ac]的增加,导电离子数量也增加,κ也会增大;当x[Mim][Ac]趋向于1 时,体系κ下降,这归因于体系中导电离子数目减少。而与[Mim][Ac]+水体系的κ相比[97],[Mim][Ac]+ILs 体系κ总体偏小。因此,影响ILs+ILs 体系κ的主要因素有[98]:(1)体系中自由移动的离子数;(2)离子的迁移率,这与ILs+溶剂体系相似,可以采用Every 模型解释[83]。
ILs+ILs 体系中阴阳离子缔合情况更加复杂,使得体系明显偏离了理想溶液行为[99-101]。ILs+ILs 体系的电导性质是研究体系中离子缔合作用最直接的手段。宁汇等[58]测定了10 多组等摩尔混合的ILs+ILs 体系κ,发现体系的κ介于两种纯ILs 的κ之间,且随温度升高而增大。为此,他们采用VTF 方程[式(2)]关联了体系κ随温度的变化,获得了体系的B实验值(Bexp),并与将ILs+ILs 体系视为理想溶液时的B值(Bcal)比较,用于表征ILs+ILs体系中阴阳离子的缔合情况:
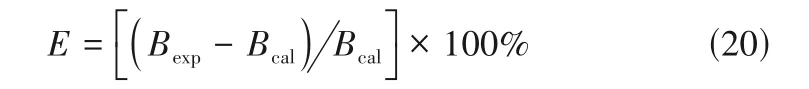
若E为正值,说明ILs 混合后阴阳离子成为自由离子需要的能量相对增大,离子缔合作用增强;若E为负值,说明阴阳离子缔合作用减弱,这与Every 等[83]报道的ILs 与ILs 混合时阴阳离子缔合作用及κ变化规律相一致,表明电导性质可以用于研究ILs+ILs体系的离子缔合作用。
4 总结与展望
ILs的电导性质不仅与其实际应用密切相关,而且可用于研究溶液热力学性质与相互作用。本文总结了纯ILs、ILs+溶剂体系、ILs+ILs 体系电导性质的研究进展,重点分析与讨论了ILs 电导性质的影响因素、变化规律以及电导性质在研究体系微观结构方面的应用。虽然ILs 电导性质研究已取得了一定进展,但目前主要集中在ILs 纯物质或ILs+溶剂体系宏观浓度时的电导性质,受仪器精度和ILs 纯度的影响,ILs无限稀释状态时的电导性质研究相对偏少,且实验重现性有待提升。ILs体系的电导性质对新型电池系统的电极反应和离子传导性能的影响规律尚未十分明确。此外,随着功能化ILs 的涌现和ILs 应用领域的拓展如半导体,对ILs 的电导性质研究提出了新要求。为此,本文对该领域后续研究方向提出以下几点建议。
(1)测定功能化ILs 及其溶液体系的电导性质,阐述功能化ILs 电导性质的特点与变化规律,及其与常规ILs电导性质的异同点。
(2)在电解质溶液理论基础上,拓展和发展适用于关联或预测ILs 及其溶液体系全浓度范围电导性质的理论模型,夯实ILs电导性质的理论基础。
(3)提升ILs 纯度和电导性质测定精度,基于实验测定的ILs+溶剂体系无限稀释电导性质,深入研究阴、阳离子的溶剂化性质,获得离子-溶剂微观相互作用信息。
(4)构建ILs 结构、电导性质与电化学器件性能之间的关系,并通过改变ILs 的结构来调控其作为电解质时电化学器件的性能。
(5)进一步明确ILs 的导电机制,定量表征ILs中自由离子与结合离子的相对数量,并通过ILs 结构设计来调控其作为“离子半导体”的能隙。

