VUV/UV/NaClO工艺降解百里香酚协同效应及活性物质贡献
肖习羽,李青松,吴俊文,李国新,陈国元
(1 汕头大学海洋灾害预警与防护广东省重点实验室,广东汕头 515063; 2 厦门理工学院水资源环境研究所,福建厦门 361024; 3 南方海洋科学与工程广东省实验室(广州),广东广州 511458;4 厦门市水资源利用与保护重点实验室,福建厦门 361024)
引 言
近年来,痕量级的药物及个人护理品(PPCPs)在地表水、地下水和饮用水等水环境中被频繁检出[1-3]。百里香酚(thymol,Tml),又名麝香草酚,是一种典型的酚类PPCPs,通常用于制作香料、保鲜剂及杀虫剂[4]。Tml的广泛使用及其在环境中难被降解,在地表水和污水等水体环境中均有检出[5-6],传统水处理技术对其去除效果不佳[7-8]。另有研究表明,Tml 会损害动物肝脏的解毒功能[9]、刺激皮肤、眼睛和呼吸道,甚至影响中枢神经系统[10]。因此,水体中Tml的环境效应及去除问题备受关注。
基于紫外辐射的高级氧化工艺(AOPs)以羟基自由基为主要氧化剂,实现有机物的有效降解;因其具有去除效率高、降解速度快及副产物少等优点越来越受到关注[11]。其中,基于254 nm 紫外光辐射(UV)联合氯氧化剂(NaClO、ClO2和NH2Cl 等)的组合工艺在降解PPCPs时有显著的协同作用而被广泛应用[12-14]。UV 照射氯氧化剂可以产生活性氧自由基(ROSs),包括:羟基自由基(HO·)、氧自由基(O-·)和超氧自由基(O2-·)等,以及活性氯自由基(RCSs),包括:氯自由基(Cl·)、二氯自由基(Cl2-·)和氯氧自由基(ClO·)等[15]。其 中HO·的 氧 化 还 原 电 位 高 达2.8 V[16-18],能无选择性地氧化大多数PPCPs[19-20]。研究表明,Cl·、Cl2-·和ClO·等RCSs 更具选择性,对含富电子基团的PPCPs、酚和胺类等含芳香环的化合物具有更高效的去除作用[21-23]。与UV 相比,真空紫外线(VUV,100~200 nm)不仅能直接光解有机污染物,还可以被水直接吸收产生HO·、氢原子(H·)和水合电子()[24]。目前,普遍使用的是能同时发射UV(254 nm)和VUV(185 nm)的双波长低压汞灯。因为VUV185辐射的能量密度更大,辐照水能产生额外的HO·,对各种有机污染物的降解效率明显高于传统UV254低压汞灯[25-29]。研究表明,在VUV/UV/Cl 工艺中加入游离氯可以抑制HO·重组产生H2O2,同时生成了选择性更强的Cl·、Cl2-·以及半衰期更长的ClO·,更能有效降解多种污染物,并且表现出明显的协同作用[30]。
自由基的生成是产生协同效应的主要因素[31-32],不同自由基在VUV/UV/NaClO 工艺中的贡献取决于其浓度和污染物的结构特性[22,33];自由基浓度及其与目标污染物的反应速率常数,以及对应产生的协同效应大小都是研究去除效率的重要参数[34]。因此,本文拟对VUV/UV、UV与NaClO的组合工艺对Tml 的去除效果和反应机制进行研究。首先,以协同因子(R)为指标,探究了不同NaClO 浓度和pH 下,两种工艺去除Tml 的协同效应;同时,以NB和BA为探针物质,确定了不同反应体系中HO·、Cl·的稳态浓度及其与Tml的二级反应速率常数;最后,研究了在Tml 降解过程中UV、NaClO、HO·、Cl·和其他活性自由基的相对贡献率。本研究可为UV/NaClO 工艺和VUV/UV/NaClO 工艺降解水中微量污染物提供理论依据和数据支撑。
1 材料与方法
1.1 实验试剂与仪器
百里香酚(Tml,德国Dr.Ehrenstorfer 公司,纯度99.5%);乙 腈(HPLC 级,德 国 Merck)、硝 基 苯(nitrobenzene,NB,99%)、苯甲酸(benzoic acid,BA,99.5%);叔丁醇(tert-butanol,TBA)(HPLC 级,上海安谱实验科技有限股份公司);次氯酸钠(CP,活性氯≥5.2%);五 水 合 硫 代 硫 酸 钠(Na2S2O3·5H2O)、HCl 和NaOH 均为分析纯;实验室用水均为Milli-Q 超纯水(≤18.2 MΩ)。
高效液相色谱仪(HPLC,Agilent 1260,美国);DZF-6050 真空干燥箱(上海精宏实验设备有限公司),纯水机(密理博(Millipore)公司,美国),HJ-6A 型磁力恒温搅拌器(江苏金坛峥嵘仪器),pH 计(Ohaus,美 国),ALC-210.4 电 子 天 平(Acculab,德 国),UV(254 nm)、VUV/UV(185 nm+254 nm)低压汞灯(北京航天宏达光电技术股份有限公司,各4 W)。
1.2 实验方法
反应在特制的圆筒形石英容器(300 ml)中进行,将反应容器放置在磁力搅拌器上,加入一定量配好的Tml 储备液,使反应初始浓度为3.33 μmol·L-1。实验中通过添加少量0.1 mol·L-1NaOH 微调pH 为7.0(±0.2);考察初始pH的影响时通过添加0.1 mol·L-1的HCl 或NaOH 调节溶液pH 为设定值。UV/NaClO与VUV/UV/NaClO 工艺中光源分别采用单个主要发射254 nm 辐射及同时发射185 nm 和254 nm 辐射的低压汞灯(均为4 W,实验前预热30 min),外置高透石英套管(厚度1 mm)。实验前开启搅拌装置,然后投加一定量的NaClO 溶液(0.2~0.4 mg·L-1),同时开启紫外灯进行反应。在设定的时间间隔分别取出1.5 ml 水样,经0.01 mol·L-1的硫代硫酸钠淬灭过膜后,采用HPLC 测定反应后剩余Tml 的浓度。所有条件下的反应均重复3次,取其平均值。
本文采用探针法和淬灭法来确定反应体系中活性自由基的生成和贡献。选用TBA 为自由基的清除剂,BA和NB作为探针化合物,通过自由基清除剂验证不同复合工艺中的主导自由基的存在,通过竞争动力学确定HO·和Cl·的稳态浓度及其与Tml的二级反应速率常数。引入协同因子(R)来定量评估VUV/UV/NaClO 和UV/NaClO 工 艺 降 解Tml 的 协同效应,用式(1)和式(2)描述[30,34]。通过计算RVUV/UV/Cl和RUV/Cl评估pH及NaClO的浓度对协同效应的影响。

1.3 分析方法
Tml、BA 和NB 浓度采用HPLC 进行测定。检测波长分别为275、230和262 nm。Tml与NB流动相均为乙腈和水(比例为65∶35),BA 流动相为乙腈和0.15%乙酸(比例为55∶45),流速设定为1.0 ml·min-1,柱温设定为35℃,进样体积均为20 μl。
2 结果与讨论
2.1 NaClO、UV、UV/NaClO、VUV/UV 和VUV/UV/NaClO对Tml的降解
本实验研究了NaClO、UV、VUV/UV 及其组合工艺对Tml 的降解,不同工艺降解去除率随时间的变化见图1。UV 和NaClO 氧化对Tml的去除率分别为25.2%和17.6%,VUV/UV 辐射对Tml 的去除率达80.3%。而投加NaClO(0.3 mg·L-1)后,反应5 min 后UV/NaClO 和VUV/UV/NaClO 工艺对Tml 的去除率分别为67.6%和95.0%。UV/NaClO 工艺对Tml 的去除率比单独UV 和NaClO 分别提高了168% 和284%。类似地,VUV/UV/NaClO 工艺的去除率相较VUV/UV 与NaClO 也 相 应 提 高 了18% 和440%。NaClO、UV、VUV/UV、UV/NaClO 和VUV/UV/NaClO对Tml 的降解均符合一级动力学反应,其拟一级动力 学 常 数k分 别 为0.000634 s-1、0.000983 s-1、0.00524 s-1、0.00479 s-1和0.0113 s-1。其中,kVUV/UV/Cl大于kUV/Cl与kVUV/UV之和,kUV/Cl大于kUV和kNaClO之和。因此,组合工艺对Tml的降解存在协同作用。
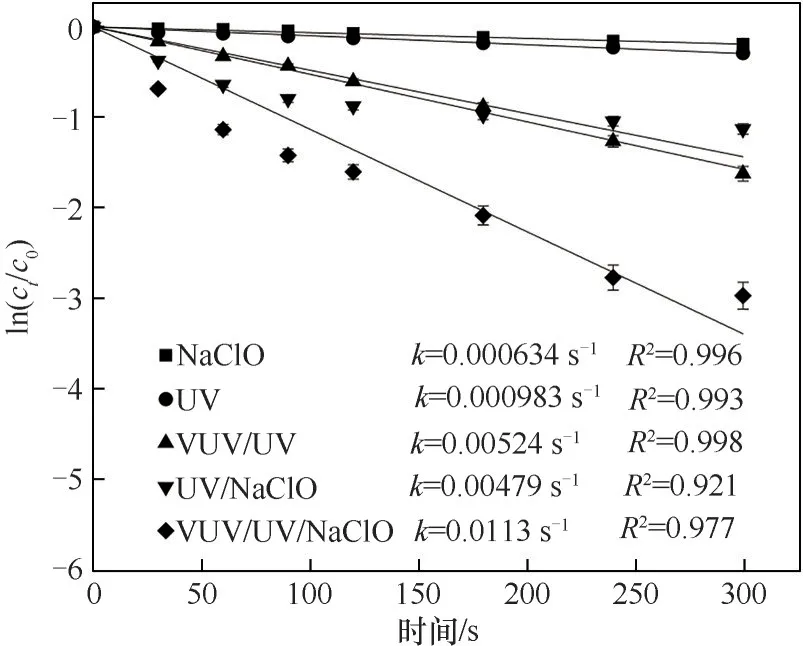
图1 不同工艺中Tml的降解Fig.1 Degradation of Tml in different processes
2.2 NaClO 浓 度 和pH 对VUV/UV/NaClO 和UV/NaClO降解Tml协同效应的影响
2.2.1 NaClO 浓度对Tml 降解协同效应的影响 由于NaClO 的浓度对紫外/氯工艺降解有机污染物有重要影响[34],本文考察了NaClO 浓度对Tml 降解的影响,动力学常数和协同因子随NaClO 浓度的变化如图2所示。
如图2(a)所示,随着NaClO 浓度的增加(0~0.4 mg·L-1),kVUV/UV/Cl和kUV/Cl分 别 由0.00524 s-1和0.000983 s-1增加至0.0113 s-1和0.00479 s-1。一方面,NaClO 作为强氧化剂,在一定程度上可降解多种有机污染物;另一方面,NaClO 经紫外辐射可产生活性自由基,既能有效降解紫外吸光度低的污染物,也能在VUV/UV与UV/NaClO 工艺间获得协同效应,从而提高降解效率[34]。
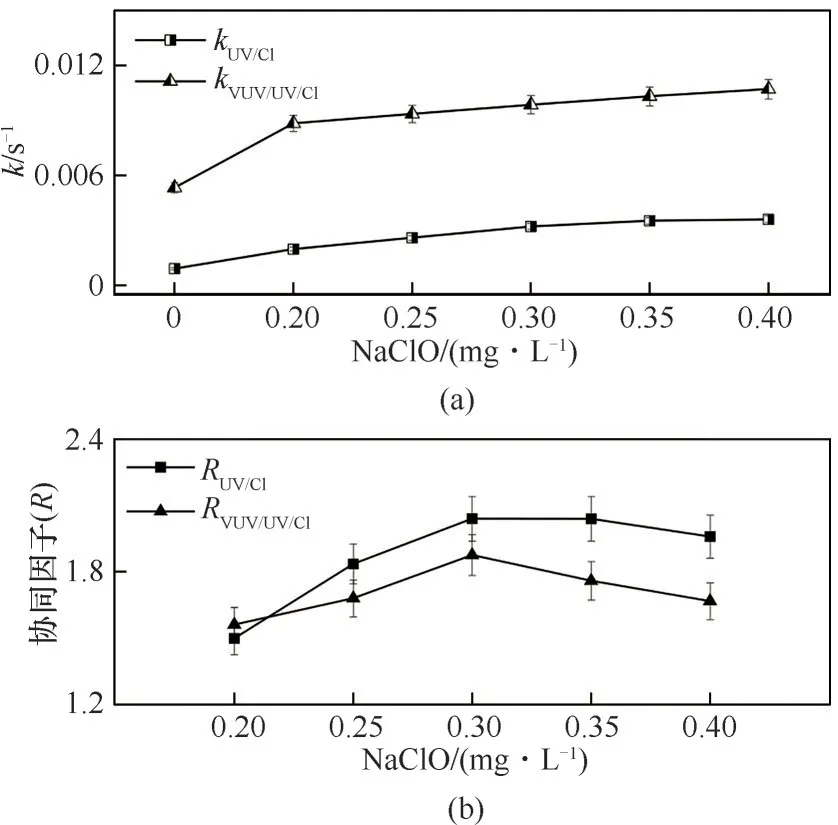
图2 NaClO对VUV/UV/NaClO 和UV/NaClO降解Tml的k(a)和协同因子R(b)的影响Fig.2 Effect of NaClO concentration on the k(a)and R(b)during the Tml degradation by VUV/UV/NaClO and UV/NaClO([Tml]0=3.33 μmol·L-1,pH=7.0(±0.2))
与kVUV/UV/Cl和kUV/Cl的 变 化 趋 势 不 同,RVUV/UV/Cl和RUV/Cl随NaClO 浓度的增大呈现先增加后减少的趋势,变化范围分别在1.6~1.9 和1.5~2.1 之间,对Tml降解的协同增效分别为60%~90%和50%~110%。当NaClO 浓度为0.3 mg·L-1时协同因子R具有最大值,分别是1.9 和2.1[图2(b)]。这主要是因为在低浓度范围内,NaClO 的增加促进了HO·向RCSs 转化的同 时[式(3)~式(5)],也 促 进 了UV 光 解NaClO 生 成RCSs[式(7)~式(12)]和NaClO 对Tml 的直接氧化。而当NaClO 浓度超过0.3 mg·L-1时,过量的NaClO 作为自由基清除剂导致HO·向RCSs 的转化受到抑制[35];此外,HO·反应性强且存在时间非常短,过量HO·易与氢原子(H·)发生反应,还原成H2O,使其浓度降低[式(11)和式(12)][23]。实际上,单独VUV/UV 对Tml 的去除已超过80%,UV/NaClO 最大仅为74%,而VUV/UV/NaClO 均达92% 以上。因此,虽然VUV/UV/NaClO 工艺对Tml 的去除率更高,但其产生的协同效应低于UV/NaClO 工艺。Yang 等[34]采用VUV/UV/NaClO 工艺降解含ATZ 的六种杀虫剂时发现,UV/UV 与UV/NaClO 有明显的协同效应,在低浓度范围内随NaClO 浓度的升高先增加后降低,与本研究所得规律相似。

2.2.2 pH 对Tml 降解协同效应的影响 紫外/氯工艺中溶液的酸碱度对自由基的形成和有机污染物的电离有不同程度的影响[36],本实验探究了不同pH时Tml的降解情况(图3)。

图3 pH对4种工艺降解Tml的k和去除率的影响Fig.3 Effect of pH on the k and removal rate during the Tml degradation by four processes
在酸性范围内(pH<7),VUV/UV 辐射或组合工艺对Tml 降解的拟一级动力学常数k和去除率均随pH 的减小而增加。在碱性范围内(pH>7),k与去除率则随pH 的增大而增加。随着pH 的上升,kVUV/UV/Cl和kUV/Cl呈先减小再增加的趋势,在pH 为7 时kVUV/UV/Cl和kUV/Cl的值最小,分别为0.0113 s-1和0.00479 s-1。这主要是因为pH 越小HO·的氧化还原电位越高[37],并且在酸性条件下HO·具有更高的稳态浓度[38]。同时HClO 的pKa为7.5 时[式(6)],酸性条件更有利于HClO 的形成;而与ClO-相比,HClO 具有更高的紫外吸光度和量子产率[39],从而提高了Tml 在酸性pH 范围内的去除。此外,由于Tml 的结构中含有pKa为10 的酚羟基,在碱性条件下会发生去质子化反应[40],有利于HO·和RCSs 的生成,也抵消了碱度对自由基反应的不利影响,使得k在碱性条件下增大。单独VUV/UV 和UV 降解Tml 时,随着pH由酸性范围过渡到碱性范围,k同样呈现先减后增的变化。
实验表明,组合工艺对Tml 的降解有协同作用(图4)。当溶液pH 为3、5、7、9 和11 时,VUV/UV/NaClO 降解Tml 反应的协同因子RVUV/UV/Cl分别为1.5、1.4、1.9、1.3 和1.4;VUV/UV/NaClO 降解Tml 的协同增效为30%~90%。已知kVUV/UV/Cl和kUV/Cl在pH 为7 时最小,但RVUV/UV/Cl在pH 为7 时具有最大值1.9。在酸性或碱性条件下,UV/NaClO 工艺对Tml 去除率增大,kUV/Cl的增长速度明显快于kVUV/UV/Cl,二者数值差距缩小,使得VUV/UV与UV/NaClO 工艺间的协同效应减弱。由此表明,VUV/UV/NaClO 在中性条件下协同效果最佳。Li 等[36]研究了VUV/UV/Cl 对MB 的降解,同样发现协同因子在中性条件下最大,且弱酸性环境下的协同效应强于弱碱性。
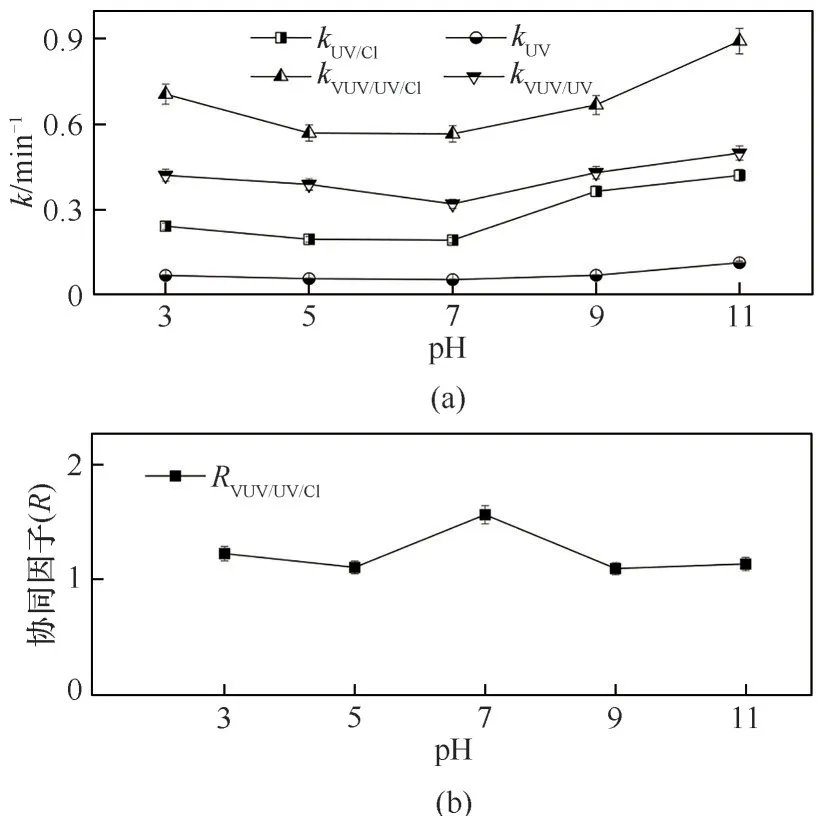
图4 pH对VUV/UV/NaClO和UV/NaClO降解Tml k(a)和协同因子R(b)的影响Fig.4 Effect of pH on the k(a)and R(b)during the Tml degradation by VUV/UV/NaClO and UV/NaClO
2.3 VUV/UV/NaClO 和UV/NaClO 降解Tml 过程中各组分的贡献
两种组合工艺生成的活性自由基导致反应动力学常数及协同因子的不同,因而进一步研究了HO·、Cl·对Tml降解的贡献。
2.3.1 HO·与Tml 的二级反应速率常数及各体系中的稳态浓度 由于水对波长为185 nm VUV 的吸光系数很高(1.8 cm-1)[41],其光辐照能量会被水强烈吸收而产生HO·等活性自由基,因此,VUV辐射对Tml的直接光解作用可以忽略不计。与UV/NaClO 工艺相比,VUV/UV/NaClO 能通过水的直接光解生成HO·[式(13)和式(14)][24],并且能间接产生浓度更高的RCSs降解Tml[式(7)~式(12)]。

由于NB 专一性与HO·反应,因此以其作为HO·的探针化合物(kHO·-NB=3.9×109M-1·s-1)[22,42],计算出HO·与Tml 的二级反应速率常数及反应体系中HO·的稳态浓度。UV、VUV/UV 和(VUV)UV/NaClO降解NB和Tml的动力学分析如图5所示。
由图5可知,VUV/UV和UV对NB和Tml的降解遵循一级动力学模型,其拟一级动力学常数kV/U-NB、kV/U-Tml、kUV-NB和kUV-Tml分别为0.00261 s-1、0.00537 s-1、0.000124 s-1和0.00101 s-1。由于NB 的初始浓度很低(1.22 μmol·L-1),且水对185 nm VUV 的吸光系数足够高,可忽略VUV 对NB 的光解[34,43-44],对NB 的直接光解主要归因于UV 的作用;因此,VUV/UV 和UV对NB和Tml的降解可表示为式(15)和式(16)[34]。


式中,k′HO·-NB和k′HO·-Tml表示HO·与NB 和Tml的二级反应速率常数;[HO·](V/U)ss表示VUV/UV 反应体系中HO·的稳态浓度。
由式(15)可以计算出[HO·](V/U)ss=6.37×10-13mol·L-1,并代入式(16)进而求出HO·与Tml 的二级反应速率常数k′HO·-Tml=6.84×109L·mol-1·s-1。据报道,HO·与有机污染物间的二级反应速率常数为108~1010L·mol-1·s-1之间[7],本文的研究结果(k′HO·-Tml=6.84×109L·mol-1·s-1)符合这一范围。
VUV/UV/NaClO 和UV/NaClO 对NB 的 降 解(图5)常 数kV/U/Cl-NB和kUV/Cl-NB分 别 为0.00287 s-1和0.00115 s-1。由于NB 的低投加量,且NaClO 或RCSs对NB 的降解作用微弱,可以忽略[22,35],反应过程可用式(17)和式(18)表示[45]。
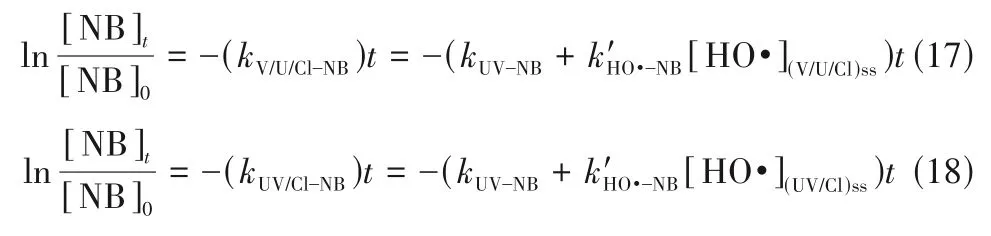
式中,[NB]t、[NB]0分别表示NB 在t时刻的浓度和初始浓度;由式(17)和式(18)可以求出,[HO·](V/U/Cl)ss=7.05×10-13mol·L-1,[HO·](UV/Cl)ss=2.63×10-13mol·L-1。与单独NaClO 氧化和UV 直接光解相比,VUV/UV/NaClO 和UV/NaClO 工艺对Tml 的降解增效主要归因于自由基的有效生成,根据[HO·](V/U/Cl)ss为[HO·](UV/Cl)ss的近3 倍,说明VUV/UV/NaClO 体系生成了更多HO·,导致其对NB的去除率更高。
2.3.2 Cl·与Tml 的二级反应速率常数及各体系中的稳态浓度 采用苯甲酸(BA)作为探针化合物,计算Cl·与Tml 的二级反应速率常数及各反应体系中Cl·的稳态浓度。VUV/UV/NaClO、UV/NaClO 和UV对BA的降解动力学如图6所示。
根据图6 可知,kV/U-BA、kUV-BA分别为0.00449 s-1和0.000153 s-1,kUV/Cl-BA、kV/U/Cl-BA分别为0.00233 s-1和0.00651 s-1。BA几乎不与其他RCSs反应,而其与HO·和Cl·的二级反应速率常数分别为5.9×109L·mol-1·s-1和1.8×1010L·mol-1·s-1[22,32]。此 外,单 独NaClO 和VUV无法降解BA[46],反应可表示为式(19)和式(20):

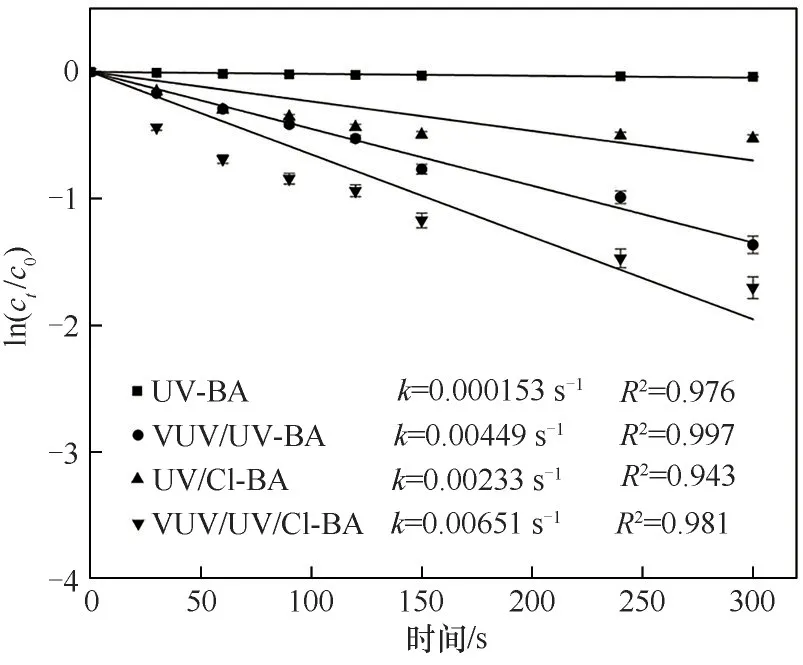
图6 不同工艺对BA的降解Fig.6 Degradation of BA by different processes
式中,kV/U/Cl-BA和kUV/Cl-BA表示VUV/UV/NaClO 和UV/NaClO 降 解BA 的 拟 一 级 动 力 学 常 数;k′HO·-BA和k′Cl·-BA表示HO·和Cl·与BA 的二级反应速率常数;[Cl·](V/U/Cl)ss和[Cl·](UV/Cl)ss表示两种工艺体系中Cl·的稳态浓度。
由式(19)和式(20)可以算出[Cl·](V/U/Cl)ss=1.23×10-13mol·L-1,[Cl·](UV/Cl)ss=3.47×10-14mol·L-1。在两种体系中,[HO·](V/U/Cl)ss为[HO·](UV/Cl)ss的2.7 倍,[Cl·](V/U/Cl)ss比[Cl·](UV/Cl)ss大3.5 倍。这可能是因为VUV 辐射能量更强,光解NaClO 产生了更多的Cl·,并且生成的HO·有一部分转化为Cl·。因此,在两方面因素共同作用下使得VUV/UV/NaClO 对BA 的去除率比UV/NaClO高。
TBA 为自由基清除剂,能与HO·、Cl·快速反应(k′HO·-TBA=6.0×108L·mol-1·s-1,k′Cl·-TBA=3.0×108L·mol-1·s-1),且几乎不与其他活性自由基(O-·、O2-·和·)反应[47]。向VUV/UV/NaClO 和UV/NaClO 反应体系中添加100 mmol·L-1TBA 淬灭反应中的主要自由基,结果见图7。
如图7 所示,kV/U/Cl-Tml、kUV/Cl-Tml和kNaClO-Tml分别为0.0113 s-1、0.00479 s-1和0.000634 s-1。加 入TBA 后两种组合工艺降解Tml 的一级动力学常数kV/U/Cl-Tml,TBA=0.00132 s-1,kUV/Cl-Tml,TBA=0.00128 s-1,上 述反应可用式(21)~式(28)表示[31,34,43]。

图7 VUV/UV/NaClO、UV/NaClO和NaClO对Tml的降解动力学Fig.7 Kinetics of Tml degradation in VUV/UV/NaClO,UV/NaClO and NaClO


式中,k′Cl·-Tml表示Cl·与Tml 的二级反应速率常数;kNaClO-Tml表示NaClO 降解Tml的一级动力学常数;k1,Others和k2,Others分别表示VUV/UV/NaClO 与UV、NaClO体系中其他活性自由基(O-·、O2-·、·和ClO·等)对降解Tml的贡献。
由式(21)~式(24)求得k′Cl·-Tml=3.9×1010L·mol-1·s-1,k1,Others=0.00000682 s-1,k1,HO·-Tml=0.00482 s-1,k1,Cl·-Tml=0.000479 s-1。再通过式(25)~式(28)计算得到k2,HO·-Tml=0.00180 s-1,k2,Cl·-Tml=0.00136 s-1,k2,Others=0.00000995 s-1。由此可知,k′Cl·-Tml>k′HO·-Tml,说明Cl·比HO·更易与Tml反应,且反应速率更快。研究表明RCSs 对烯烃、酚和胺类衍生物及烷基/烷氧基苯等含芳香环的化合物表现出相当强的反应性,虽然Cl·的氧化还原电位(2.4 V)低于HO·,但比HO·更具选择性,能够更快地与Tml结构中富电子基团反应[48]。
实 验 中k1,HO·-Tml显 著 高 于k2,HO·-Tml,但VUV/UV/NaClO 体系中HO·的相对贡献率反而低于UV/NaClO。原因可能是HO·与NaClO 反应生成了RCSs[式(3)~式(5)]。为了验证这一点,将TBA 作为自由基清除剂加入反应体系中(图7)。实验发现,加入足量TBA(100 mmol·L-1)后,kV/U/Cl-Tml,TBA与kUV/Cl-Tml,TBA几乎相等,且均与kUV-Tml非常接近,可以说明加入足量TBA后反应体系中生成的自由基已基本被清除,此时对Tml的降解主要来自UV 直接光解的贡献,而非自由基的作用;而未加TBA 时,kV/U/Cl-Tml明显高于kUV/Cl-Tml,且已知[HO·](V/U/Cl)ss<[HO·](V/U)ss。这初步证明VUV 辐射消耗了一部分HO·与NaClO 反应生成了更多的RCSs,从而使VUV/UV/NaClO 体系中Cl·的相对贡献率更高。
2.3.3 VUV/UV/NaClO 和UV/NaClO 降 解Tml 过 程中各物质的贡献 两种工艺均在相同条件下取得最大协同因子,故进一步考察了VUV/UV/NaClO 和UV/NaClO 降解Tml体系中各物质的贡献值,结果如图8所示。

图8 VUV/UV/NaClO和UV/NaClO工艺中不同物质对Tml的降解的贡献Fig.8 Contribution of different species to Tml degradation in VUV/UV/NaClO and UV/NaClO processes
两种体系中kV/U/Cl-Tml明显高于kUV/Cl-Tml,且k1,HO·-Tml与k1,Cl·-Tml均 大 于k2,HO·-Tml与k2,Cl·-Tml,但 协 同 因 子RVUV/UV/Cl<RUV/Cl。这 可 能 是 因 为Tml 在254 nm UV 处的吸光度较低,UV 只能直接光解一小部分Tml,且无法光解水产生HO·,因此对Tml的去除效果较差;而VUV/UV 降解Tml 时,体系中产生了大量的HO·,对Tml 的去除效率高于UV/NaClO。而kV/U/Cl-Tml是kUV/Cl-Tml与kVUV/UV-Tml的2.3 倍和2.2倍,kUV/Cl-Tml是kUV-Tml和kNaClO-Tml的4.9 倍与7.5 倍,则根据计算知RUV/Cl>RVUV/UV/Cl。故UV/NaClO 降解Tml 时,与NaClO 和UV产生了更加显著的协同增效。但从Tml的去除效果来看,VUV/UV/NaClO工艺明显优于UV/NaClO。
两种工艺中各组分对Tml去除的相对贡献率分别通过其一级反应速率常数(k)在kV/U/Cl和kUV/Cl所占百分比而得,其中自由基的贡献值是利用TBA 和NB及BA 计算出两种工艺体系中HO·和Cl·的稳态浓度([HO·](V/U/Cl)ss、[HO·](UV/Cl)ss、[Cl·](V/U/Cl)ss和[Cl·](UV/Cl)ss),进而 得 到 它 们 与Tml 的 二 级 反 应 速 率 常 数(k′HO·-Tml、k′Cl·-Tml)。将各体系中自由基的稳态浓度与其对应的二级反应速率常数相乘可得两种工艺下自由基降解Tml 的 一 级 反 应 速 率 常 数k(k1,HO·-Tml、k1,Cl·-Tml、k2,HO·-Tml和k2,Cl·-Tml),进而得到两种体系中HO·和Cl·的贡献率;而NaClO 和UV 去除Tml的相对贡献值同样通过计算kNaClO和kUV在kV/U/Cl和kUV/Cl中的占比所得。
VUV/UV/NaClO 反 应 体 系 中HO·、Cl·、UV、NaClO 和其他活性自由基对Tml 降解的贡献率分别为42.7%、42.4%、8.7%、5.6%和0.6%;UV/NaClO 体系中分别为37.6%、28.5%、20.5%、13.2%和0.2%,两种工艺中HO·和Cl·都是主要贡献物质。VUV/UV/NaClO 和UV/NaClO 体系中HO·和Cl·的相对贡献率分别为42.7%、42.4%及37.6%、28.5%。
3 结 论
本文研究了VUV/UV/NaClO 和UV/NaClO 工艺对Tml的降解,得到的主要结论如下。
(1)VUV/UV/NaClO 和UV/NaClO 工艺对Tml的降解都有显著的协同效应,RVUV/UV/Cl为1.6~1.9,协同增效为60%~90%;RUV/Cl为1.5~2.1,协同增效为50%~110%。
(2)NaClO 浓度和溶液pH 对两种工艺降解Tml有不同程度的影响,在[NaClO]0=0.3 mg·L-1或溶液pH=7 时具有最佳协同效果,对应的协同因子RVUV/UV/Cl=1.9和RUV/Cl=2.1。UV/NaClO 降解Tml的协同效应更明显,但VUV/UV/NaClO 对Tml 的去除效果明显优于UV/NaClO。
(3)在pH=7,[NaClO]0=0.3 mg·L-1条件下,VUV/UV/NaClO 工艺中HO·和Cl·的稳态浓度分别为7.05×10-13mol·L-1和1.22×10-13mol·L-1,在UV/NaClO工艺中分别为2.63×10-13mol·L-1和3.47×10-14mol·L-1。两种工艺下以HO·和Cl·为主导的各组分贡献均为:HO·>Cl·>UV>NaClO>其他活性自由基。

