猪链球菌2 型05ZYH33 糖苷水解酶SSU05_1921 和SSU05_1922 的表达纯化及功能研究
卫 东,高广娟,武柳君,朱金鲁,刘思国,刘 冉,张跃灵
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/动物细菌病研究创新团队,黑龙江 哈尔滨 150069)
哺乳动物细胞表面存在大量糖基化的蛋白质和脂类,形成了一层富含碳水化合物的多糖包被,这些多糖除了在细胞自身功能中发挥关键作用外,还为病原微生物提供了营养[1]。N-糖基化是哺乳动物中最常见的蛋白质糖基化形式,许多病原微生物进化出了水解N-聚糖的酶类,从而利用宿主富含碳水化合物的环境,成功定殖和感染宿主[2]。最近有研究显示,肺炎链球菌(Streptococcus pneumoniae)中水解高甘露糖型N-聚糖(High mannose N-glycan)的糖苷水解酶,包括外切α-1,2-甘露糖苷酶SpGH92 和内切β-1,4-N-乙酰氨基葡萄糖苷酶EndoD,二者联合作用可以将高甘露糖型N-聚糖水解。在以高甘露糖型N-聚糖为唯一碳源的培养基中,SpGH92 和EndoD 对肺炎链球菌的生长非常重要,表明这二者在肺炎链球菌利用高甘露糖型N-聚糖获取碳源中发挥关键作用[2]。
猪链球菌(Streptococcus suis,SS)是一种人兽共患病病原,严重威胁养猪业和人类健康[3-5]。SS 的自然定植部位是猪的上呼吸道,可引起猪的急性败血症、脑膜炎、关节炎和死亡,也会引起人的相似感染和死亡[6]。姚火春等发现SS2 ZY05719 菌株中的GH92 和EndoSS 分别与肺炎链球菌糖苷水解酶Sp⁃GH92 和EndoD 同源,二者联合作用时能够使含高甘露糖型N-聚糖的底物RNase B 的分子量减小,并且它们对SS 的毒力及其在宿主血清中的生存具有重要作用,但由于检测手段所限,该研究未详细阐明其糖苷水解酶功能[7]。
本研究采用BLAST 从GenBank 检索到猪链球菌2 型(SS2)中与肺炎链球菌高甘露糖型N-聚糖水解酶SpGH92 和EndoD 同源的蛋白,分别为SSU05_1921 和SSU05_1922 蛋白(后分别简写为1921 和1922)。为了进一步了解SS2 高甘露糖型N-聚糖水解酶的功能和生化特性,本研究表达和纯化了SS2 05ZYH33 菌株的1921 和1922 蛋白,在SDS-PAGE 鉴定二者酶解产物的基础上,结合基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)技术,精确分析了其糖苷水解酶的功能,并鉴定了pH 和金属离子对其酶活性的影响,为进一步研究这二者在SS 感染宿主过程中的作用奠定了基础。
1 材料与方法
1.1 主要实验材料 SS2 05ZYH33 菌株为2005 年四川流行分离株[8];大肠杆菌DH5α 和BL21(DE3)感受态细胞购自TIANGEN 公司;质粒小提试剂盒和DNA胶回收试剂盒购自美国OMEGA 公司; PrimeStarMax聚合酶购自宝生物工程(大连)有限公司;LB 培养基购自美国BD 公司;卡那霉素、IPTG 购自美国Am⁃resco 公司;限制性内切酶和T4 DNA 连接酶购自美国Thermo Scientific 公司;蛋白酶抑制剂购自德国罗氏诊断有限公司;SDS-PAGE 蛋白预制胶购自金斯瑞生物科技有限公司;Ni-NTA 树脂购自美国GE 公司;核糖核酸酶B(RNase B)购自NEB(北京)有限公司。
1.2 1921 和1922 蛋白序列分析和引物设计 以SS2 05ZYH33 基因组(CP000407)注释的蛋白为靶标,采用BLAST,检索分别与肺炎链球菌TIGR4 株糖苷水解酶SpGH92 和EndoD 同源的蛋白。分别采用NCBI Conserved Domain Search、SignalP-5.0 软 件 和TMHMM Server 2.0 分析蛋白的结构域、信号肽和跨膜区。根据1921和1922的DNA 序列,设计扩增1921和1922全长及1922基因中编码GH85 糖苷水解酶催化结构域和CBM32 结构域的1922-Cat基因的引物(表1),由哈尔滨博仕生物公司合成。
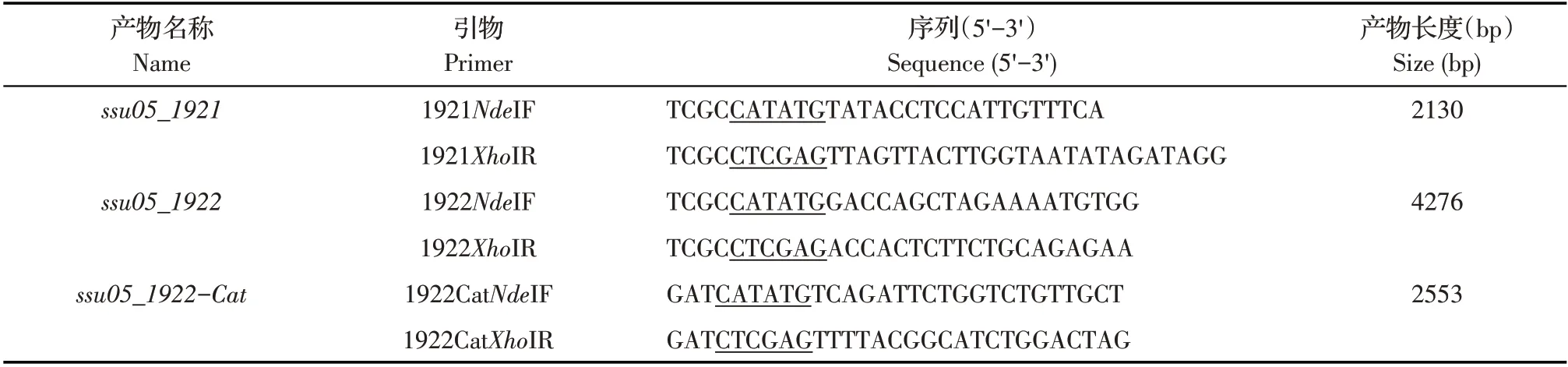
表1 引物信息Table 1 Primers used in this study
1.3 重组表达质粒的构建与鉴定 以提取的05ZYH33 菌株基因组DNA 为模板,分别以表1 中的1921NdeIF/1921XhoIR、1922NdeIF/1922XhoIR 和1922 CatNdeIF/1922CatXhoIR 为引物,经PCR 扩增1921、1922和1922-Cat基因片段。PCR 产物经NdeI 和XhoI双酶切后克隆至pET-28a 载体。构建的重组质粒经NdeI 和XhoI 双酶切鉴定后,经测序鉴定。正确的重组质粒分别命名为pET28a-1921、pET28a-1922和pET28a-1922-Cat。
1.4 重组蛋白的表达及纯化 将1.3 构建的重组质粒转化大肠杆菌BL21(DE3),37 ℃180 r/min 培养至OD600nm为0.6~0.8 加 入 终 浓 度 为1 mmol/L IPTG,16 ℃160 r/min 过夜诱导培养后,离心收集菌体后重 悬 于 结 合 缓 冲 液(20 mmol/L Tris-HCl,pH7.9,150 mmol/L NaCl,20 mmol/L 咪唑)中,冰浴超声破碎后离心,上清液用Ni-NTA 树脂亲和纯化,采用洗涤缓 冲 液(20 mmol/L Tris-HCl,pH7.9,150 mmol/L NaCl,40 mmol/L 咪唑)去除非特异结合的蛋白后,采用250 mmol/L 咪唑洗脱。含有目的蛋白的洗脱产物经超滤柱浓缩后经PD-10 脱盐柱将缓冲液转换为50 mmol/L 磷酸钠(pH7.4),纯化获得1921、1922 和1922-Cat 蛋白。经SDS-PAGE 检测蛋白大小和纯度,并经超微量紫外分光光度计检测蛋白的浓度。对表观分子量与预期分子量不一致的蛋白再经MALDITOF-MS 鉴定。
1.5 各重组蛋白糖苷水解酶功能的鉴定 为了鉴定1921 和1922 蛋白在水解高甘露糖型N-聚糖中的功能,根据文献报道的核糖核酸酶RNase B 去糖基化方法设置以下6 个蛋白反应鉴定[2]:10 μL 反应体系如表2 所示,缓冲液和底物统一分别为1 μL 100 mmol/L HEPES(pH 7.0)和1 μL RNase B(5 mg/mL),添加的蛋白设置为6 个反应体系:1)不加蛋白的反应1;2)只添加1921 蛋白的反应2;3)只添加1922蛋白的反应3;4)添加1921 和1922 两种蛋白的反应4;5)只添加1922-Cat 蛋白的反应5;6)添加1921和1922-Cat 两种蛋白的反应6,最后用ddH2O 补充体积至10 μL,37 ℃水浴12 h 后,通过SDS-PAGE和MALDI-TOF-MS 检测反应后的产物,分析1921、1922 和1922-Cat 蛋白糖苷水解酶的功能。
1.6 pH 值对1921 和1922-Cat 联合作用的影响采用乙酸-乙酸钠分别配制100 mmol/L pH3.0、pH4.0和pH5.0 的缓冲液;采用磷酸氢二钠-磷酸二氢钠配制100 mmol/L pH6.0、pH7.0 和pH8.0 的 缓 冲 液;采用甘氨酸-氢氧化钠配制100 mmol/L pH9.0 和pH10.0的缓冲液。结合1.5得出的结果,RNase B 去糖基反应体系按照表2 中的反应6 进行,除了将其中的HEPES缓冲液换成相应上述不同pH 的缓冲液。37 ℃反应12 h 后,SDS-PAGE 检测产物。根据RNase B 去糖基化的不同程度,分析不同pH 对1921 和1922-Cat 联合作用的影响。
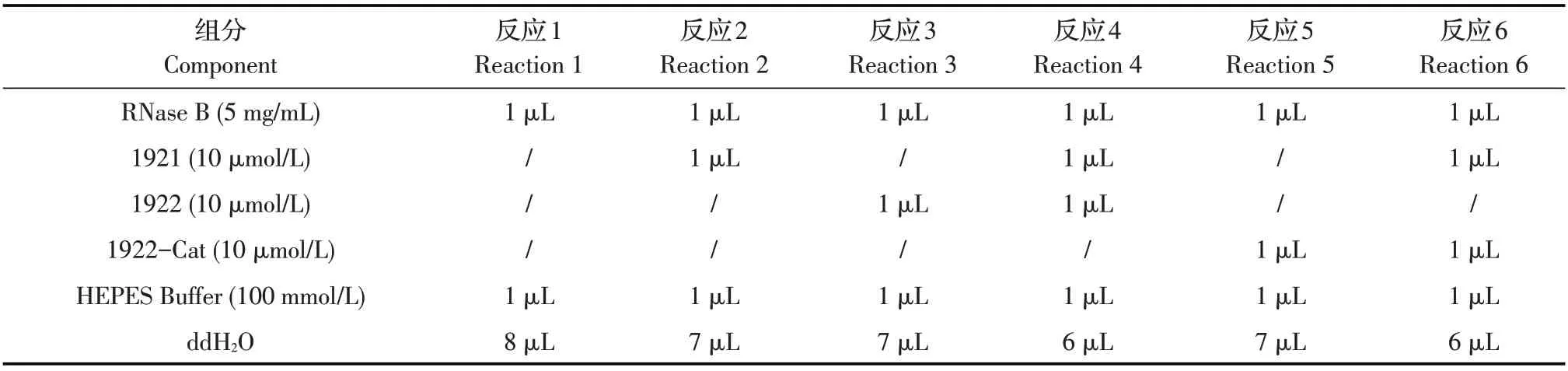
表2 RNase B去糖基化的反应体系(μL)Table 2 Reactions of RNase B deglycosylation(μL)
1.7 金属离子及螯合物对1921 和1922-Cat 联合作用的影响 分别配制50 mmol/L CaCl2、MgCl2、Cu⁃SO4、ZnSO4、NiCl2、KCl 和NaCl 金 属 离 子 溶 液,以及EDTA 和乙二醇双(2-氨基乙基醚)四乙酸(EGTA)螯合物溶液。RNase B 去糖基化反应体系按照表2 中的反应6进行,除了额外加入1 μL的上述金属离子或螯合物溶液,然后用ddH2O 补充体积至10 μL。37 ℃反应12 h 后通过SDS-PAGE 检测产物。根据RNase B去糖基化的程度,分析不同金属离子及螯合物对1921 和1922-Cat 联合作用的影响。
2 结 果
2.1 1921 和1922 蛋白的序列分析 采用BLAST 检索SS2 中与肺炎链球菌TIGR4 株的外切α-甘露糖苷酶SpGH92(SP_2145)和内切β-N-乙酰氨基葡萄糖苷酶EndoD(SP_0498)的同源蛋白。结果显示,二者在SS2 05ZYH33 菌株中分别仅有一个同源蛋白,编号分别为1921 和1922,与TIGR4 SpGH92 和EndoD蛋白氨基酸序列的同源性分别为52% 和56%,表明SS2 中的这两个蛋白与肺炎链球菌的相应蛋白的氨基酸序列存在显著差异。蛋白序列长度也有差别,SpGH92 和EndoD 蛋白分别有694 和1 659 个氨基酸,而1921 和1922 蛋白分别为709 和1 491 个氨基酸。通过分析1921 和1922 的结构域、信号肽和跨膜区,结果显示1921 仅含有一个GH92 糖苷水解酶催化结构域,而无信号肽和跨膜区(图1A)。1922不仅含有N 端GH85 糖苷水解酶催化结构域和相邻的CBM32 碳水化合物结合结构域,其C 端还含有3个未知功能的结构域,分别为Big_3(Bacterial Iglike domain)、TBPIP(Tat binding protein 1(TBP-1)-interacting protein)和G5(G5 domain),另外,1922 的N 末端有一37 个氨基酸的信号肽(SP),C 末端有一个细胞壁锚定结构域(CW)(图1B)。
2.21921、1922和1922-Cat重组表达质粒的构建与鉴定结果 1921蛋白只有一个结构域,对其进行全长克隆(即编码aa1~aa709蛋白的基因序列)(图1A)。1922蛋白含有多个结构域,为了进一步确定其糖苷水解酶的催化结构域,对其分别经PCR扩增(即去除N端信号肽和C端LPXTG结构域后,编码aa38~aa1423蛋白的的基因序列,命名为1922)及编码aa124~aa974蛋白的基因序列即1922-Cat(图1B)。结果显示获得的PCR产物均与预期相符(图2A)。重组质粒经双酶切鉴定插入片段大小正确(图2B),测序序列也均正确。表明正确构建了重组表达载体pET28a-1921、pET28a-1922和pET28a-1922-Cat。

图1 1921(A)和1922(B)蛋白结构域分析及克隆策略Fig.1 Domain analysis and clone strategy of 1921(A)and 1922(B)

图2 1921、1922及1922-Cat的PCR扩增(A)及表达载体的酶切鉴定(B)Fig.2 PCR amplification of 1921,1922 and 1922-Cat(A)anddigestion of the expression plasmid(B)
2.3 重组1921、1922 和1922-Cat 蛋白的表达及纯化 上述重组质粒转化大肠杆菌BL21(DE3),经IPTG诱导表达和纯化后的SDS-PAGE 检测结果显示,获得了高纯度的1921 蛋白,但其表观分子量(约74 ku)与预期分子量84 ku 差距较大(图3A,泳道1)。为了确定获得的蛋白确为1921,对其蛋白条带进行了MAL⁃DI-TOF-MS分析,结果显示,能够检测到全长蛋白的肽段,证实纯化的蛋白确为1921(图3B)。获得的1922 全长蛋白分子量符合预期的162 ku,但因其分子量太大,在纯化过程中一些蛋白被降解,获得的蛋白纯度略差(图3A,泳道2)。获得的1922-Cat蛋白分子量与预期的99 ku 相符,且获得了高纯度的该蛋白(图3 A,泳道3)。经超微量分光光度计检测1921、1922 全长和1922-Cat 蛋白的浓度分别为6.25 mg/mL、3.32 mg/mL、5.88 mg/mL。
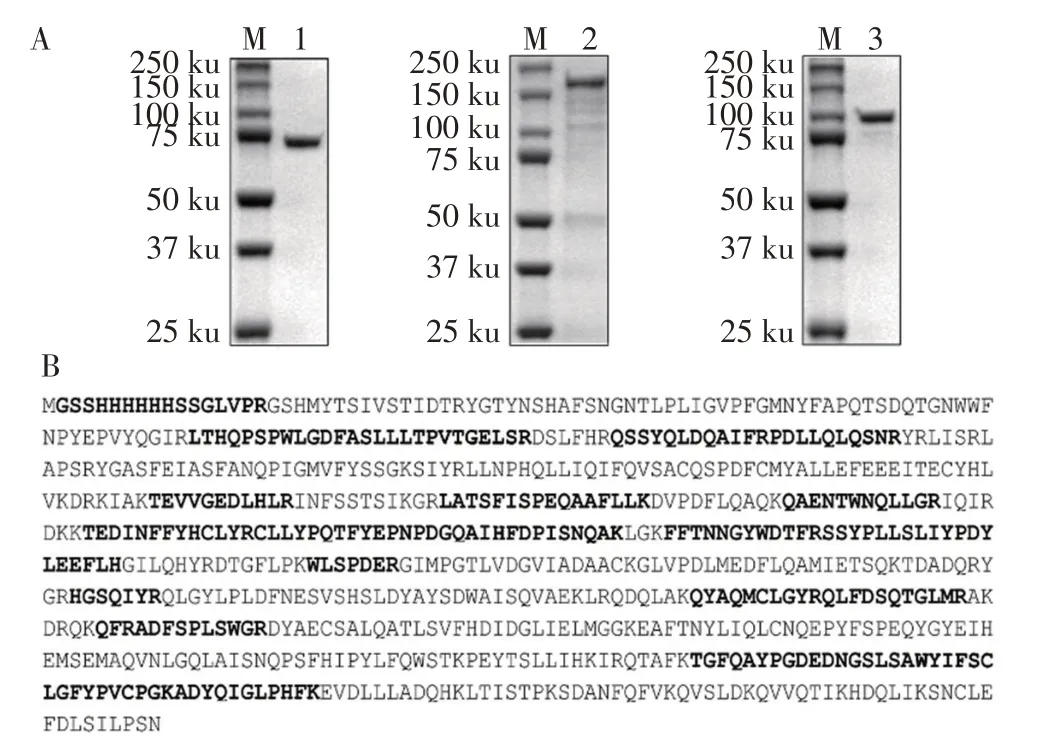
图3 纯化蛋白的SDS-PAGE(A)和1921蛋白的质谱(B)检测结果Fig.3 SDS-PAGE of purified proteins(A)and mass spectrometry of 1921 protein(B)
2.4 1921 和1922 水解高甘露糖型N-聚糖的功能鉴定 RNase B 是多种结构的混合物,分子式分别为R-GlcNAc2-Man9、R-GlcNAc2-Man8、R-GlcNAc2-Man7、R-GlcNAc2-Man6和R-GlcNAc2-Man5(图4A)。RNase B在无任何蛋白作用时(即反应1),SDS-PAGE检测结果显示仅有一条17 ku 的条带(图4B),MALDI-TOF-MS结果显示此时RNase B 有5 种结构,且每种分子之间相差一个糖分子(图4C)。
RNase B经1921单独作用(反应2)后,SDS-PAGE检测结果显示一条约17 ku 的条带(图4B),质谱结果显示其已经全部被水解为R-GlcNAc2-Man5(图4C),表明1921 与其同源蛋白SpGH92 功能相同,水解的是RNase B 高甘露糖型N-聚糖末端的4 个α-1,2-甘露糖残基,是外切α-1,2-甘露糖苷酶。RNase B 经1922 单独作用(反应3)后,SDS-PAGE 结果显示,约有一半的RNase B 能被1922 水解为分子量较小的产物,在15 ku 出现条带(图4B),另外一半未被水解的RNase B 在17 ku 处出现条带(图4B),质谱结果显示RNase B 只有R-GlcNAc2-Man5被水解为R-GlcNAc(图4C)。表明17 ku 处是未被水解分子的混合物, 15 ku 处的分子为R-GlcNAc,更进一步表明1922 与其同源蛋白Endo D 的功能相同,是内切β-1,4-N-乙酰氨基葡萄糖苷酶,内切连接糖链和蛋白链的几丁二糖的β-1,4-N-乙酰氨基葡萄糖苷键,切除含5 个甘露糖残基和1 个乙酰氨基葡萄糖残基的结构(GlcNAc2-Man5),而当含有α-1,2-甘露糖残基时,1922 则不能发挥水解作用。
1921 和1922 联合作用(反应4)于RNase B 的结果显示,此时RNase B 被完全去糖基化,在15ku 出现带一条带(图4B)。该过程为1921 和1922 联合作用于RNase B 的高甘露糖型N-聚糖,即1921 切除RNase B 中的α-1,2-甘露糖残基后,RNase B 只剩下R-GlcNAc2-Man5结 构,1922 再 切 除R-GlcNAc2-Man5的β-1,4-N-乙酰氨基葡萄糖苷键,将其水解为RGlcNAc 结构,从而使RNase B 完全去糖基化。1922-Cat 单独作用(反应5)及其与1921 联合作用(反应6)结果显示,1922-Cat 和1922 全长蛋白的糖苷水解酶功能完全相同(图4B)(反应5 和反应6 均未作质谱检测),表明1922 蛋白中负责糖苷水解酶功能的主要结构域即为1922-Cat。根据该试验结果选择1921 和1922-Cat 联合作用进行后续研究。

图4 RNase B高甘露糖型N-聚糖的结构及其去糖基化后的SDS-PAGE和质谱检测Fig.4 Structures of high-mannose N-glycan of RNase B and detection of their deglycosylation by SDS-PAGE and mass spectrometry
2.5 1921 和1922-Cat 联合作用最适pH 值的测定结果 采用不同的缓冲液分别配置不同pH 值的缓冲液(pH3.0~pH10.0)。除了将反应6(1921+1922-Cat联合作用)中的HEPES 缓冲液换为相应pH 值的缓冲液,其余均按照该反应体系反应12 h 后经SDS-PAGE检测反应产物。结果显示,在pH3.0 时1921 和1922-Cat 联合作用后在约17 ku出现一条单一条带,pH4.0~pH5.0时出现了两条条带,在pH6.0~pH9.0时,主要在15 ku 处出现目的条带(图5)。结合2.4 的结果表明,在pH3.0 时,1921 和1922-Cat 联合作用对RNase B 去糖基化的活性完全受到抑制,未被水解成RGlcNAc;在pH4.0~pH5.0 时,二者的联合作用能够发挥部分活性,只有一部分被水解成R-GlcNAc;在pH6.0~pH9.0 时,二者联合作用的活性较高,且在pH7.0 和pH8.0 该 联 合 作 用 的 活 性 最 高,即1921 和1922-Cat 的联合对RNase B 去糖基化作用的最适pH为7.0~8.0,且RNase B 完全被水解为R-GlcNAc。

图5 pH对1921和1922-Cat联合作用的检测结果Fig.5 Detection results of the effect for pH on the combination of 1921 and 1922-Cat
2.6 金属离子及螯合物对1921、1922-Cat 联合作用影响的检测结果 分别配制二价重金属离子、一价金属离子以及EDTA 和EGTA 螯合物溶液分别加入表2 中反应6(1921+1922-Cat 联合作用)中的反应体系,12 h 后经SDS-PAGE 检测反应产物。结合2.4、2.5 的结果和图的结果显示,二价重金属离子Cu2+、Fe2+、Ni2+、Co2+、Zn2+明显抑制1921 和1922-Cat 的联合作用活性;Ca2+部分抑制1921 和1922-Cat 的联合作用活性;一价离子K+和Na+、金属离子螯合物EDTA 和EGTA 则不能抑制1921 和1922-Cat 的活性(图6)。表明,1921 和1922-Cat 的联合对RNase B 去糖基化的作用不依赖于某些二价金属离子,但是会被一些重金属离子所抑制。
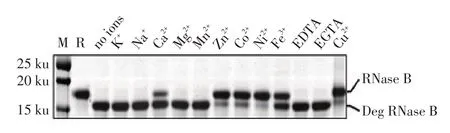
图6 金属离子和螯合物对1921和1922-Cat联合作用的检测结果Fig.6 Detection results of the effect for metal ions and chelates on the combination of 1921 and 1922-Cat
3 讨 论
SS 自然定植于猪的上呼吸道,并可引起猪和人的各种组织感染,在宿主体内获取营养,是其成功定植和感染的关键。病原菌和共生菌通过产生糖苷水解酶,并利用宿主的糖基,是获取碳水化合物营养的一种有效手段[9-10]。在链球菌属中,肺炎链球菌糖苷水解酶的研究较为深入,并在其中发现了一套水解N-聚糖(包括复杂N-聚糖和高甘露糖型N-聚糖)的酶系[2]。目前对SS 相关糖苷水解酶的研究较少[11],姚火春研究团队报道了SS2 ZY05719 菌株中与肺炎链球菌SpGH92 和EndoD 分别同源的蛋白GH92和EndoSS,证实其对SS 的毒力和SS 在宿主血清中的存活具有重要作用,但由于RNase B 底物是多种结构的混合物,SDS-PAGE 无法对其区分,因此他们未对水解产物做精确的分析,也未详细阐释GH92 和EndoSS 的具体功能[7]。基于该研究的基础上,本研究以核糖核酸酶RNase B 为底物对SS2 进行了高甘露糖型N-聚糖水解酶的功能分析及其水解产物的质谱鉴定。
本研究采用BLAST 从SS2 中发现了与肺炎链球菌高甘露糖型N-聚糖水解酶GH92 和EndoD 的同源蛋白1921和1922,通过原核表达并经Ni-NTA 柱亲和层析纯化1921 和1922 蛋白,以及1922 的催化结构域蛋白1922-Cat。但在纯化1921 蛋白的过程中,SDSPAGE结果显示1921蛋白的表观分子量(约74 ku)明显小于理论分子量(84 ku)。根据报道,受氨基酸组成和蛋白变性等的影响,蛋白的表观分子量和理论分子量存在差异也属正常[12],进一步经过质谱鉴定证明纯化的蛋白确为1921 蛋白,酶功能分析也显示1921 与其肺炎链球菌中同源蛋白的功能相同,因此确定本研究中的1921 蛋白确由ssu05_1921基因表达,其异常表观分子量可能与其本身特性有关。
RNase B 是一种天然糖基化蛋白,仅有一个单一的高甘露糖型N-聚糖糖基化位点,且其分子量小,只有17 ku 左右,其糖基切除后分子量变化较明显,能够采用SDS-PAGE 结合MALDI-TOF-MS 检测其糖基化产物,因此常被用于高甘露糖型N-聚糖糖苷水解酶功能研究的底物[2]。本研究采用SDSPAGE 结合MALDI-TOF-MS 检测,确定了1921 为外切α-1,2-甘露糖苷酶,水解高甘露糖型N-聚糖末端的α-1,2-甘露糖苷键。1922 为内切β-1,4-N-乙酰氨基葡萄糖苷酶,水解高甘露糖型N-聚糖中连接糖链和蛋白链的几丁二糖的β-1,4-N-乙酰氨基葡萄糖苷键。因此,尽管这二者分别与肺炎链球菌中的同源蛋白SpGH92 和EndoD 在氨基酸序列上存在显著差异,但与他们的功能相同。本研究还确定了1922 蛋白中的GH85 糖苷水解酶结构域和CBM32 碳水化合物结构域为1922 蛋白水解高甘露糖型N-聚糖的功能域。通过检测不同酸性环境和金属离子对1921 和1922-Cat 联合作用于RNase B 糖基化的影响,确定了1921 和1922-Cat 联 合 作 用 的 最 适pH 值 为7.0~8.0,这与SS 侵染宿主体液的pH 值相符[13]。另外,1921 和1922-Cat 的联合作用不依赖于二价金属离子,但是会被一些重金属离子所抑制,这为进一步研究它们在SS 感染宿主过程中营养获取的机制奠定了基础。
1921 蛋白只有一个GH92 催化结构域,而1922除了有GH85 家族的糖苷水解酶催化结构域和一个与糖基结合有关的CBM32 碳水化合物结合结构域外,还存在5 个其他结构域,分别为信号肽、Big_3、TBPIP、G5 和CW 细胞壁锚定结构域。其具有信号肽和CW细胞壁锚定结构域表明1922是锚定于SS表面的蛋白,而Big_3、TBPIP 和G5 则在结合宿主因子方面发挥作用[14-16],因此表面蛋白1922 很可能具有其他与宿主互作的功能,有待进一步研究证明。
综上,本研究首次较详细探究了SS2 高甘露糖型N-聚糖水解酶的功能和生化特性,为进一步研究SS 感染宿主过程中的营养获取机制奠定了基础。

