宿主因子KRT2影响A型流感病毒复制的研究
王一涵,石文军,李奇兵,胡玉珍,赵玉辉,王广文,严 娅,姜 丽,陈化兰,李呈军
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/农业农村部动物流感重点开放实验室,黑龙江 哈尔滨 150069)
流感是重要的人兽共患病之一,其病原流感病毒可以在人群中迅速传播,从而引起全球范围内的广泛流行[1]。流感病毒不断进化变异,持续产生威胁动物和人类健康的新病毒株。鉴于流感病毒对养殖业发展和公共卫生安全的严重危害,加强流感病毒研究仍是动物疫病防控和保障人类健康的重中之重。流感病毒的复制过程是病毒与宿主因子相互作用的博弈过程,在这个过程中宿主因子对流感病毒感染、致病、传播等生物学特性发挥重要作用[2]。
流感病毒复制高度依赖于宿主细胞。病毒与其宿主之间多方面相互作用决定了感染的结果,包括子代病毒的增殖和致病性。宿主因子可以直接作为与病毒蛋白相互作用的内在限制因子,也可以通过诱导或调节抗病毒细胞因子而间接发挥作用。同时,一些宿主因子也可以通过不同的分子机制来抑制病毒的侵入、脱衣壳、核酸复制或病毒的释放过程,最终导致病毒感染率和发病率的降低。目前已有很多关于宿主蛋白抗病毒功能的研究,例如,TRIM5α 通过与病毒衣壳结合并诱导病毒过早脱衣壳而被广泛用于抑制物种特异性逆转录病毒复制[3];TRIM33 通过降低HIV-1 整合酶功能抑制HIV-1 cDNA整合入宿主细胞基因组[4];PLSCR1 与流感病毒NP 蛋白相互作用,抑制NP 蛋白入核,从而抑制流感病毒复制[5]。角蛋白(Keratin,KRT)可以保护上皮组织细胞免受损伤或压力[6]。Ⅱ型细胞角蛋白由碱性或中性蛋白组成,在上皮组织分化过程中共同表达,参与角蛋白细胞激活、增殖和角蛋白化[7]。宿主因子Ⅱ型角蛋白2(KRT2)是人类染色体12号上的基因,该基因编码的蛋白隶属于纤维结构蛋白家族之一的角蛋白家族。本研究前期通过质谱鉴定的方法筛选到KRT2,其可能与流感病毒复制相关。
本研究通过瞬时转染pCAGGS-KRT2-Myc 质粒过表达以及针对KRT2 基因的特异性siRNA 干扰技术改变KRT2 蛋白的表达水平,检测KTR2 蛋白对流感病毒复制的影响,以期揭示KRT2 对流感病毒复制周期的调控作用。
1 材料与方法
1.1 主要实验材料 HEK293T 细胞和A/WSN/1933(H1N1)株流感病毒为本实验室保存;A549 细胞购自ATCC。pCAGGS-KRT2-Myc 真核表达质粒由本实验室构建;质粒提取试剂盒购于Qiagen 公司;总RNA 提取试剂盒购自天根生化科技(北京)有限公司;HiScript Q RT SuperMix for qPCR、ChamQ SYBR qPCR Master Mix 购自南京诺唯赞生物科技有限公司;转染试剂Lipofectamine 2000 和Lipofectamine RNAi MAX Transfection Reagent 购自Thermo Scientific 公司;siR⁃NA由上海吉玛制药技术有限公司合成;Cell Titer-Glo Luminescent Cell Viability Assay 购 自Promega 公 司;Primestar DNA 聚合酶购自TaKaRa 公司;限制性内切酶和快速连接酶购自NEB 公司;Protein Marker 购自上海雅酶生物科技有限公司;5×蛋白上样缓冲液购自上海碧云天生物科技有限公司;兔抗Myc 多克隆抗体购自金斯瑞生物科技有限公司;兔抗NP多克隆抗体为本实验室制备;兔抗GAPDH多克隆抗体购自Santa Cruz公司;山羊抗兔IgG-Cy5、山羊抗鼠IgG-FITC及鼠抗NP单克隆抗体均购自Li-COR Bioscience公司。
1.2 过表达KRT2 蛋白对流感病毒复制影响的检测
1.2.1 KRT2 蛋白过表达的检测 将1 μg pCAGGSKRT2-Myc 表达质粒和1 μg pCAGGS 空载体质粒按照Lipofectamine 2000 转染试剂说明书分别转染HEK293T细胞。转染24 h后,用MOI 0.01的A/WSN/1933(H1N1)株病毒感染细胞,感染48 h 后加入100 μL 裂解液裂解细胞,经95 ℃处理后,以兔抗Myc 标签抗体(1∶300)为一抗,兔抗GAPDH 多克隆抗体(1∶1 000)作为内参,以山羊抗兔IgG-Cy5(1∶500)为二抗,经western blot 检测KTR2 蛋白过表达情况。
1.2.2 噬斑滴定检测过表达KRT2 蛋白对流感病毒复制的影响 将HEK293T 细胞传代于赖氨酸包被的12 孔细胞培养板中,待其生长至80%融合度后,利用Lipofectamine 2000 转染试剂将pCAGGS-KRT2-Myc(1 μg)表达质粒转染至HEK293T 细胞中,对照组细胞则转染1 μg pCAGGS 空载体质粒。转染24 h 后,利用MOI 0.01 的A/WSN/1933(H1N1)株病毒感染细胞,分别于感染后24 h、48 h 收集细胞上清,参照文献[8]进行噬斑滴定,检测上调表达KRT2 蛋白对流感病毒复制的影响。
1.3 激光共聚焦检测过表达KRT2 蛋白对流感病毒复制的影响 参照1.2.2 中方法转染pCAGGS-KRT2-Myc 于A549 细 胞24 h 后,以MOI 5 的A/WSN/1933(H1N1)株病毒感染,于感染后0、4 h、6 h 分别收集细胞,用4%多聚甲醛固定细胞,0.1% Triton X-100通透处理20 min,5%脱脂乳封闭1 h 后,以鼠抗NP单克隆抗体(1∶500)和兔抗Myc 标签抗体(1∶300)为一抗,山羊抗鼠IgG-FITC(1∶500)和山羊抗兔IgGCy5(1∶500)为二抗,通过激光共聚焦显微镜观察KRT2 蛋白对病毒NP 蛋白表达的影响。
1.4 siRNA干扰下调KRT2蛋白表达后细胞活力的检测及siRNA 筛选 根据NCBI 中的KRT2 基因,设计合成两对针对KRT2 基因的特异性siRNA 和对照NC siRNA,siRNA-1序列为:正链(5'-3'):GCAGCCUCU CAACGUGAAATT/反链(5'-3'):UUUCACGUUGAGAG GCUGCTT;siRNA-2 序列为:正链(5'-3'):GCUGCU ACAACAAAUGAAUTT/反链(5'-3'):AUUCAUUUGUU GUAGCAGCTT;NC siRNA 序列为:正链(5'-3'):UU CUCCGAACGUGUCACGUTT/反链(5'-3'):ACGUGAC ACGUUCGGAGAATT。利用Lipofectamine RNAiMAX试剂将20 pmol(1 μL)对照NC siRNA和两对KRT2特异性siRNA分别转染A549细胞,置于37 ℃培养48 h后,利用细胞活力检测试剂盒CellTiter-Glo kit 检测干扰下调KRT2表达是否影响细胞活力。同时收集转染48 h后细胞样品,采用文献[9]中荧光定量PCR 方法检测KRT2 mRNA 转录水平,筛选干扰效率最佳的siRNA。
1.5 siRNA 干扰下调KRT2 蛋白表达后对流感病毒复制影响的检测
1.5.1 噬斑滴定检测siRNA 干扰下调KRT2 蛋白表达后对流感病毒复制的影响 利用Lipofectamine RNAi MAX Transfection Reagent 将20 pmol(1 μL)对照NC siRNA 和筛选的最佳siRNA 分别转染生长至80%融合度的A549 细胞,48 h 后利用MOI 0.01 的A/WSN/1933(H1N1)株病毒感染细胞,分别于感染后24 h、48 h 收集细胞上清进行噬斑滴定[8],检测下调KRT2蛋白表达对流感病毒复制的影响。同时,在倒置荧光显微镜下观察感染48 h 后对照组和干扰组A549 细胞的病变情况,进一步分析下调KRT2 蛋白表达对流感病毒复制的影响。
1.5.2 siRNA 干扰下调KRT2 蛋白表达影响流感病毒蛋白表达水平的检测 将20 pmol(1 μL)对照NC siRNA和最佳KRT2 特异性siRNA 分别转染A549 细胞。48 h后用MOI 5 的A/WSN/1933(H1N1)株病毒感染细胞,分别在感染后0、4 h、6 h、8 h 在每孔中加入300 μL IP 裂解液,冰上裂解1 h,收集裂解的细胞,4 ℃离心10 min 取上清,95 ℃处理后,以兔抗NP 多克隆抗体(1∶500)为一抗,兔抗GAPDH 多克隆抗体(1∶1 000)作为内参,DyLight680羊抗兔IgG(1∶10 000)为二抗,经western blot 检测siRNA 干扰KTR2 蛋白对流感病毒NP 蛋白表达的影响。
1.6 激光共聚焦检测KRT2 蛋白对流感病毒复制早期阶段的影响 按1.5.1 转染siRNA 后以MOI 5 的A/WSN/1933(H1N1)病毒感染A549 细胞后4 h、6 h、8 h 收集细胞,按照1.3 方法,通过激光共聚焦试验观察KRT2 蛋白对病毒NP 蛋白入核的影响。
1.7 试验数据的统计分析 采用GraphPad Prism 5.0软件进行统计学处理,以t检验比较组间差异。ns表示P>0.05,差异不显著;* 表示P<0.05,差异显著;**表示P<0.01,差异极显著。
2 结 果
2.1 过表达KRT2蛋白对流感病毒复制影响的检测结果 将pCAGGS-KRT2-Myc真核表达质粒转染至HEK 293T细胞中,western blot 检测结果显示,转染细胞中KTR2蛋白表达水平明显提高(图1A)。用MOI 0.01的A/WSN/1933(H1N1)株病毒感染转染24 h 后的HEK293T细胞,分别于感染后24 h、48 h收集细胞上清进行噬斑滴定,结果显示,在病毒感染后的24 h、48 h,过表达KRT2蛋白的实验组相比于转染pCAGGS空载体的对照组,流感病毒的滴度均极显著下降(P<0.01)(图1B)。上述结果表明过表达KRT2可以抑制流感病毒复制。
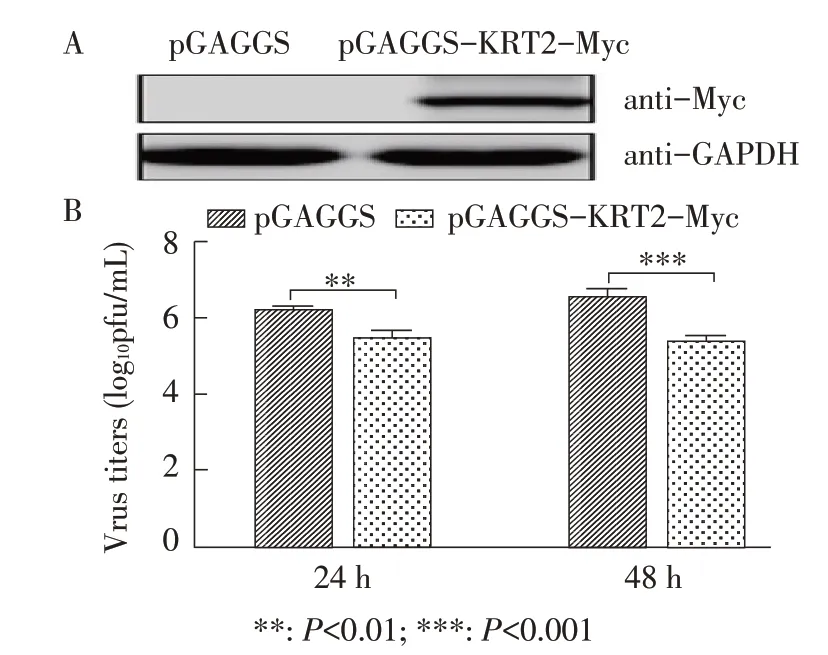
图1 过表达KRT2 蛋白western blot(A)和病毒噬斑滴定(B)检测结果Fig.1 Western blot of KRT2 protein expression(A)and virus titer detection by plaque assay(B)in MDCK cells
2.2 激光共聚焦检测过表达KRT2蛋白对流感病毒复制影响的结果 进一步利用激光共聚焦显微镜观察感染后0、4 h、6 h的过表达KRT2蛋白的细胞,结果显示,KRT2蛋白过表达后,在4 h时流感病毒NP蛋白向细胞核内的聚积受到了抑制(图2),初步表明KRT2蛋白可能在流感病毒复制早期发挥抑制作用。
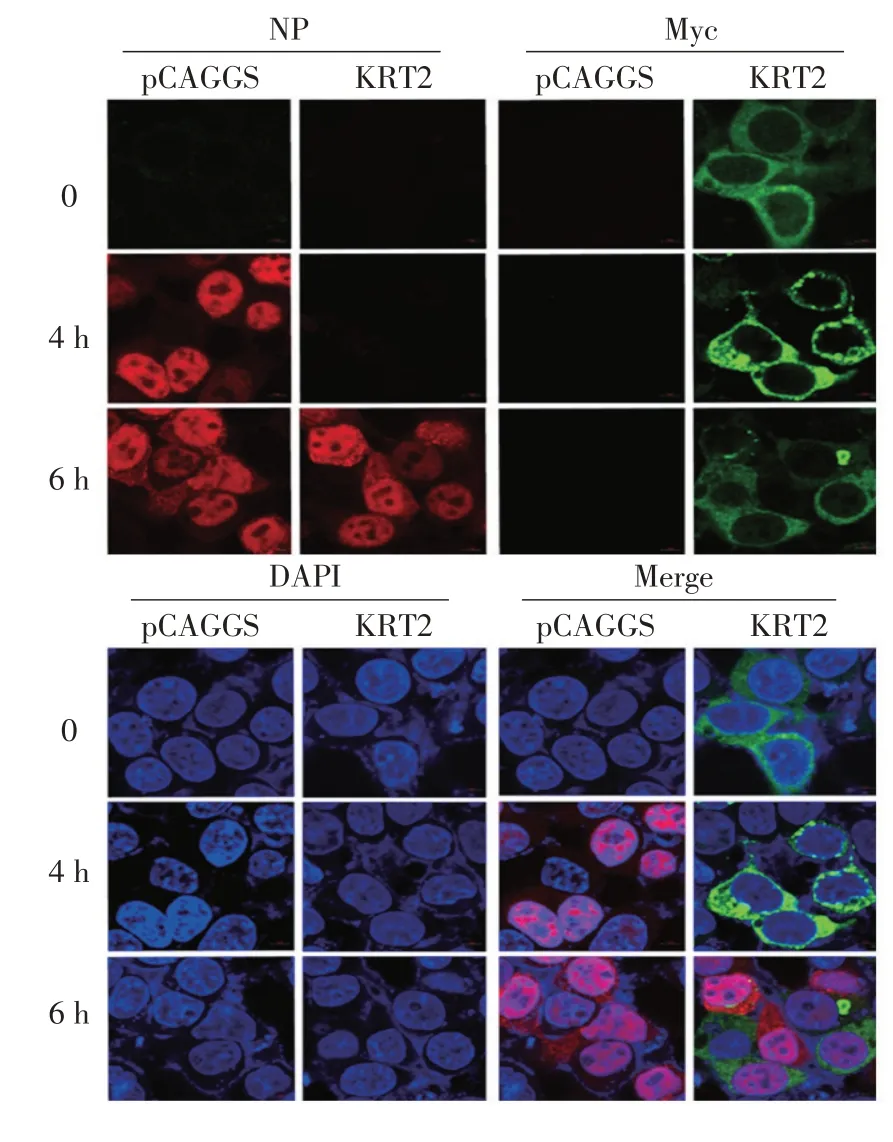
图2 激光共聚焦分析KRT2 蛋白过表达对流感病毒复制的影响Fig.2 Effect of KRT2 overexpression on influenza virus replication was analyzed by CLSM
2.3 siRNA 下调KRT2 蛋白表达后细胞活力的检测及siRNA 筛选 利用Lipofectamine RNAi MAX Trans⁃fection Reagent 将两条特异性siRNA 和对照NC siRNA分别转染A549 细胞,进行细胞活力检测,结果显示,转染组细胞活力与对照组相比无显著性差异(P>0.05)(图3A)。
利用Lipofectamine RNAi MAX Transfection Reagent将特异性siRNA-1/2 和对照NC siRNA 分别转染A549细胞后,利用荧光定量PCR 的方法分别检测两条KRT2 siRNA 的干扰效率。结果显示,与对照组比较,两条KRT2 siRNA 均可以极显著下调A549 细胞内KRT2蛋白的表达(P<0.01),其中siRNA-2下调效率最高(图3B)。因此本实验选择siRNA-2进行后续试验。
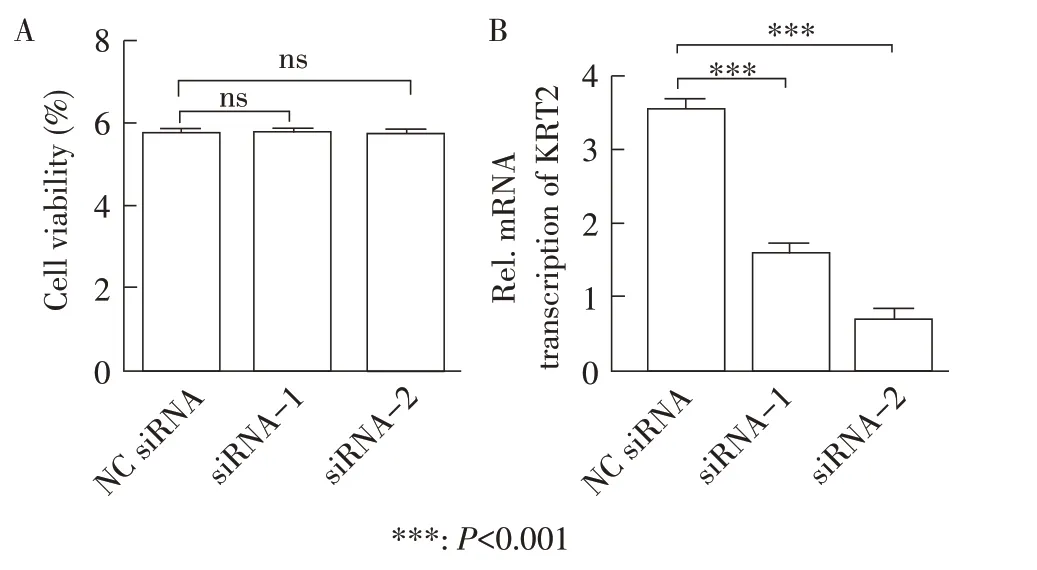
图3 细胞活力(A)及siRNA干扰效率(B)检测Fig.3 Detection results of siRNA-treated A549 Cell viability(A)and siRNA interference efficiency(B)
2.4 siRNA 干扰下调KRT2 蛋白表达后对流感病毒复制影响的检测结果 以MOI 0.01 的A/WSN/1933(H1N1)株病毒感染siRNA 干扰后的细胞,收集细胞上清,进行噬斑滴定,结果显示,相比于对照组,干扰组流感病毒的滴度在感染后不同时间均显著升高(P<0.01)(图4A)。为了进一步验证该结论,检测A/WSN/1933(H1N1)株病毒感染后0、4 h、6 h、8 h NP蛋白的表达情况,结果显示,KRT2蛋白表达下调后流感病毒NP蛋白的表达水平在感染后各时间点均高于对照组(图4B)。A/WSN/1933(H1N1)株病毒感染48 h后镜下观察细胞病变情况,发现相比对照组细胞,干扰组的细胞病变更明显(图4C)。综上所述,表明下调KRT2蛋白表达可提高流感病毒的复制水平。
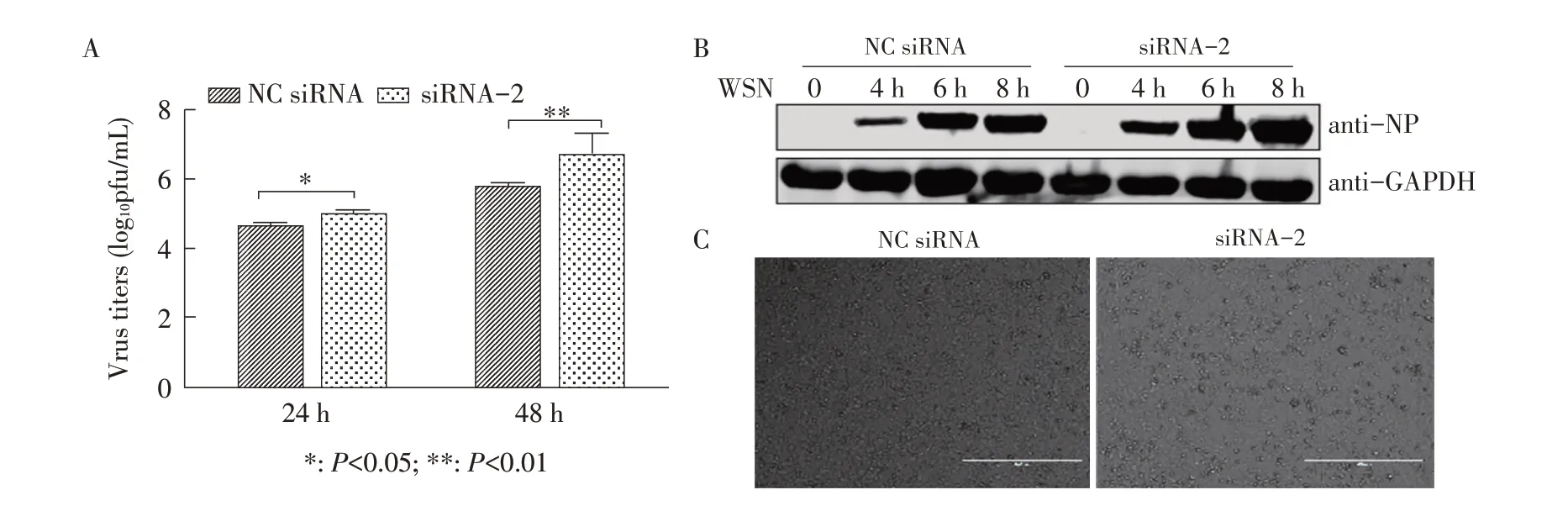
图4 siRNA下调KRT2蛋白表达后对流感病毒复制影响的检测结果Fig.4 The results of the replication of influenza virus by down-regulating KRT2 protein
2.5 激光共聚焦检测下调KRT2 蛋白表达对流感病毒复制影响的结果 于流感病毒感染siRNA-2 干扰组和对照组A549 细胞后各时间点,收获样品进行激光共聚焦检测,结果显示转染KRT2 siRNA-2 的A549细胞在感染病毒4 h 后,NP 蛋白在细胞核内聚积的比例相比转染对照NC siRNA 的A549 细胞明显升高;感染6 h 后,对照细胞内新合成的NP 蛋白主要聚集在细胞核周围,而在干扰组的A549 细胞中新合成的NP 蛋白则明显聚积于细胞核内;在感染8 h后,对照细胞内的NP 蛋白在细胞核和细胞质均有分布,而在干扰组A549 细胞中NP 蛋白已经被完全输出细胞核并在细胞质膜聚积,表明子代核糖核蛋白复合体(vRNP)已经运输到细胞质膜包装位点(图5)。上述数据进一步表明,KRT2 蛋白抑制流感病毒复制的早期阶段,从而导致病毒整个复制周期的延迟。
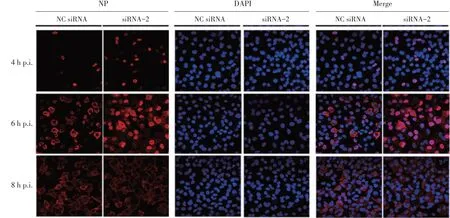
图5 激光共聚焦检测KRT2蛋白对流感病毒复制早期阶段影响的结果Fig.5 The effect of KRT2 protein on the early stage of influenza virus replication by CLSM
3 讨 论
本实验采用噬斑滴定、western blot、激光共聚焦技术研究了宿主因子KRT2 对A 型流感病毒复制的影响,结果显示,过表达KRT2 蛋白可以下调流感病毒的复制。相反,干扰KRT2 蛋白的表达后可以上调流感病毒的复制。此外,通过激光共聚焦实验证明KRT2蛋白最有可能参与了流感病毒复制的早期阶段。
在流感病毒复制的早期阶段,病毒识别和结合宿主细胞表面的唾液酸受体,通过受体介导的内吞作用进入细胞,流感病毒可通过网格蛋白介导的以及网格蛋白和小窝蛋白非依赖的内吞途径感染细胞[10]。细胞内吞包括吞噬作用和胞饮作用[11]。吞噬作用通常是指特定细胞消化大颗粒和细菌,如巨噬细胞;胞饮作用是指负责细胞对液体、大分子和病毒等小病原体的吸收[12]。胞饮作用涉及几个不同的机制:巨胞饮、网格蛋白介导的内吞作用、小窝蛋白介导的内吞作用,以及不依赖网格蛋白和小窝蛋白的通路。网格蛋白介导的内吞作用是依赖受体和结合配体的浓度进入网格蛋白包裹的囊泡发生的[8]。在内吞体的酸性环境中病毒囊膜与内吞体膜融合,而后经过脱壳过程,病毒vRNP 复合体与基质蛋白M1解离后释放到细胞质中,最终经过经典的细胞核输入途径进入细胞核[13]。本研究发现KRT2 可能影响流感病毒复制的早期阶段,但是KRT2 蛋白影响流感病毒复制早期阶段中的具体环节仍有待深入研究。由于目前针对KRT2 家族蛋白与病毒复制之间的研究仍然很少,因此,本研究下一步针对宿主因子KRT2 与流感病毒复制的早期阶段之间的关系进行研究,以期发现宿主因子KRT2 调控流感病毒复制的分子机制,深化对宿主因子影响流感病毒复制机制的认知。

