2011—2020年上海地区肠球菌属细菌耐药性变迁
辛 玲,郭 燕,朱德妹,胡付品,周春妹,王传清,应春妹,曹文俊,庄亦晖,方 毅,蔡金凤,林 勇,袁轶群0,朱 旻,汤 瑾,李妮娅,刘庆中,张 泓,孙康德,瞿跃红,潘秋辉,张灏旻,卫颖珏0,孙景勇,刘 瑛,孙 晴,李 丽,奚 卫,娄加陶,袁应华,张雯雁,郭 建,侯伟伟0,余方友,周 浩,吴亚洲,胡 骏,乔 昀,陈君灏,王海英,杨乐园,李志兰,刘 云0,胡海清,王 敏,沈振华,李 娜,钱敏健,龚 炜,唐群力,汪瑞忠,赵 芳,范惠清0,黄 韵,张 立,戴俊华,邓燕燕,侯彦强,林 勇,沈 稳,孙 杰,胡 江,王 蓉0,刘淑芬,徐玉梅
肠球菌作为医院内感染的条件致病菌,已从低毒力的良性共生菌发展为医学上重要的多重耐药菌,造成严重的公共健康威胁[1]。CHINET 2020年监测数据显示,肠球菌属细菌在革兰阳性菌中的分离率仅次于金黄色葡萄球菌,居第二位[2],因此,对其进行长期耐药性监测获得的结果对临床抗感染治疗具有重要意义。本研究总结2011—2020年上海地区肠球菌属细菌耐药性,为指导临床合理使用抗菌药物提供依据。
1 材料与方法
1.1 材料
1.1.1 细菌来源 收集2011年1月1日—2020年12月31日上海市细菌真菌耐药监测网62所临床医学机构常规送检标本中分离获得的肠球菌属临床分离株,剔除同一患者相同部位的重复菌株,按监测网要求的统一技术方案进行肠球菌属细菌对抗菌药物的敏感性试验。
1.1.2 试验材料 抗菌药物药敏试验中使用的抗菌药物纸片主要为英国OXOID公司和美国BBL公司产品,仪器法使用的商品化板条为法国生物梅里埃公司VITEK、美国BD公司Phoenix等的产品。万古霉素和利奈唑胺E试验条为法国生物梅里埃公司和中国温州康泰公司产品。培养基纸片法药敏试验用MH琼脂为英国OXOID公司产品。
1.2 方法
1.2.1 试验方法 药敏试验按上海市细菌真菌耐药监测网技术方案,采用自动化仪器法或纸片扩散法进行药敏测定,万古霉素或利奈唑胺不敏感菌株进行菌种鉴定后再采用E试验条复核最低抑菌浓度(MIC)。质控菌株为粪肠球菌ATCC 29212。
1.2.2 结果判断 结果判断参照2020年美国临床和实验室标准化协会(CLSI)M100文件推荐的判断标准[3]。
1.2.3 统计学分析 药敏数据采用WHONET 5.6软件进行统计分析。
2 结果
2.1 细菌分布
2.1.1 菌种分布 2011—2020年上海地区62所临床医疗机构共分离到肠球菌属细菌113 391株,其中粪肠球菌54.5%(61 770/113 391),屎肠球菌40.1%(45 423/113 391),其他肠球菌5.4%。历年粪肠球菌在当年肠球菌属细菌中的占比从2011年的50.5%上升至2020年的52.9%,历年屎肠球菌在当年肠球菌属细菌中的占比从2011年的44.3%锯齿状下降至2020年的41.0%。见表1。

表1 2011—2020年上海地区肠球菌属菌种分布Table 1 Species distribution of Enterococcus isolates over the period from 2011 to 2020 in Shanghai[n(%)]
2.1.2 标本分布 该菌属细菌主要分离自尿液标本(59.9%,67 967/113 391)、胆汁和胸腹水等标本(10.5%)、血液标本(7.9%)、伤口标本(4.4%)、呼吸道标本(3.9%)等。其中尿液标本中粪肠球菌和屎肠球菌为主,分别占54.7%(37 182/67 967) 和42.6%(28 954/67 967)。粪肠球菌在胆汁和胸腹水、血液、伤口、呼吸道、脑脊液与生殖道标本中的检出数量均高于屎肠球菌。见表2。

表2 2011—2020年万古霉素和利奈唑胺耐药肠球菌分布Table 2 Species distribution of vancomycin-resistant and linezolid-resistant Enterococcus isolates over the period from 2011 to 2020% (n/N)
2.2 肠球菌属细菌对抗菌药物的敏感率和耐药率
2.2.1 历年肠球菌对抗菌药物的敏感性 除利奈唑胺外,粪肠球菌对其他抗菌药物的历年耐药率均较屎肠球菌低,并基本呈下降趋势。屎肠球菌对氨苄西林、左氧氟沙星和呋喃妥因的历年耐药率呈上升趋势,对高浓度庆大霉素的耐药率由2011年的60.3%下降至2020年的39.8%。粪肠球菌和屎肠球菌对万古霉素历年耐药率分别为0~1.9%和0.2%~3.5%,对利奈唑胺的历年耐药率分别为0~1.8%和0~0.8%。见表3。其他肠球菌属细菌(包括鸟肠球菌、铅黄肠球菌、鹑鸡肠球菌和坚韧肠球菌等)对抗菌药物的敏感性见表4。
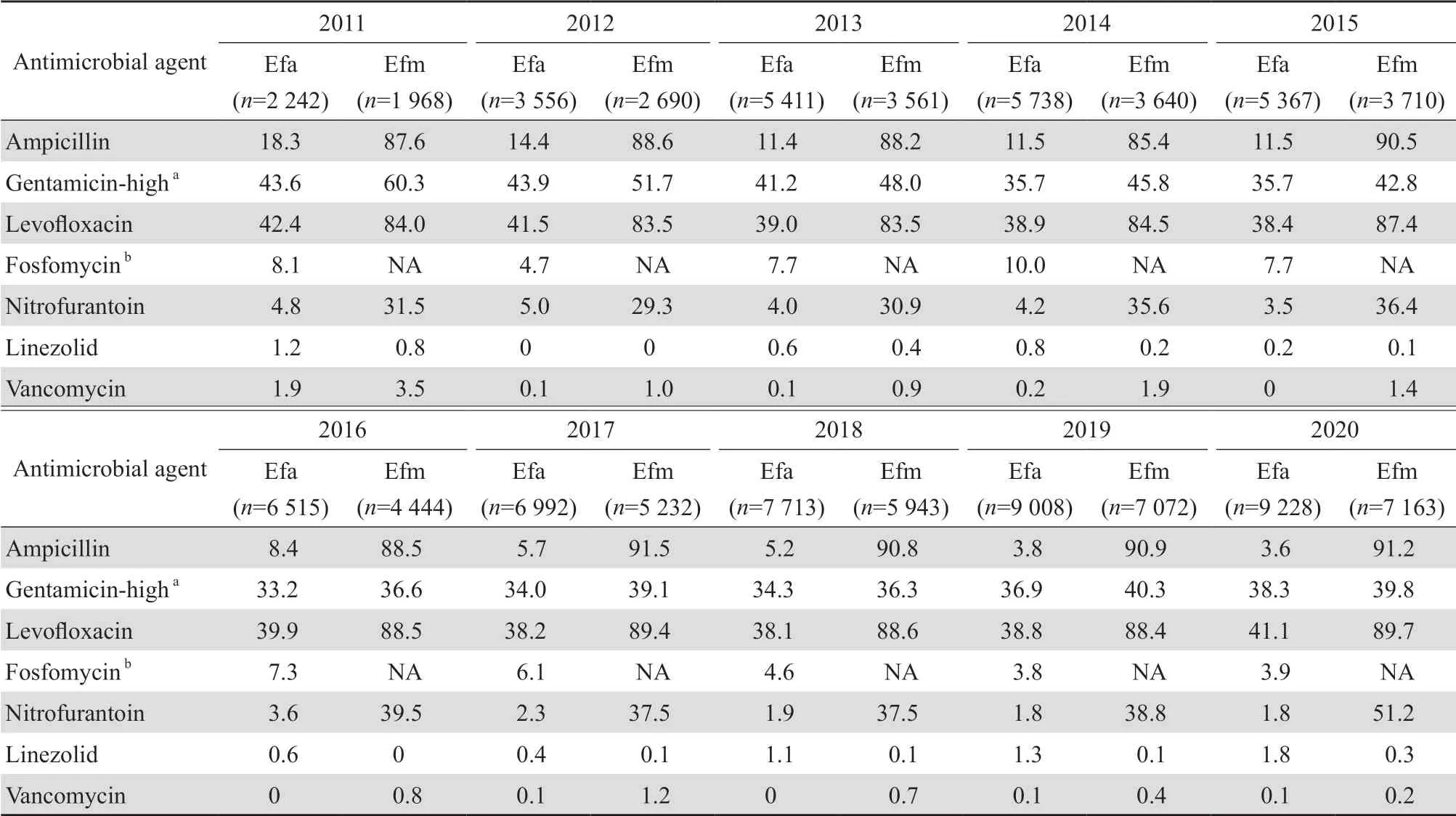
表3 2011—2020年上海地区粪肠球菌和屎肠球菌对抗菌药物耐药率的变迁Table 3 Resistant rates of Enterococcus faecalis and Enterococcus faecium to antimicrobial agents in Shanghai from 2011 to 2020(%)

表4 2011—2020年上海地区其他肠球菌属细菌对抗菌药物的敏感率和耐药率Table 4 Susceptibility of other Enterococcus species to antimicrobial agents in Shanghai from 2011 to 2020 (%)
2.2.2 不同科室分离肠球菌的耐药率 ICU患者送检标本分离的粪肠球菌对氨苄西林、呋喃妥因和左氧氟沙星的耐药率均高于门急诊和非ICU患者送检标本中分离菌株的耐药率,见表5。粪肠球菌对万古霉素和利奈唑胺的耐药率均<2%。门急诊患者送检标本中分离的粪肠球菌较屎肠球菌对利奈唑胺的耐药率更高。
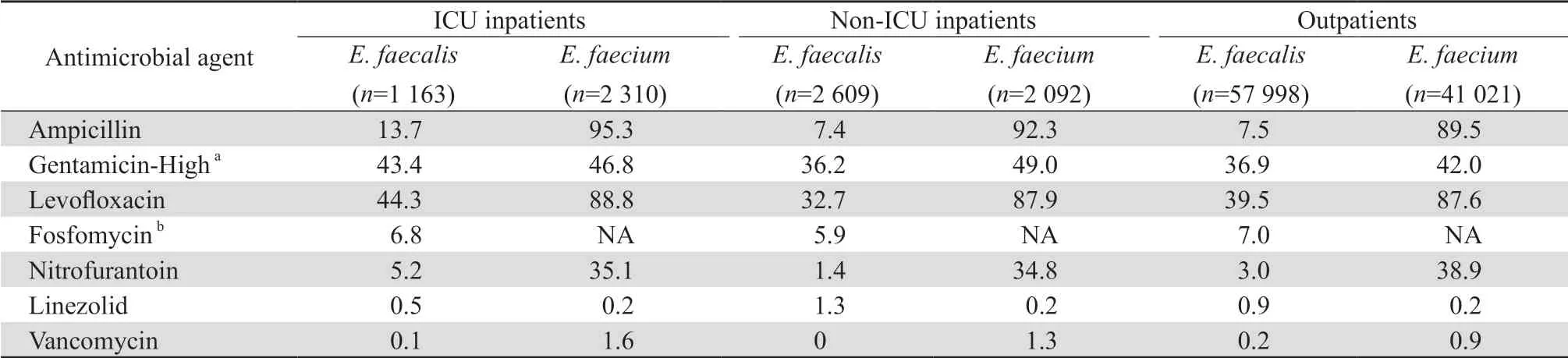
表5 2011—2020年门急诊患者与住院患者粪肠球菌和屎肠球菌对抗菌药物的耐药率Table 5 Resistance rates of Enterococcus faecalis and Enterococcus faecium to antimicrobial agents in various departments from 2011 to 2020(%)
541株万古霉素耐药肠球菌(VRE)包括万古霉素耐药屎肠球菌434株和万古霉素耐药粪肠球菌107株。其中434株万古霉素耐药屎肠球菌主要集中在ICU(95株,21.9%)、急诊科(24株,5.5%)与血液科(23株,5.3%),而107株万古霉素耐药粪肠球菌主要集中在泌尿外科(8株,7.5%)、ICU (5株,4.7%)与血液科(5株,4.7%)。
2.2.3 三级医院与二级医院肠球菌对抗菌药物的敏感率和耐药率 结果显示,三级医院送检标本分离的粪肠球菌对氨苄西林、呋喃妥因和利奈唑胺的耐药率均高于二级医院,对其他抗菌药物的耐药率均低于二级医院。三级医院送检标本分离的屎肠球菌对万古霉素的耐药率高于二级医院,对其他抗菌药物的耐药率均低于二级医院。见表6。
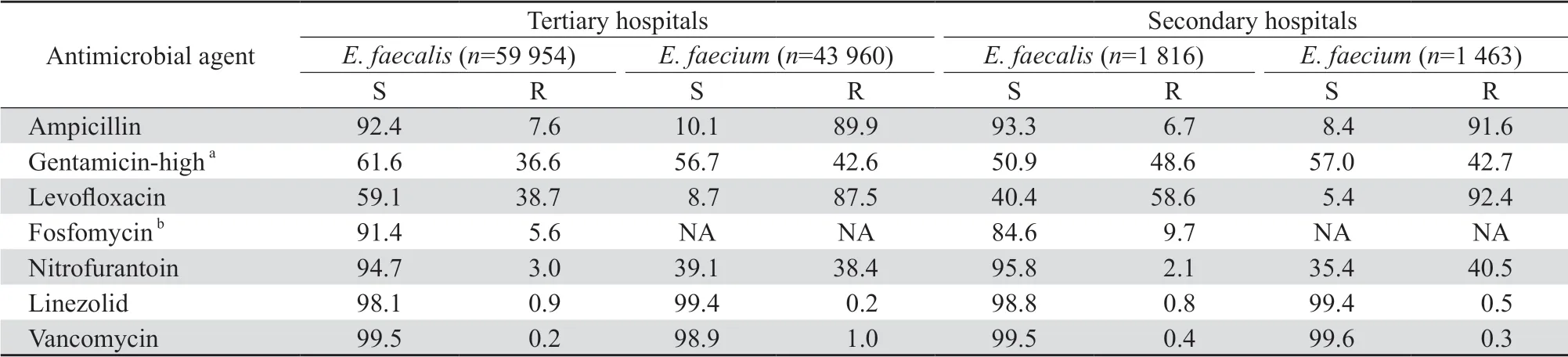
表6 2011—2020年上海地区三级医院与二级医院分离肠球菌对抗菌药物的敏感率和耐药率Table 6 Susceptibility of Enterococcus faecalis and Enterococcus faecium to antimicrobial agents in tertiary and secondary hospitals in Shanghai from 2011 to 2020(%)
3 讨论
2011—2020年上海地区肠球菌耐药性监测显示以下特点:①粪肠球菌是肠球菌属中最常见的细菌,占54.5%;屎肠球菌是第二常见细菌,占40.1%。②粪肠球菌主要分离自门诊患者标本,其次为非ICU住院患者与ICU患者标本;屎肠球菌亦主要分离自门诊患者送检标本,其次为ICU患者与非ICU住院患者标本。③尿液标本是肠球菌分离率最高的标本,其次为胆汁、胸腹水和血液标本。④除利奈唑胺外,屎肠球菌对其他抗菌药物的耐药率均高于粪肠球菌;粪肠球菌对万古霉素和利奈唑胺的历年耐药率分别为0~1.9%和0~1.8%;屎肠球菌对万古霉素和利奈唑胺的历年耐药率分别为0.2%~3.5%和0~0.8%。⑤分离自ICU患者的粪肠球菌对氨苄西林、呋喃妥因和左氧氟沙星的耐药率均高于分离自门急诊和非ICU患者。除利奈唑胺外,分离自ICU、门急诊、非ICU患者的屎肠球菌对抗菌药物的耐药率均较粪肠球菌高。⑥粪肠球菌对万古霉素的耐药率和屎肠球菌对利奈唑胺的耐药率,三级医院均低于二级医院。
万古霉素等糖肽类药物一直是治疗肠球菌属细菌感染的有效药物,但随着这些抗菌药物在临床应用,对其耐药菌株所致感染呈增多趋势。1988年法国报告了第1例万古霉素耐药肠球菌之后,1997—2016年全球范围内屎肠球菌对万古霉素的耐药率出现上升趋势,其中美国高达21.0%,欧洲为9.9%[1]。本组资料显示,屎肠球菌对万古霉素的历年耐药率为0.2%~3.5%,低于上述报道中数据。同时,本组资料亦显示万古霉素耐药粪肠球菌在2011年肠球菌属细菌中检出率为1.9%,此后一直维持在≤0.2%的水平;而万古霉素耐药屎肠球菌在2011年肠球菌属细菌中的检出率达到最高(3.5%),在2020年肠球菌属细菌中检出率为0.2%,但整体呈下降趋势。此外,2015—2016年我国北京、杭州、武汉等主要城市三级甲等医院住院患者分离出的肠球菌中,万古霉素耐药粪肠球菌和屎肠球菌检出率分别为0.4%和1.6%[4],2017—2018年万古霉素耐药粪肠球菌和屎肠球菌检出率分别为0.3%和1.1%[5],本组资料的结果均低于上述报道中数据。
2011—2020年粪肠球菌对利奈唑胺和万古霉素的耐药率呈锯齿状变化,其中对利奈唑胺的耐药率自2017年起逐渐上升至2020年的1.8%,而对万古霉素的耐药率,除2011年为1.9%,其余年份均为≤0.2%。2011—2020年屎肠球菌对利奈唑胺耐药率同样呈锯齿状变化,除2011年为0.8%,其余年份均≤0.4%;屎肠球菌对万古霉素的耐药率2011年为3.5%,近年呈逐渐下降趋势。文献报道,肠球菌对万古霉素的耐药机制是携带vanA、vanB或vanM基因,其中vanA是亚洲最常见的VRE类型。2006—2014年上海地区分离的VRE菌株对利奈唑胺均敏感[6]。有文献报道,肠球菌对唑烷酮类药物的常见耐药机制包括23S rRNA 的G2576T突变或cfr基因介导的残基甲基化[1],由此提示肠球菌属细菌对万古霉素和利奈唑胺不会存在交叉耐药,除非细菌同时具有这两类抗菌药物的耐药机制。2011—2020年,上海地区共出现29株对万古霉素和利奈唑胺均耐药的肠球菌(粪肠球菌13株、屎肠球菌16株),这些菌株在下属监测单位是否均按方案进行复测,现已无法考证,但在笔者实验室中采用肉汤微量稀释法对万古霉素或利奈唑胺耐药菌株复测时,均未发现细菌对该两药交叉耐药的结果。因此建议实验室需加强对VRE和利奈唑胺耐药肠球菌(LRE) 的耐药监测,一旦发现此类菌株,应按照CLSI要求进行菌种复测和药敏试验确认后,送至中心实验室进一步确证试验。此外,还可开展分子生物学研究,检测是否具有万古霉素或利奈唑胺耐药基因。临床上可根据细菌的药敏结果,将万古霉素或利奈唑胺作为治疗LRE或VRE感染的选择。
本组数据中分离自尿液标本的粪肠球菌对磷霉素和万古霉素的耐药率分别为5.8%和0.1%,提示磷霉素对临床分离肠球菌具有良好的抗菌活性。磷霉素主要用于泌尿道、皮肤及软组织、肠道等部位的感染[7],细菌对磷霉素和其他抗菌药物间不产生交叉耐药,故在临床上广泛应用时也要关注随之出现的耐药菌株。目前CLSI指南中只针对尿液标本分离的粪肠球菌有明确的纸片法药敏折点供临床微生物实验室参考,临床上在使用磷霉素治疗肠球菌属细菌感染时,建议将其作为单一疗法或与其他抗菌药物联用[8]。
综上所述,2011—2020年上海地区临床分离的肠球菌属细菌主要以粪肠球菌和屎肠球菌为主,对目前沿用的大多数抗菌药物仍保持较好敏感性,但本次监测结果中出现了对利奈唑胺或万古霉素耐药的肠球菌属细菌,提示仍需加强细菌耐药监测,特别是一线抗感染药物,临床上需结合细菌的药敏结果合理用药。

