“培土生金法”早期干预对哮喘模型幼鼠肠道菌群的影响
周 娟,林晓玲,刘 华,叶丽妍,陈佩文,叶绮娜,陈晓刚
(1.广州中医药大学第一附属医院,广东 广州 510405;2.广州中医药大学第一临床医学院,广东 广州 510405;3.广州妇女儿童医疗中心,广东 广州 510623)
支气管哮喘是以慢性气道炎症和气道高反应性为特征的过敏性疾病,以儿童多见。目前现代医学对哮喘的治疗仍然以雾化吸入糖皮质激素为主,然而过量吸入糖皮质激素可能会造成药物依赖或耐药性以及其他不良反应。此外,哮喘疾病病程较长,患儿的用药依从性较差,亦会影响治疗效果。中医药治疗哮喘显示出较好效果,如景晓平等[1]研究报道,中药治疗可降低哮喘发作次数、整体调节患儿免疫力。课题组前期研究发现,“培土生金法”早期干预能显著减轻哮喘模型幼鼠的气道炎症反应,增加支气管肺泡灌洗液中白细胞介素-10(IL-10)的含量[2]。本实验探讨了“培土生金法”的上述作用机制是否与调节肠道微生物的构成相关,旨在为中医药防治哮喘的作用机制研究提供更多的实验证据。
1 实验材料与方法
1.1实验动物 7日龄SPF级BALB/c雌性幼鼠32只,体重(5.26±1.15)g,购自广州中医药大学实验动物中心,动物许可证号:SYXK(粤)2018-0034。饲养环境:广州中医药大学第一附属医院实验动物中心SPF级环境,实验中心许可证号:SYXK(粤)2018-0092,实验符合广州中医药大学第一附属医院伦理审查要求。
1.2药品、试剂与仪器 鸡卵清蛋白(OVA,Sigma公司);氢氧化铝粉(天津天士力化学试剂公司);异功散组方:人参、白术、茯苓、广陈皮、炙甘草(广州中医药中大学第一附属医院)按1∶1∶1∶1∶1比例配制成含生药质量浓度为2 g/mL的溶液;酪酸梭菌(CGMCC313-1,山东科兴生物制品有限公司);雾化器(广州中医药大学第一附属医院儿科);小鼠雾化激发箱(广州中医药大学第一附属医院实验动物中心)。
1.3实验方法 按随机数表法将幼鼠分为空白组、模型组、异功散组和益生菌组,每组8只,分笼喂养。模型组、异功散组和益生菌组参照文献[2]方法制备幼鼠哮喘模型:幼鼠分别于第1天、第13天腹腔注射0.2 mL OVA致敏液(质量分数为10% OVA溶液0.1 mL与等体积佐剂液态铝混合),并于第19天开始以3% OVA溶液雾化吸入激发,每次20 min,每日1次,连续激发6 d,幼鼠出现烦躁不安、腹部凹陷、搔耳挠鼻、弓背为阳性反应;空白组以等体积生理盐水行腹腔注射致敏及雾化吸入激发。从造模起始日至雾化激化前1 d(共18 d),异功散组给予异功散煎液灌胃,益生菌组给予浓度为5×108CFU/mL的酪酸梭菌溶液灌胃,空白组和模型组给予PBS溶液灌胃,均每日1次,0.2 mL/只。
1.4观察指标及方法
1.4.1幼鼠表现及体重 观察幼鼠激发阶段表现,实验结束后记录各组幼鼠体重。
1.4.2肠道菌群检测 实验结束后,解剖各组幼鼠取全结肠,收集粪便,-80 ℃冰箱保存备用。样本送至上海锐翌生物科技有限公司行16S-rRNA扩增子高通量检测及相应的生物信息学分析。
2 结 果
2.1各组幼鼠激发阶段表现及体重比较 模型组幼鼠在激发阶段期间出现搔耳挠鼻、前肢上抬、烦躁、活动过度活跃(跑窜、攀爬等行为)、腹部凹陷等表现;异功散组和益生菌组幼鼠偶有搔耳挠鼻行为,无明显其他异常表现。实验结束后,空白组、模型组、异功散组、益生菌组幼鼠体重分别为(16.34±0.89)g、(13.33±1.98)g、(13.85±1.72)g、(14.59±1.64)g,模型组明显低于空白组(P<0.05),异功散组、益生菌组与模型组比较差异无统计学意义(P>0.05),益生菌组与异功散组比较差异无统计学意义(P>0.05)。
2.2各组幼鼠肠道菌群情况
2.2.1微生物菌群物种丰度 门水平:与空白组比较,模型组幼鼠肠道内的拟杆菌门(Bacteroidetes)丰度减少,厚壁菌门(Firmicutes)丰度增加;与模型组比较,异功散组、益生菌组的拟杆菌丰度增加,厚壁菌门丰度减少,见图1。属水平:空白组产丁酸盐菌属(Saccharibacteria-genera-incertae-sedis)比例显著增加,模型组中阿克曼氏菌属(Akkermansia)、链球菌属(Streptococcus)、棒杆菌属(Corynebacterium)比例显著增加,异功散组螺杆菌属(Helicobacter)、黄酮菌属(Flavonifractor)比例显著增加,益生菌组中肠杆菌属(Enterorhabdus)、罗氏菌属(Rothia)、戴尔福特菌属(Delftia)比例显著增加,见图2。
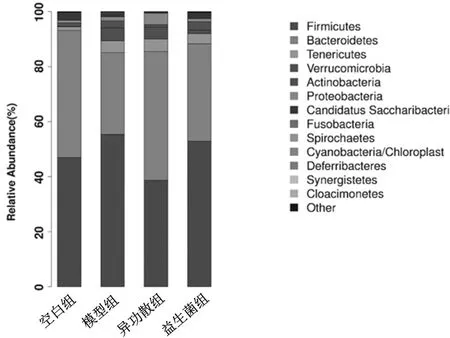
图1 空白组和哮喘各组幼鼠门水平上微生物菌群物种丰度
2.2.2肠道菌群物种alpha多样性分析 各组幼鼠肠道菌群的稀释曲线均急剧上升后呈平缓趋势(见图3),表明测序深度可以覆盖本样本中的物种组成情况。与空白组比较,模型组幼鼠肠道菌群丰度chao1指数及observed_species指数和菌群多样性shannon指数及simpson指数均有下降趋势,但差异均无统计学意义(P均>0.05)。与模型组比较,异功散组幼鼠肠道菌群的丰度chao1指数明显降低(P<0.05),菌群多样性指数有下降趋势,但差异均无统计学意义(P均>0.05);益生菌组幼鼠肠道菌群丰度chao1指数及observed_species指数有下降趋势,菌群多样性shannon指数及simpson指数有增加趋势,但差异均无统计学意义(P均>0.05)。见表1。
表1 空白组和哮喘各组幼鼠肠道微生物菌群丰富度和多样性比较
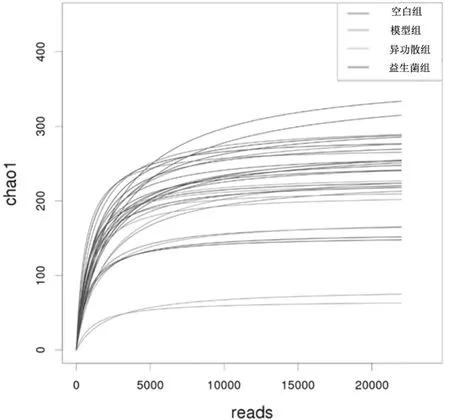
图3 空白组和哮喘各组幼鼠肠道菌群的稀释曲线
2.2.3Beta多样性分析各组样本的主成分分析(PCA) 空白组、模型组、异功散组及益生菌组在第1主成分(14.68%)及第2主成分(10.78%)可分离,说明各组菌群组成存在一定的差异,见图4。
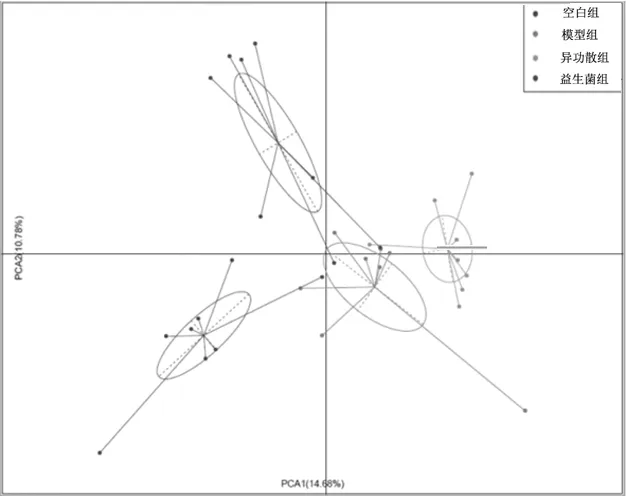
图4 空白组和哮喘各组幼鼠肠道菌群样本的主成分分析
2.2.4微生物组间差异分析 在门水平上,空白组幼鼠肠道菌群以CandidatusSaccharibacteria为主,模型组以疣微菌门(Verrucomicrobia)为主,异功散组以拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)为主;在属水平上,空白组主要为产丁酸盐菌属(Saccharibacteria-genera-incertae-sedis)、球菌属(Sporosarcina)、巴氏杆菌属(Pasteurella),模型组主要为阿克曼氏菌属(Akkermansia)、拟普雷沃菌属(alloprevotella),异功散组主要为螺杆菌属(Helicobacter)、黄酮菌属(Flavonifractor)、Erysipelotrichaceae-incertae-sedis,益生菌组主要为肠杆菌属(Enterorhabdus)、短小杆菌属(Curtobacterium)。见图5及图6。
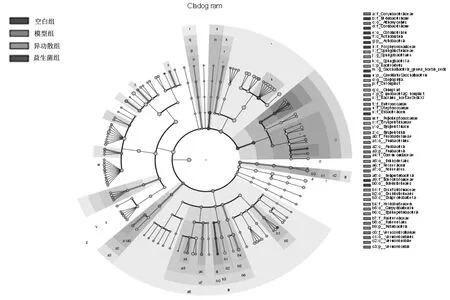
图5 空白组和哮喘各组幼鼠肠道菌群进化分支
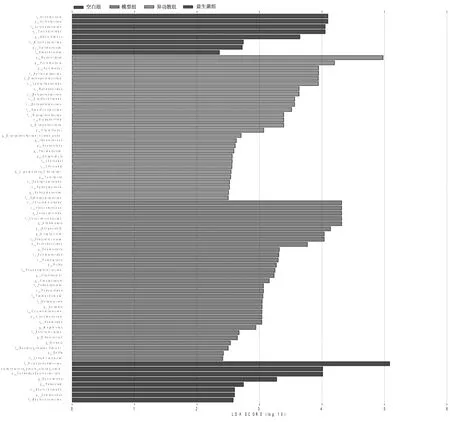
图6 空白组和哮喘各组幼鼠肠道菌群 LDA值分布情况
3 讨 论
近年来越来越多的证据表明,婴儿早期肠道微生物的组成及改变与过敏性哮喘发生密切相关[3-4]。研究发现,出生后第1个月肠道菌群多样性降低可导致学龄期哮喘的发生[3];3个月婴儿肠道的低水平Faecalibacterium、Lachnospira、V feillonella和Rothia菌群与哮喘发生风险呈正相关[5]。肠道菌群的失调虽可能导致哮喘的发生,但特定的微生物物种在哮喘的发展中亦起保护作用,口服益生菌被认为是防治哮喘的有效治疗手段。动物实验表明,口服酪酸杆菌、短双歧杆菌M-16V可减轻OVA导致的小鼠过敏性气道炎症[6];一项随机对照试验的Meta分析结果显示,补充鼠李糖乳杆菌GG有助于预防哮喘[7]。
中医认为,哮喘的夙根为“痰”,哮喘缓解期以脾肺气虚证多见。《保婴撮要》中记载:“喘一小儿外感风邪,服表散之剂,汗出作喘,此邪气去而脾肺虚也。用异功散而汗喘止,再剂而乳食进。”异功散是北宋名医钱乙所制名方,由人参、白术、茯苓、陈皮、炙甘草组成,人参益气补中,白术健脾燥湿,茯苓健脾渗湿,陈皮行气燥湿,甘草甘缓和中,全方健脾益气、行气化滞,在哮喘患儿缓解期的治疗中得到大量应用。现代药理研究发现,方中主要药物的活性成分如橘皮素、橙皮苷、人参皂苷Rh2等,能减轻哮喘模型动物肺组织炎症,或降低气道高反应性,抑制Th2、Th17细胞增殖及相关炎性因子分泌等[8-9]。
本实验中采用16S-rRNA扩增子高通量测序技术检测哮喘幼鼠肠道菌群情况,结果显示模型组肠道菌群丰度和菌群多样性有下降趋势,异功散和益生菌的早期干预并未使菌群结构发生显著改变,提示二者未能有效逆转哮喘幼鼠肠道菌群物种丰度及多样性的下降,这可能与用药时间较短(18 d)有关,也提示药物的作用可能只局限于某些特定菌群。
拟杆菌是肠道内栖息的常见共生菌,是肠道产生短链脂肪酸(SCFAs)尤其是乙酸的主要细菌来源[10],而乙酸可有效改善过敏性哮喘[4]。Abrahamsson等[3]研究发现,肠道拟杆菌丰度高的婴幼儿以后患哮喘和过敏性疾病的概率相对较低;相关动物实验提示,肠道拟杆菌有助于减轻哮喘模型小鼠的过敏性炎症及气道高反应性[4,11]。本实验结果显示,与空白组比较,模型组幼鼠肠道内的拟杆菌门丰度减少,厚壁菌门丰度增加;与模型组比较,异功散组、益生菌组的拟杆菌丰度增加,厚壁菌门丰度减少。提示异功散早期干预可能通过改变肠道菌群中拟杆菌门丰度从而改善哮喘。
幽门螺杆菌被认为可防治哮喘。美国一项大型横断面分析结果显示,幽门螺杆菌的定植与哮喘发生呈负相关,在5岁以下尤为明显[12]。动物实验研究表明,在致敏前期暴露于幽门螺杆菌可显著改善OVA致敏哮喘小鼠的气道炎症,抑制气道重塑[13],其诱导的保护作用包括通过IL-18和IL-10依赖性机制诱导耐受性树突状细胞和调节性T细胞[14-16]。黄酮菌属中的Flavonifractorplautii(FP)为革兰阳性厌氧菌,可从人类粪便中分离出来,参与人肠道中儿茶素的代谢,儿茶素被认为可减轻哮喘小鼠的气道炎症[17]。动物实验结果显示,口服FP可抑制OVA致敏小鼠的脾脏细胞分泌IL-4,减少血清中OVA-sIgE的含量,并增加CD4+CD25+T细胞和CD103+CD11c+树突状细胞,减轻抗原诱导的Th2免疫应答[18]。本实验结果显示,异功散组中螺杆菌属、黄酮菌属较模型组显著增加,提示异功散早期干预可能通过影响螺杆菌属、黄酮菌属而发挥治疗哮喘作用。
综上所述,异功散的早期干预影响了哮喘模型幼鼠的肠道菌群,其防治哮喘作用可能与某些关键菌群如拟杆菌、螺杆菌、黄酮菌等相关,但其具体机制尚需进一步深入探索。
利益冲突:所有作者均声明不存在利益冲突。

