疏肝健脾法对肝郁脾虚型功能性消化不良大鼠SP、GAS、MTL、VIP的影响
范明明,林 伟,韩海瑞,张嘉裕,王 顺
(黑龙江省中医药科学院,黑龙江 哈尔滨 150000)
功能性消化不良(FD)是一种功能性的胃肠道疾病,以上腹部疼痛、烧灼感、餐后饱胀和早饱感中的1项或多项为主要临床表现,可伴上腹部胀满、食欲不振、恶心、呕吐及嗳气,需排除因代谢性、系统性和器质性疾病所导致的消化不良[1]。罗马Ⅳ标准将功能性消化不良分为餐后不适综合征、上腹痛综合征以及混合型[2]。中医依据该病临床特点,将其归属于“胃脘痛”“痞满”等范畴,临床以肝郁脾虚多见。笔者依据多年丰富临床实践经验,以自拟疏肝健脾方药对肝郁脾虚证FD患者辨证施治,效果显著,但其作用机制尚不明确。本研究通过建立肝郁脾虚FD大鼠模型,探讨了疏肝健脾法治疗FD的可能机制。
1 实验材料与方法
1.1实验动物 雄性健康SPF级SD大鼠60只,体重(220±20)g,由黑龙江中医药大学实验动物中心提供,许可证号:SCXK(黑)2016004。适应性饲养7 d,饲养期间充足清洁饮水,自由摄食,室温控制在(22±2)℃,相对湿度维持在55%~60%。
1.2实验药物 柴术理胃饮组方:柴胡15 g、党参20 g、白术15 g、白芍15 g、枳实10 g、陈皮10 g、姜半夏10 g、丹参10 g、砂仁10 g、炙甘草10 g,黑龙江省中医医院药房提供,常规水煎浓缩至10.8 g/mL后4 ℃冷藏备用。多潘立酮(西安杨森制药有限公司,国药准字H20033213,规格:10 mg/片),蒸馏水配制成0.3 mg/mL的溶液备用。
1.3主要试剂 P物质(SP)抗体(批号:BS-0065R)、胃泌素(GAS)抗体(批号:BS-1189R)、胃动素(MTL)抗体(批号:BS-1445R)、血管活性肠肽(VIP)抗体(批号:BS-0077R)均由北京博奥森提供;内参抗体β-actin(wanleibio,WL01845);TRNzol总RNA提取试剂[天根生化科技(北京)有限公司,DP405-02]。
1.4主要仪器 超速冷冻离心机(湖南湘仪,H-2050R);凝胶成像系统(北京六一,WD-9413型);双垂直蛋白电泳仪(DYCZ-24DN);分光光度计(Therno Scientific,NANODROP 2000);荧光定量PCR仪(Applied Biosystems,ABI7500)。
1.5实验方法 将旷场试验筛选符合标准的60只SPF级雄性SD大鼠随机分为正常组、模型组、柴术理胃饮低剂量组、柴术理胃饮中剂量组、柴术理胃饮高剂量组和多潘立酮组,每组10只。除正常组外,其余组大鼠均采用复合因素刺激(慢性疲劳+悬尾刺激+饮食失节)方法[3]制备FD模型,造模周期为28 d。造模成功后,柴术理胃饮低、中、高剂量组分别给予13.5 g/kg、27 g/kg、54 g/kg柴术理胃饮灌胃,多潘立酮组给予制备的多潘立酮溶液3.125 mg/kg灌胃,正常组、模型组给予等量生理盐水灌胃,均1次/d,连续21 d。
1.6观察指标及方法
1.6.1大鼠一般状态 记录各组大鼠实验过程中的精神状态、毛发情况、活动度、大便性状等行为学改变。
1.6.2大鼠体重和进食量 造模前和末次灌胃当天用电子秤称量各组大鼠空腹体重;记录造模前7 d和灌胃最后7 d时进食量,计算每日平均进食量,分别作为造模前和末次灌胃当天进食量。
1.6.3大鼠胃肠动力 末次灌胃后,大鼠禁食12 h,给予1 mL/100 g碳素墨水灌胃,30 min 后用10%水合氯醛腹腔麻醉。剖腹取胃称重为全重,然后沿胃小弯侧剪开胃壁并冲洗,滤纸吸干后称重为净重,计算胃排空率[胃排空率=(全重-净重)/全重×100%]。截取小肠全段,测量小肠全长和幽门至炭墨上缘距离,计算小肠推进率[小肠推进率=碳墨推进距离/小肠全长×100%]。
1.6.4大鼠胃窦组织病理形态学观察 检测胃肠动力后,取大鼠胃窦组织,放入4%多聚甲醛中固定,然后常规脱水、浸蜡和包埋,制备4 μm厚切片,HE染色观察病理学表现。
1.6.5胃窦组织中SP、GAS、MTL、VIP蛋白表达量采用免疫印迹法检测:采用BCA方法提取胃窦组织中SP、GAS、MTL、VIP蛋白并测定含量,常规电泳。电泳结束后,将“海绵-滤纸-膜-胶-滤纸-海绵”在80 V电压下转印1.5 h。转印结束后,将PVDF膜浸入脱脂奶粉溶液中,摇床缓慢摇动1 h结束封闭。1∶500的抗体稀释液(TBST,5%脱脂奶粉)稀释一抗,4 ℃条件下孵育过夜;1∶5 000的抗体稀释液稀释二抗,37 ℃下孵育45 min。将孵育二抗后的PVDF膜均匀地洒上ECL发光液,静置5 min并在暗室进行曝光。将曝光后的PVDF膜浸入蒸馏水中,摇床摇动5 min,重复2次,再加入剥脱液并摇床摇动15 min;将洗涤后的PVDF膜放入蒸馏水中,摇床摇动10 min,重复2次。将抗体剥脱后的PVDF膜浸入TBST中,摇床摇动5 min,紧接着浸入脱脂奶粉溶液中,摇床缓慢摇动1 h进行封闭。按照以上相同步骤孵育内参抗体,然后将ECL发光液均匀地洒在PVDF膜上,静置5 min并在暗室进行曝光。最后扫描胶片,用凝胶图像处理系统(Gel-Pro-Analyzer软件)分析目标条带的光密度值。
1.6.6胃窦组织中SPmRNA表达量 采用Real Time PCR法检测:充分研磨胃窦组织,加入TRIzol,室温保存5 min后加入0.2 mL氯仿并充分混合,室温放置5 min;12 000 r/min离心15 min后吸取上层水相预冷异丙醇静置10 min,再次离心15 min后弃掉上清液,加入75% DEPC乙醇离心后静置并加入DEPC水溶解沉淀完成总RNA提取,紫外分光光度计测定RNA浓度和纯度;电泳后进行反转录生成cDNA,将cDNA置于-20 ℃保存备用。Real Time PCR反应体系:2 × Master Mix共10 μL、SP上游引物0.5 μL、SP下游引物0.5 μL、cDNA 2 μL、水7 μL。引物序列:SP上游引物为5’-ATGAAA ATCCTCGTGGCGGT-3’,下游引物为5’-AATGGGCAAACGGGATGCTG-3’,产物大小210 bp;ACTIN上游引物为5’-CATCTCTTGGAAGT CA-3’,下游引物为5’-ATCATGTTTGAGACCTTCAACA-3’,产物大小280 bp。实时荧光定量PCR反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 40 s,共40个循环。再95 ℃ 10 s,60 ℃ 60 s,95 ℃ 15 s,并从60 ℃缓慢加热到99 ℃的条件下获得熔解曲线。β-actin在相同条件下进行实时荧光定量PCR反应并获取溶解曲线。每个样本检测3个复孔,采用2-△△CT法进行数据分析。
2 结 果
2.1各组大鼠一般状态 造模初期,各组大鼠的饮水进食、体重、粪便性状及皮毛色泽等均正常。造模结束,造模各组大鼠的饮水量和进食量均减少,精神差,皮毛少光泽,体重下降,自主活动显著减少,稀便,反应力较差。灌胃结束,柴术理胃饮各组和多潘立酮组大鼠饮水量、进食量基本恢复,皮毛光泽,体重缓慢增长,自主活动增多,粪便性状均正常。
2.2各组大鼠体重及进食量比较 末次灌胃当天,模型组大鼠体重及进食量均明显低于模型组(P均<0.05);柴术理胃饮各组和多潘立酮组大鼠体重及进食量均明显高于模型组(P均<0.05);各药物组间进食量比较差异均无统计学意义(P均>0.05),柴术理胃饮高剂量组大鼠体重明显高于柴术理胃饮低剂量组(P<0.05)。见表1。

表1 正常组和功能性消化不良各组大鼠体重及进食量比较
2.3各组大鼠胃排空率与小肠推进率比较 模型组大鼠胃排空率及小肠推进率均明显低于正常组(P均<0.05),柴术理胃饮各组和多潘立酮组大鼠胃排空率及小肠推进率均明显高于模型组(P均<0.05);柴术理胃饮高剂量组大鼠胃排空率明显高于柴术理胃饮低剂量组(P<0.05),各药物组间小肠推进率比较差异均无统计学意义(P均>0.05)。见表2。
表2 正常组和功能性消化不良各组大鼠胃排空率与小肠推进率比较
2.4各组大鼠胃窦组织病理形态学表现 正常组大鼠胃窦组织结构、细胞排列均正常,未见炎性细胞浸润;模型组大鼠胃窦黏膜层可见淋巴细胞浸润;柴术理胃饮各组和多潘立酮组大鼠胃窦黏膜层可见少量淋巴细胞浸润,浸润程度轻于模型组。见图1。

图1 正常组和功能性消化不良各组大鼠胃窦组织病理形态学表现(HE,×100)
2.5各组大鼠胃窦组织中SP、GAS、MTL、VIP蛋白表达情况 与正常组比较,模型组大鼠胃窦组织中SP、GAS、MTL蛋白表达量均明显降低(P均<0.05),VIP蛋白表达量明显增高(P<0.05)。柴术理胃饮中、高剂量组大鼠胃窦组织中SP、GAS、MTL蛋白表达量均明显高于模型组(P均<0.05),柴术理胃饮低剂量组和多潘立酮组SP、GAS、MTL蛋白表达量与模型组比较差异均无统计学意义(P均>0.05);柴术理胃饮各组和多潘立酮组大鼠胃窦组织中VIP蛋白表达量均明显低于模型组(P均<0.05);柴术理胃饮高剂量组SP、GAS、MTL蛋白表达量均明显高于柴术理胃饮低剂量组(P均<0.05),VIP蛋白表达量明显高于柴术理胃饮低剂量组(P<0.05)。见图2~5。

图2 正常组和功能性消化不良各组大鼠胃窦组织中SP蛋白表达情况
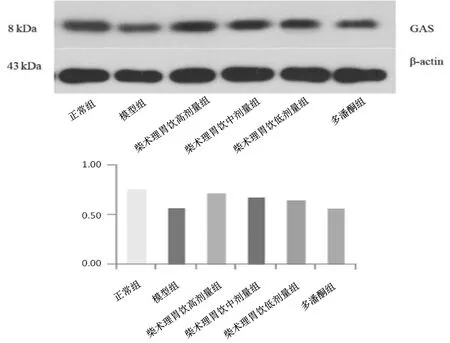
图3 正常组和功能性消化不良各组大鼠胃窦组织中GAS蛋白表达情况

图4 正常组和功能性消化不良各组大鼠胃窦组织中MTL蛋白表达情况
2.6各组大鼠胃窦组织中SP mRNA表达情况 模型组大鼠胃窦组织中SP mRNA表达量明显低于正常组(P<0.05);柴术理胃饮各组和多潘立酮组大鼠胃窦组织中SP mRNA表达量均明显高于模型组(P均<0.05),且柴术理胃饮高剂量组明显高于柴术理胃饮低剂量组(P<0.05)。见图6。

图5 正常组和功能性消化不良各组大鼠胃窦组织中VIP蛋白表达情况
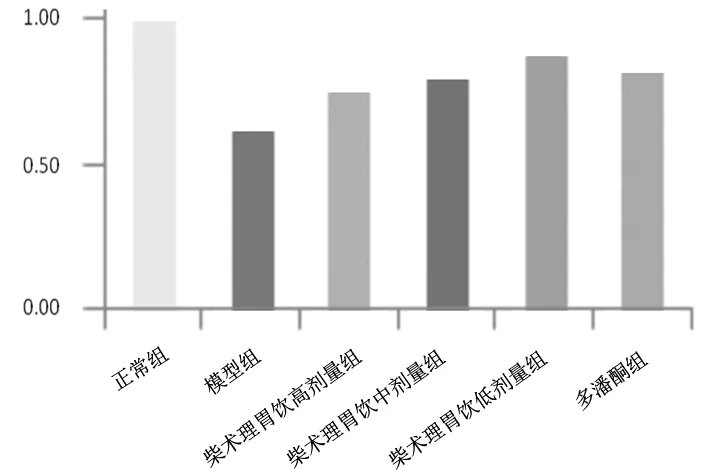
图6 正常组和功能性消化不良各组大鼠胃窦组织中SP mRNA表达情况
3 讨 论
目前FD的发病机制尚不完全清楚,现代医学认为与胃肠道运动功能障碍、胃的高敏感性、胃十二指肠低级别炎症、幽门螺杆菌感染、精神心理因素、脑-肠轴功能紊乱、遗传易感性等诸多因素密切相关[4-6]。其中脑-肠轴功能紊乱被视为FD发病的重要核心机制,脑-肠轴是由中枢神经系统、自主神经系统和肠神经系统连接而成的一种双向神经调节回路,主要由分布于其间的脑肠肽(由胃肠激素、胃肠神经肽、神经肽组成)将整合后的各种信息通过神经-内分泌网络传递到胃肠内分泌细胞而起到调节作用,其中胃肠激素SP、GAS、MTL、VIP分泌紊乱与FD的发生密切相关[7-9]。
SP是由11个氨基酸组成的神经肽,作为主要的兴奋性非胆碱能神经递质,能促进乙酰胆碱释放,从而诱导胃肠道平滑肌收缩。肠道低度炎性状态下可刺激SP释放,增加内脏敏感性并加速胃肠蠕动,且可以下调炎症因子来减轻肠损伤,维持肠黏膜屏障完整性[10-12]。GAS由存在于胃窦和十二指肠内的G细胞分泌,也存在于垂体和大脑皮质中,并受中枢神经和周围神经调节。其主要生理功能是促进胃酸分泌,刺激胃肠道黏膜增生并起营养保护作用,加强胃肠道运动,此外还可以加速胃电节律,促进胃窦和幽门括约肌收缩[13-15]。在紧张焦虑等环境下,血清GAS含量降低[16]。MTL主要是由M细胞合成分泌,能够启动胃肠移行性肌电复合波(MMC)Ⅲ相,提高胃肠道平滑肌细胞内Ca2+浓度,促进胃蛋白酶分泌,可加速肠胃蠕动及胃排空[17],还可作为中枢神经递质参与焦虑等行为及情绪的整合[18]。VIP分布于中枢神经和肠神经系统中,其既是一种胃肠道激素,又是一种非肾上腺能非胆碱能神经抑制系统的神经递质,能够松弛胃肠道平滑肌,延迟胃排空,抑制胃液分泌[19];徐派的等[20]研究报道,肝郁脾虚型FD大鼠下丘脑、胃窦、空肠中VIP表达明显增高。本实验结果显示,肝郁脾虚型FD大鼠模型胃排空率和小肠推进率降低,胃窦组织中SP、GAS、MTL蛋白表达均下降,VIP蛋白表达增加,与既往研究结论一致。
柴术理胃饮由柴胡疏肝散、小建中汤、香砂六君子汤加减而成,其中柴胡疏肝气而调达肝木,白术补气健脾,二者相合肝郁解而脾旺。党参补中益气、健脾益肺,与白术相伍补脾胃之虚;枳实、陈皮理气健脾、行气和胃,与白术、党参相伍补而不滞;白芍养血柔肝,缓急止痛。姜半夏燥湿化痰,降逆消痞;砂仁芳香醒脾化湿,行气和胃;丹参活血祛瘀止痛,甘草调和诸药。全方具有疏肝解郁、益气健脾之功。曹峰等[21]动物实验研究发现,高剂量柴胡可明显提高胃窦组织中MTL含量,增强胃肠动力。相关药理研究发现,白芍可以降低胃肠VIP含量,促进胃排空[22];白术能修复胃肠黏膜损伤[23];党参具有抑制胃酸分泌、修复胃黏膜等作用[24];陈皮可提高大鼠血清GAS水平,促进胃平滑肌收缩和消化液分泌[25];枳实提取物能增强胃动力和加速肠蠕动[26];丹参水溶性成分能够增加胃黏膜血流,保护黏膜屏障[27];砂仁能抑制胃酸分泌,调节肠道菌群,加快胃肠蠕动[28]。本实验结果显示,柴术理胃饮各组大鼠胃排空率及小肠推进率均明显高于模型组,柴术理胃饮中、高剂量组大鼠胃窦组织中SP、GAS、MTL蛋白表达量和柴术理胃饮各组SP mRNA表达量均明显高于模型组,柴术理胃饮各组胃窦组织中VIP蛋白表达量均明显低于模型组,提示柴术理胃饮干预能增强肝郁脾虚型FD大鼠胃排空和小肠推进功能,上调胃窦组织中SP、MTL、GAS表达,下调VIP表达。
综上所述,疏肝健脾法可以促进肝郁脾虚型FD大鼠胃肠蠕动,上调胃窦组织中SP、GAS、MTL表达和下调VIP表达可能是其改善胃肠动力障碍的重要机制。
利益冲突:所有作者均声明不存在利益冲突。

