外周血PD-1、PD-L1表达与肾细胞癌骨转移的相关性分析
朱云,吴东娟,马帅军,张梦姣
肾细胞癌是起源于肾小管上皮组织的恶性肿瘤,占所有肾癌的 90%,20%~30%的肾细胞癌患者以转移性肾细胞癌就诊,20%~40%局部病变患者在手术后最终会发展为转移性病变[1]。骨骼是除肺外肾细胞癌第二常见的转移部位,发生率为24%~32%,骨转移可引起严重骨骼破坏,严重降低患者生活质量[2]。肿瘤细胞可通过将其免疫检查点与T细胞上表达的受体结合来抑制T 细胞激活,导致免疫逃逸[3]。程序性死亡分子-1(programmed cell death protein 1,PD-1)通过调节T细胞活性,促使抗原特异性T细胞凋亡,抑制免疫反应和促进自身耐受,程序性死亡分子-1配体(programmed cell death ligand 1,PD-L1)是免疫反应的协同抑制因子,与PD-1结合减少PD-1阳性细胞增殖,抑制细胞因子分泌并诱导细胞凋亡,PD-1/PD-L1轴与恶性肿瘤免疫逃逸、发生和进展密切相关[4]。现有研究显示,透明细胞肾细胞癌外周血和肿瘤组织中PD-1、PD-L1表达均增高[5],但其表达是否与肾细胞癌骨转移有关尚不清楚,鉴于此,现分析肾细胞癌患者外周血PD-1、PD-L1表达及其与肾细胞癌骨转移的相关性,报道如下。
1 资料与方法
1.1 临床资料 选择2016年2月—2021年3月中国人民解放军空军军医大学第一附属医院泌尿外科收治肾细胞癌患者219例,其中发生骨转移66例(骨转移组),未发生骨转移153例(无骨转移组)。骨转移组患者均经放射性核素骨显像或PET-CT证实骨转移,并且骨转移灶经病理证实,符合“肾癌骨转移临床诊疗专家共识(2008版)”[6]。本研究已经获得医院伦理委员会批准(PZ021541),患者及家属均知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①经术后病理学证实为肾细胞癌;②年龄18岁以上。(2)排除标准:①合并其他部位恶性肿瘤;②临床资料及病理资料缺失者;③合并自身免疫疾病者,接受PD-1抑制剂治疗者。
1.3 观测指标与方法
1.3.1 临床资料收集:收集性别、年龄、体质量指数、吸烟史、高血压病史、糖尿病病史、组织学类型、TNM分期、肌肉或骨痛症状、碱性磷酸酶升高(>125 U/L)、高钙血症(>2.75 mmol/L)等临床资料。
1.3.2 外周血CD4+T、CD8+T细胞表面PD-1表达及CD14+单核细胞表面PD-L1表达检测:患者入组后24 h内采集外周血3 ml注入EDTA抗凝试管混匀后加入RPMI-1640培养液(购自杭州吉诺生物医药技术有限公司)100 μl混匀,加入CD4-FITC/PD-1-PE、CD8-FITC/PD-1-PE和CD14-FITC/PD-L1-PE单克隆抗体(购自武汉艾美捷科技有限公司)4℃反应20 min。设阴性对照管,每个阴性对照管中分别加入CD4-FITC/IgG-PE、CD8-FITC/IgG-PE或CD14-FITC/IgG-PE,避光反应20 min。每管内加入红细胞lysis Buffer(美国Beckman-Coulter公司)150 μl混匀,42℃水浴反应10 min,磷酸盐缓冲液洗涤,3000 r/min离心5 min(离心半径10 cm)弃上清,加入磷酸盐缓冲液500 μl重悬。EPICS-XL 流式细胞仪(美国贝克曼库尔特有限公司)检测CD4+T细胞、CD8+T细胞表面PD-1表达率及CD14+单核细胞表面PD-L1表达率。

2 结 果
2.1 2组临床资料比较 骨转移组患者年龄≥65岁、TNM分期Ⅲ~Ⅳ期、有肌肉或骨痛症状、碱性磷酸酶升高、高钙血症比例高于无骨转移组(P<0.05),2组性别、体质量指数、吸烟史、高血压病史、糖尿病病史、组织学类型比较差异无统计学意义(P>0.05),见表1。
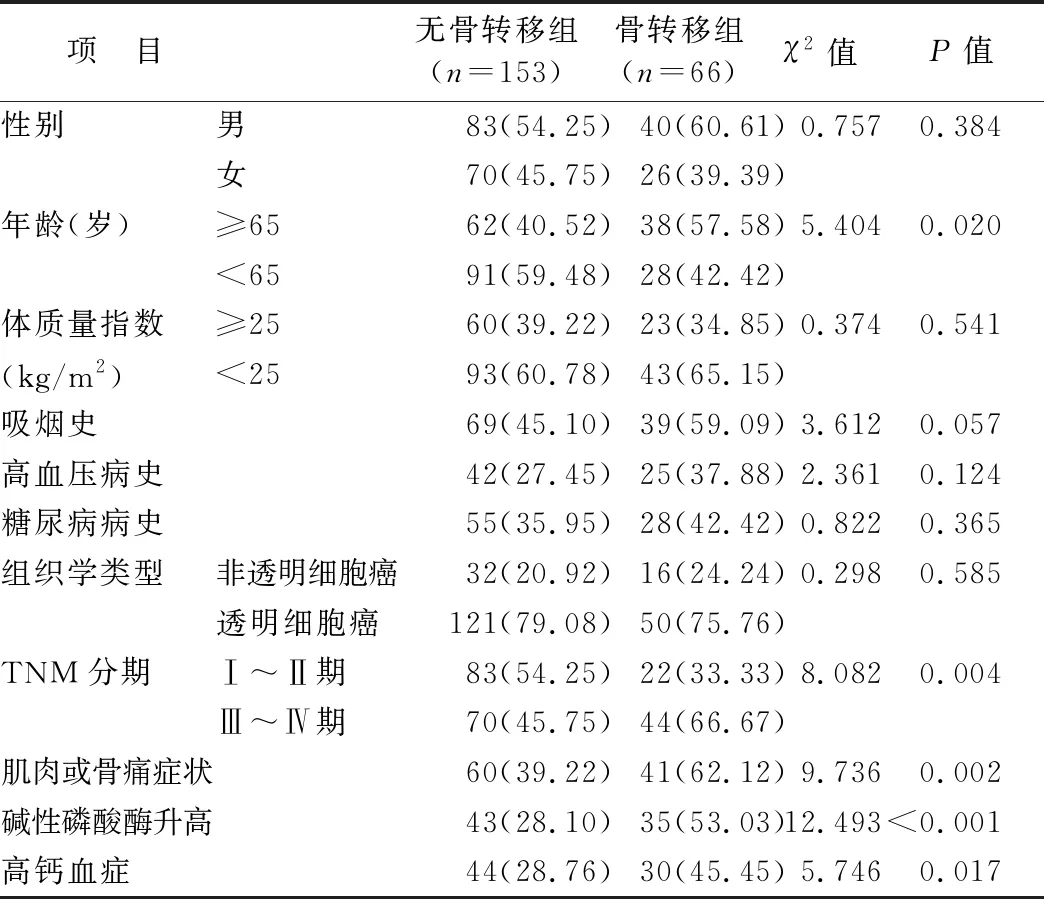
表1 骨转移组和无骨转移组临床资料比较 [例(%)]
2.2 2组外周血CD4+T、CD8+T细胞表面PD-1及CD14+单核细胞表面PD-L1表达率比较 骨转移组外周血CD4+T、CD8+T细胞表面PD-1及CD14+单核细胞表面PD-L1表达率均高于无骨转移组(P<0.01),见表2、图1。

注:A、B、C分别为无转移组CD4+T、CD8+T细胞表面PD-1及CD14+单核细胞表面PD-L1表达比例;D、E、F分别为骨转移组CD4+T、CD8+T细胞表面PD-1及CD14+单核细胞表面PD-L1表达比例
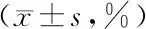
表2 骨转移组和无骨转移组外周血细胞表面PD-1/PD-L1表达率比较
2.3 肾细胞癌发生骨转移的多因素Logistic回归分析 以年龄≥65岁、TNM分期Ⅲ~Ⅳ期、肌肉或骨痛症状、碱性磷酸酶升高、高钙血症、CD4+T细胞表面PD-1表达率、CD8+T细胞表面PD-1表达率、CD14+单核细胞表面PD-L1表达率为自变量,骨转移(赋值:0=否,1=是)为因变量,ENTER法筛选变量,最终结果显示,TNM分期Ⅲ~Ⅳ期、高钙血症、CD4+T细胞表面PD-1表达率高、CD8+T细胞表面PD-1表达率高、CD14+单核细胞表面PD-L1表达率高是肾细胞癌发生骨转移的危险因素(P<0.05),见表3。
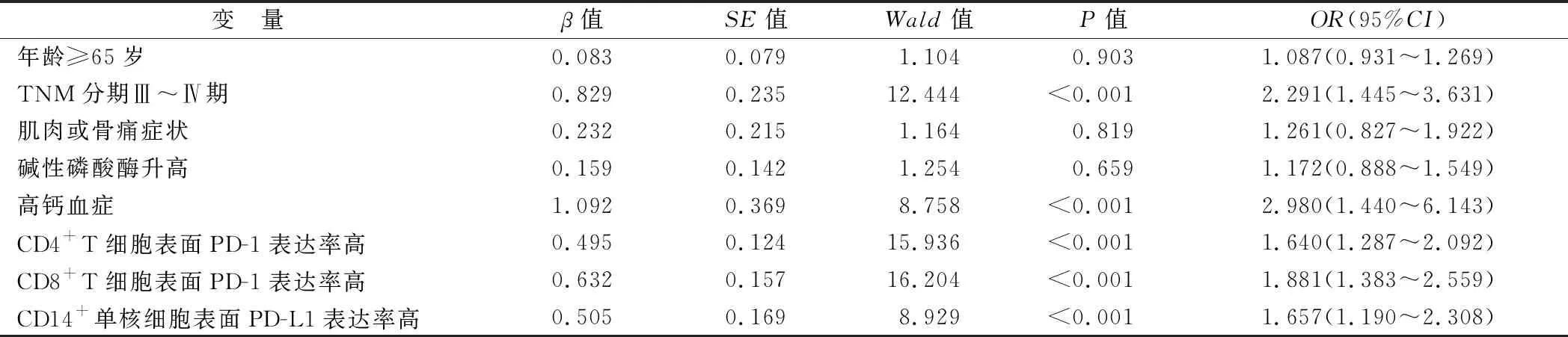
表3 肾细胞癌发生骨转移的多因素Logistic回归分析
2.4 CD4+T、CD8+T细胞表面PD-1及CD14+单核细胞表面PD-L1表达诊断肾细胞癌骨转移的价值 CD4+T 、CD8+T细胞表面PD-1及CD14+单核细胞表面PD-L1表达诊断肾细胞癌骨转移的曲线下面积分别为0.722、0.721、0.718,三者联合诊断肾细胞癌骨转移的曲线下面积为0.915,高于各自单独诊断效能(Z=5.458、5.094、5.022,P均<0.001),见表4、图2。
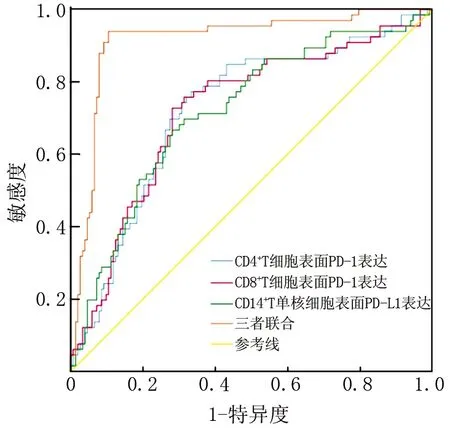
图2 CD4+T、CD8+T细胞表面PD-1及CD14+单核细胞表面PD-L1表达诊断肾细胞癌骨转移的ROC图

表4 CD4+T、CD8+T细胞表面PD-1及CD14+单核细胞表面PD-L1表达诊断肾细胞癌骨转移的效能
3 讨 论
骨是肾细胞癌血源性肿瘤细胞扩散的主要部位,一旦发生骨转移,治疗难度将大幅增加,并可引起严重的骨痛、脊髓压迫、病理性骨折和高钙血症,降低患者生存率[7]。免疫检查点分子是共刺激受体,与配体结合后负向调节效应免疫细胞,积极参与感染的免疫防御、自身免疫的预防、移植和肿瘤免疫逃避[8]。肿瘤免疫逃逸是造成肿瘤转移的关键原因,免疫逃逸可促使上皮间质转化,导致肿瘤细胞失去细胞间黏附和基底膜黏附力,获得侵入基底膜和血管及向远处迁移的能力[9-10]。PD-1是适应性和先天免疫反应的抑制剂,在肿瘤特异性T细胞上高度表达,PD-1与其配体PD-L1结合后产生强烈的抑制信号,下调T细胞活性,控制肿瘤微环境中免疫耐受的诱导和维持,导致抗肿瘤免疫反应退化,促使肿瘤发生及肿瘤进展[11-12]。现有报道显示,PD-1/PD-L1轴可通过磷酸肌醇3-激酶/蛋白激酶B通路促使癌细胞增殖,还可通过调控丝裂原活化蛋白激酶信号通路调节癌细胞增殖、分化、侵袭和转移[13]。PD-1/PD-L1被证实与胃癌远处转移、三阴性乳腺癌淋巴结转移、前列腺癌骨转移有关[14-15]。但是PD-1、PD-L1与肾细胞癌骨转移的报道十分少见。
本研究发现,外周血CD4+T细胞、CD8+T细胞表面PD-1表达率及CD14+单核细胞表面PD-L1表达率增高是肾细胞癌骨转移的危险因素,表明PD-1、PD-L1表达增高可能与肾细胞癌骨转移有关,可作为骨转移的潜在标志物。肾细胞癌多因溶骨性病变发生骨转移,溶骨性转移是由于骨吸收细胞活性增强所致[16]。骨髓是巨噬细胞、树突状细胞、T 细胞亚群等免疫细胞的储存库,直接调控免疫细胞增殖和分化,免疫细胞也可直接作用于骨细胞,调节骨细胞发育和骨代谢,肿瘤微环境中免疫细胞抑制可加剧骨—肿瘤微环境[17]。骨髓微环境同时为循环癌细胞归巢、存活和增殖提供肥沃的土壤,当癌细胞到达骨微环境时,诱导释放各种因子,如骨形态发生蛋白、转化生长因子-β、胰岛素样生长因子和成纤维细胞生长因子及其他刺激转移性肿瘤细胞生长的物质,嵌入骨基质中并导致成骨/破骨系统失衡[16]。因此,推测PD-1、PD-L1可能通过抑制T细胞、B 细胞、自然杀伤细胞、单核细胞活性抑制机体抗肿瘤免疫反应,破坏骨—肿瘤微环境,促使肿瘤细胞免疫逃逸,转移至骨骼组织,发生溶骨性转移。
本研究ROC分析结果显示,PD-1、PD-L1诊断肾细胞癌骨转移均具有一定价值,联合诊断骨转移的效能明显提高,可为临床肾细胞癌骨转移判断提供可靠的信息,对临床进一步治疗具有指导价值。本研究回归分析结果显示,TNM分期Ⅲ~Ⅳ期、高钙血症与肾细胞癌骨转移也有关,提示临床对TNM分期晚期、伴高钙血症患者应警惕骨转移风险。
综上,肾细胞癌骨转移患者外周血CD4+T细胞、CD8+T细胞表面PD-1表达率及CD14+单核细胞表面PD-L1表达率均增高,且其增高与肾细胞癌骨转移发生有关,可作为骨转移诊断的潜在指标。
利益冲突:所有作者声明无利益冲突
作者贡献声明
朱云:设计研究方案,实施研究过程,论文撰写;吴东娟:提出研究思路,分析试验数据,论文审核;马帅军:资料搜集整理,论文修改;张梦姣:课题设计,进行统计学分析

