血清自分泌运动因子和溶血磷脂酸在弥漫性毒性甲状腺肿中的表达及临床意义
郝晓红,郭海清,郭敏,赵利敏,段拜拜,岳荣荣
弥漫性毒性甲状腺肿(Graves’ disease, GD)以弥漫性甲状腺肿和甲状腺功能亢进为特征,表现为外周血甲状腺素升高且甲状腺特异性自身抗体阳性[1]。GD的发病涉及复杂免疫系统功能的紊乱,但目前GD的具体发病机制仍不清楚。自分泌运动因子(autotaxin,ATX) 是一种将溶血磷脂酰胆碱水解成溶血磷脂酸(lysophosphatidic acid,LPA)的酶[2]。研究发现,ATX参与多种免疫相关性疾病,ATX与原发性胆汁性肝硬化患者的皮肤瘙痒有关[3-6],GD患者中亦可观察到同样的临床症状。此外,研究发现,LPA能够促进幼稚 T 细胞的运动和迁移,促进T淋巴细胞进入淋巴结[7]。LPA还可增强B淋巴细胞中免疫球蛋白的分泌[8]。因此,ATX 和 LPA可能参与GD的发生发展。本研究通过检测GD患者血清中ATX和LPA水平变化,分析两者与 GD 临床参数的相关性,报道如下。
1 资料与方法
1.1 临床资料 选取2017 年4月—2019 年5月内蒙古乌兰察布市中心医院内分泌科治疗GD患者84例(GD组),其中男27例,女57例;年龄31~58(36.15±7.26)岁;甲状腺增大程度:正常/Ⅰ度28例,Ⅱ/Ⅲ度56例;甲状腺相关眼病32例;有吸烟史13例,饮酒史14例;有家族遗传史3例。选取同期在医院体检中心健康体检者62 例作为健康对照组,其中男24例,女38例;年龄30~61(37.24±7.51)岁;有吸烟史9例,饮酒史10例。2组性别、年龄、吸烟史、饮酒史比较,差异无明显统计学意义(P>0.05)。本研究经医院伦理委员会批准(2017-042),受试者及家属均知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准: ①GD 的诊断符合“中国甲状腺疾病诊治指南—甲状腺功能亢进症”[9];②均为汉族患者,临床资料齐全;③初次就诊,既往未进行抗甲状腺治疗;④均接受抗甲状腺药物甲硫咪唑治疗。(2)排除标准:①发热患者;②妊娠期或哺乳期妇女;③心、肝、肾功能严重障碍者;④合并其他内分泌疾病、自身免疫性疾病;⑤合并甲状腺癌、单纯性甲状腺肿等甲状腺功能异常。
1.3 观测指标与方法 健康对照组体检当日、GD组抗甲状腺药物治疗前清晨空腹抽取肘静脉血5 ml。常规分离血清备用。
1.3.1 血清ATX、LPA水平检测:采用酶联免疫吸附试验检测血清ATX、LPA水平,试验步骤按照试剂盒说明书进行(ATX试剂盒购自上海百奥莱博生物公司,LPA试剂盒购自上海茁彩生物公司)。
1.3.2 甲状腺相关指标检测:采用全自动免疫化学发光分析仪及其配套试剂( Roche Diagnostics GmbH公司,型号cobas 6000 e 601)测定血清游离三碘甲状腺原氨酸(free triiodothyronine, FT3)、游离甲状腺素(free thyroxine, FT4)、促甲状腺激素(thyroid stimulating hormone,TSH)、甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)、甲状腺球蛋白抗体(thyroglobulin antibody,TGAb)、促甲状腺素受体抗体(thyroid stimulating hormone receptor antibody,TRAb)水平。

2 结 果
2.1 血清ATX和LPA水平比较 与健康对照组比较,GD组血清ATX、LPA水平显著升高(P均<0.01);GD患者正常/Ⅰ度亚组血清ATX、LPA水平均显著低于Ⅱ/Ⅲ度亚组,差异均有统计学意义(P均<0.01),见表1。
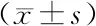
表1 健康对照组及GD组血清ATX、LPA水平比较
2.2 2组甲状腺相关指标比较 与健康对照组比较,GD组血清FT3、FT4、TgAb、TPOAb、TRAb明显升高 (P均<0.05),血清TSH水平降低(P<0.01),见表2。
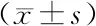
表2 健康对照组和GD组甲状腺功能指标比较
2.3 血清ATX、LPA水平与GD血清学指标的相关性 血清ATX与FT4、FT3表达呈显著正相关(P均<0.01),与TSH、TGAb、TPOAb、TRAb表达无明显相关性(P均>0.05);血清LPA表达与FT3、FT4、TSH、TGAb、TPOAb、TRAb表达均无明显相关性(P均>0.05),见表3。
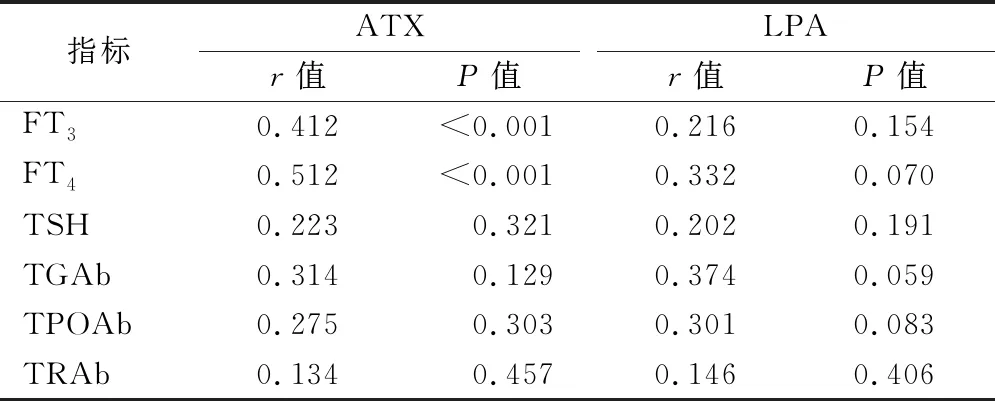
表3 血清ATX、LPA水平与GD血清学指标的相关性
2.4 血清ATX、LPA水平诊断GD的价值 血清ATX、LPA单独及联合检测诊断GD的AUC分别为0.785、0.741、0.862,血清ATX、LPA联合诊断GD的效能优于各单项指标(Z=2.788、3.375,P=0.005、0.001),见表4、图1。

表4 血清ATX、LPA单独及联合诊断GD的ROC曲线分析

图1 血清ATX、LPA单独及联合诊断GD的ROC曲线
3 讨 论
GD是甲状腺功能亢进症最常见的病因,女性较为常见,年发病率为20/10万~50/10万[10]。目前GD的标准治疗是使用抗甲状腺药物如甲硫咪唑等抑制甲状腺激素的合成和分泌;然而,部分GD患者由于疾病的活动性单独用药难以控制,需要使用放射性碘或消融手术进行治疗[11]。此外,部分GD患者药物治疗缓解后仍有复发的风险[12]。目前认为GD的发生与免疫紊乱有关,针对促甲状腺激素受体的自身免疫抗体过度刺激可促进甲状腺激素的分泌,导致FT3和FT4过度释放入血。然而,GD发生免疫紊乱的机制仍有待充分阐明。因此,研究GD的发病机制,寻找新的疗法和血清生物标志物是近年来GD的研究热点。
ATX作为一种水解酶,能将溶血磷脂酰胆碱水解成LPA。ATX主要负责产生大部分细胞外LPA,广泛表达于脂肪组织、肺支气管上皮、脑脉络丛上皮等人体多种正常组织。ATX 基因的表达受多种促炎介质诱导,包括许多细胞中的 Toll样受体配体、Ⅰ型干扰素、肿瘤坏死因子和白介素6等,ATX通过调节LPA表达水平,参与和放大炎性反应信号通路[13]。ATX 基因表达还受其酶解产物 LPA的负调控[14]。LPA是一种小的水溶性生物活性脂质,LPA 通过与G 蛋白偶联 LPA 受体或晚期糖基化末端受体结合,影响多种细胞和组织活动,包括增殖、存活、趋化性和组织发育。据报道,ATX、LPA参与包括支气管哮喘、炎性肠病等多种免疫性疾病的发生发展[15-16]。GD的发生涉及复杂免疫系统的功能紊乱。因此推测,血清中ATX、LPA可能参与GD的发生发展。本研究中,GD患者血清ATX、LPA水平升高,并且血清ATX水平与FT3、FT4呈显著正相关。因此推测血清ATX水平可能受到甲状腺素水平的调节。有学者在甲状腺切除的GD患者中发现,血清ATX水平较低,亦提示ATX可能受到甲状腺素的调节。Nojiri等[17]研究表明,ATX主要来源于脂肪细胞,在细胞实验中亦证实,用FT3或 FT4处理 3T3L1 脂肪细胞 24 h后,3T3L1 脂肪细胞中的ATX表达显著升高,并加速脂肪堆积,进一步证实上述推测。LPA作为ATX的酶解产物,在ATX表达水平升高时,LPA表达亦显著升高,LPA进一步通过激活甲状腺自身免疫反应,促进GD的疾病进展。研究表明,ATX/LPA途径激活能够促进基质金属蛋白酶13的表达,加重骨关节炎自身免疫炎性反应的进展[18]。而基质金属蛋白酶13 的表达增加导致眼窝软组织的再生功能障碍及细胞外基质的重塑能力异常,合成和降解稳态失调,导致Graves眼病的发生[19]。
有研究报道,GD患者血清 ATX、LPA 水平与 Graves 病的活动性相关,并可能是GD新的治疗靶点。目前ATX、LPA在GD发病机制中的作用尚不清楚。研究表明,ATX能够通过诱导分泌炎性细胞因子、趋化因子和血小板衍生生长因子,加重甲状腺炎性反应[20]。研究发现,LPA 可诱导 B 细胞增殖,刺激B细胞分泌产生TRAb等免疫球蛋白,作用于甲状腺上皮细胞,刺激甲状腺激素的释放[21-22]。此外,LPA 能够诱导未成熟树突细胞的趋化性,促进白介素1β、肿瘤坏死因子α等促炎细胞因子的分泌,促进T细胞的激活和黏附,加重甲状腺自身免疫炎性反应损伤[23-24]。因此,ATX、LPA可能通过加重甲状腺的自身免疫功能紊乱导致GD病情恶化,监测治疗前后血清ATX、LPA可能有助于判断GD的疾病活动性,值得临床深入研究。本研究表明,血清ATX、LPA联合检测对GD具有较高的诊断价值,并且具有较高的诊断敏感度和特异度。既往研究亦证实,在其他引起甲状腺功能亢进症的疾病,如亚急性甲状腺炎、Plummer 病中,血清 ATX 、LPA水平均未发生变化[25],表明GD中血清 ATX 、LPA水平升高具有较高的特异性,是新的GD血清生物标志物。因此,血清 ATX、LPA升高对GD具有较高的诊断及鉴别诊断价值,值得临床深入探索。
综上所述,GD患者血清ATX、LPA水平明显升高,血清ATX、LPA联合检测对诊断GD具有较高的诊断价值。血清ATX、LPA与FT4、TRAb表达呈显著正相关,可能是新的GD诊断和治疗的分子标志物。但是,目前ATX、LPA 在GD中的具体作用机制尚不清楚,需要进一步的基础研究进行探索。
利益冲突:所有作者声明无利益冲突
作者贡献声明
郝晓红:设计研究方案、研究过程,论文撰写;郭海清:分析、收集和整理数据,进行统计学分析;郭敏:提出研究方向和思路,分析、收集和整理数据,论文审核;赵利敏:实施研究过程,文献搜集整理,论文修改;段拜拜:进行统计学分析;岳荣荣:课题设计

