阳离子型表面活性剂对赭曲霉毒素A荧光性质的影响
王婷,黄磊,吕新月,李滨汐,韩建刚,李胎花*
(1. 南京林业大学生物与环境学院南方现代林业协同创新中心,南京 210037; 2. 江苏洪泽湖湿地生态系统国家定位观测研究站,洪泽 223100; 3. 南京国环科技股份有限公司,南京 210018)
真菌毒素是由曲霉属(Asperillussp.)、青霉属(Penicilliumsp.)、镰刀菌属(Fusariumsp.)等真菌产生的次级有毒代谢产物,常见的主要有黄曲霉毒素、赭曲霉毒素、玉米赤霉烯酮、伏马毒素、脱氧雪腐镰刀菌烯醇和T-2毒素等[1-3]。其中,赭曲霉毒素A(OTA)是赭曲霉毒素系列中分布最广、毒性最强、产毒量和危害最大的真菌毒素。研究表明,OTA不仅对人类和动物具有致畸、致癌、致突变及免疫抑制作用,还具有肾毒性、肝毒性和神经毒性[4-5]。由于OTA是一种化学稳定和热稳定的化合物,能够承受现代食品加工的物理化学条件,可以在宿主真菌根除后存活,且能够通过食物链在人体内富集,在人体中有较长的半衰期,约为35 d[6]。有数据显示,全球每年约25%的食物受到真菌毒素不同程度的污染,造成了巨大的经济损失[7]。鉴于OTA对人类健康的巨大危害及造成的经济损失,有必要开发可靠的方法来检测真菌毒素。目前,OTA的检测方法有高效液相色谱法(HPLC)、酶联免疫吸附法(ELISA)、荧光免疫分析法(FIA)等[8-10];因此,充分认识OTA的光学性质可为开发OTA的检测方法提供新的依据。
由于OTA结构式中苯丙氨酸部分的羧基和异香豆素部分的酚羟基,OTA的解离常数(pKa)范围分别为4.2~4.4和7.0~7.3。在弱酸性溶液中和弱碱性溶液中,OTA分别以单阴离子(OTA-)和双阴离子(OTA2-)形式存在,对应的最大吸收峰分别为波长330和380 nm,而荧光发射波长均为450 nm;因此,OTA的吸光度和荧光性质取决于其结构式中苯的丙氨酸羧基和酚羟基的去质子化状态[11]。此外,有很多因素影响OTA的去质子化,如阳离子盐、pH、蛋白质和阳离子表面活性剂等[10-13]。近年来,研究人员不断地深入了解关于表面活性剂及反应体系酸碱度在荧光分析中的作用机理及规律性[14-15]。尽管表面活性剂和酸碱度对OTA本身荧光的影响方面已有研究[13],但目前为止,人们对不同阳离子型表面活性剂对OTA光学性质的影响尚未进行系统研究。
聚乙烯亚胺(PEI)是具有单阳离子、双阳离子和三阳离子3种形态的阳离子型表面活性剂,带有很高的正电荷,PEI及其改性物具有固定阴离子性物质的作用[16]。十六烷基三甲基溴化铵(CTAB)为季铵盐型阳离子表面活性剂,具有水溶性好、耐酸碱和抗菌功效的特性,在其非极性区域含有正电荷[17]。聚二烯丙基二甲基氯化铵(PDDA)是一种高分子聚季铵盐,具有正电荷密度高、结构性质稳定且无毒等特点[18]。因此,笔者探讨了在不同酸碱度条件下的3种阳离子型表面活性剂PEI、CTAB和PDDA对OTA荧光性质的影响。
1 材料与方法
1.1 试剂与仪器
OTA(分析纯)和CTAB(相对分子质量62 000,纯度≥99%),购自西格玛奥德里奇(上海)贸易有限公司;PEI(相对分子质量10 000,纯度99%)和PDDA(相对分子质量100 000~200 000,质量分数20%),购自上海阿拉丁生化科技股份有限公司;实验用水均为超纯水,自制。实验中的OTA溶于甲醇。
分别选用pH 3.0,4.0,5.0,6.0,7.0,7.4,8.0,9.0和10.0的缓冲溶液(20 mmol/L)。其中,pH 3.0,4.0 和5.0为柠檬酸-柠檬酸钠缓冲溶液;pH 6.0为2-(N-吗啡啉)乙磺酸(MES)缓冲溶液;pH 7.0为磷酸盐缓冲溶液;pH 7.4为3-(N-吗啉代)丙烷磺酸(MOPS)缓冲溶液;pH 8.0为硼酸-硼砂缓冲溶液;pH 9.0和10.0为碳酸钠-碳酸氢钠缓冲溶液。
LS55型荧光分光光度计和365型紫外/可见光分光光度计,美国PerkinElmer公司。
1.2 试验方法
1.2.1 pH对OTA荧光性质影响实验
将溶于甲醇的OTA在不同pH的缓冲溶液中定容,使反应体系中OTA的浓度为100 nmol/L(甲醇体积分数为10%)。将溶液混匀后,常温静置反应10 min,然后使用荧光分光光度计测定体系溶液的荧光光谱,每组实验重复3次。荧光发射波长为450 nm,狭缝宽度设定为6 nm×6 nm。
1.2.2 阳离子表面活性剂对OTA荧光性质影响实验
将OTA分别加入到含PEI、CTAB、PDDA的pH 6.0,7.4和9.0缓冲溶液(10 mmol/L)中定容,使反应体系中OTA的浓度为100 nmol/L,PEI、CTAB和PDDA的质量分数为0.01%。将溶液混匀反应10 min,采用荧光分光光度计测定体系溶液的荧光光谱;在pH 6.0缓冲溶液中,100 nmol/L浓度的OTA分别与相同质量分数梯度(0,0.001%,0.005%,0.010%和0.020%)的PEI、CTAB和PDDA混合后,采用荧光分光光度计测定体系溶液的荧光光谱。每组实验重复3次。荧光发射波长均为450 nm,狭缝宽度设定为6 nm×6 nm。
1.3 数据处理
实验数据利用Origin 2018软件处理作图。
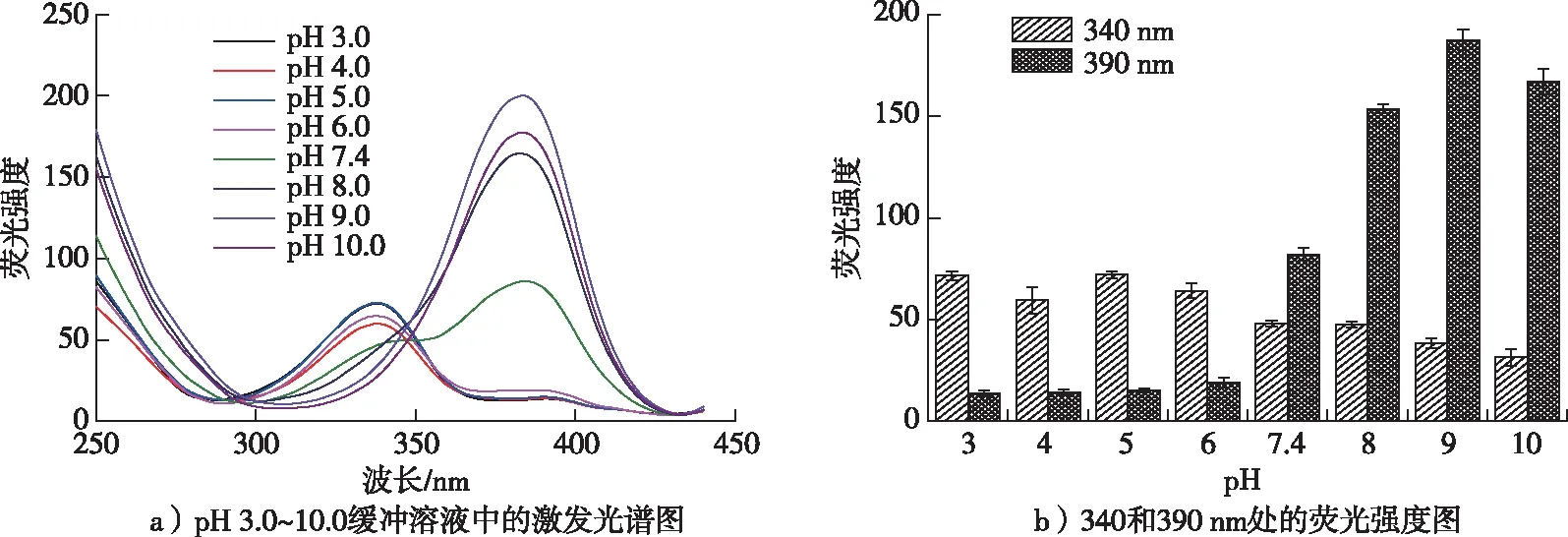
图2 OTA在不同pH缓冲溶液中的激发光谱图和各pH对应的340和390 nm处的荧光强度图Fig. 2 Fluorescence excitation spectra of OTA in buffers at different pH values and fluorescence intensities at 340 and 390 nm
2 结果与分析
2.1 pH对OTA吸光度和荧光性质的影响
为了探究pH对OTA光学性质的影响,利用紫外可见光分光光度计和荧光分光光度计分别对OTA的吸光度和荧光性质进行了分析。紫外可见光分光光度计扫描4种体系溶液中OTA的吸光光谱见图1。OTA在酸性(pH 4.0)、中性(pH 7.0)和碱性(pH 10.0)的缓冲溶液中,吸收带分别集中在波长330,380,380 nm,且在甲醇溶液中330 nm处的吸收带远大于380 nm处。这主要归因于OTA包含芳香族发色团/其他有机化合物,通常在紫外可见光光谱中显示出强吸收,尤其在紫外区。波长330和380 nm处分别对应OTA的质子化和去质子化状态,即单阴离子(OTA-)和双阴离子(OTA2-)[11,13,19]。结果表明,在酸性溶液中,完全质子化的OTA占主导地位。这归因于在酸性溶液中OTA的羧基pKa值(4.2~4.4)低于酚羟基pKa值(7.0~7.3),所以羧基比酚羟基优先电离,此时OTA以OTA-形态存在。在甲醇溶液中,完全质子化的OTA占主导地位,这是由于OTA和甲醇之间特定的溶质-溶剂相互作用(主要是氢键)。在碱性溶液中,羧基和酚羟基完全电离,此时完全去质子化的OTA2-占主导地位。由于OTA中酸性官能团的羧基的影响,OTA在中性溶液以OTA-和OTA2-形态共存[11,13,20]。

图1 在甲醇、缓冲溶液中OTA的紫外可见光光谱图Fig. 1 UV-Vis spectra of OTA in methanol and buffer solutions at different pH values
OTA在溶液中的荧光性质主要取决于其质子化和去质子化状态。为了考察OTA在不同pH条件下的荧光性质,利用pH 3.0~10.0的缓冲溶液,设置发射波长为450 nm,对其缓冲溶液中的OTA进行了荧光检测,结果如图2所示。由图2可知,在pH 3.0~6.0的缓冲体系溶液中,在340 nm处有明显的荧光波峰,表明在酸性条件下OTA主要以OTA-形态存在,随pH的增大,340 nm处的荧光强度略有下降,但变化不明显;在pH 7.4的缓冲体系溶液中,340和390 nm处均出现荧光波峰,说明OTA-和OTA2-共存,且OTA2-略占优势;在pH 8.0~10.0的缓冲体系溶液中,390 nm处有明显的荧光波峰,表明OTA2-占主导优势。随pH的增大,390 nm处的波峰也逐渐升高,pH 9.0时OTA的荧光强度最大。这主要归因于OTA在不同酸碱度溶液中的解离常数,在酸性溶液中羧基先去质子化,随pH的增大,酚羟基也进行去质子化,促使OTA-向OTA2-转变[11,13]。由图2可见,OTA在pH 6.0,7.4和9.0的缓冲溶液中表现出不同的荧光特性,所以选用这3种pH的缓冲溶液探究了表面活性剂对OTA的荧光性质的影响。
2.2 阳离子型表面活性剂对OTA荧光性质的影响
为了研究阳离子型表面活性剂对OTA荧光性质的影响,选取了质量分数0.01%的3种不同结构特征的PEI、CTAB和PDDA,在pH 6.0,7.4和9.0的缓冲溶液中与无表面活性剂的缓冲溶液对比进行了探究,结果如图3和4所示。固定发射波长450 nm进行扫描,在无表面活性剂的pH 6.0弱酸性环境中,OTA主要以OTA-形态存在;在pH 7.4中性环境中,OTA以OTA-和OTA2-形态存在;在弱碱性环境中,OTA主要以OTA2-形态存在。结果表明:在酸性条件下,OTA仅羧基会电离;在中性条件下,部分酚羟基也开始电离;在碱性条件下,羧基和酚羟基完全电离,促使OTA完全去质子化。与无表面活性剂相比,阳离子型表面活性剂对OTA的荧光特性具有显著的影响,尤其在弱酸性pH 6.0和中性pH 7.4环境中。由于不同阳离子表面活性剂的结构不同,所带正电荷量的差异,PEI、CTAB和PDDA与OTA分别呈现出了不同的荧光特性,并且呈现出一定的规律性(图3)。在pH 6.0和7.4时,加入PEI、CTAB或者PDDA后,390 nm处吸收峰都明显增强,说明阳离子表面活性剂促进了OTA由单阴离子OTA-状态向双阴离子OTA2-转变,而且在pH 7.4时,3种表面活性剂均完全促使OTA去质子化为OTA2-(图4)。在pH 6.0时,PEI/OTA与CTAB/OTA、PDDA/OTA相比,促使OTA-完全去质子化而转化为OTA2-,其对应波峰390 nm处发生了明显升高,这是由于PEI的结构上富含胺基,促使OTA-中的酚羟基发生去质子化作用。在pH 9.0时,相比同浓度的PEI和PDDA,CTAB/OTA2-的波峰明显低于前两者。这可能是低浓度的CTAB会对OTA的溶解性产生一定的影响,使OTA在溶液中的溶解度降低。而且在3种pH缓冲溶液中,OTA与CTAB共存时,均出现OTA2-的波峰右移的现象。
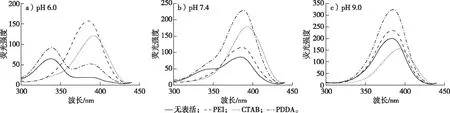
图3 不同阳离子型表面活性剂存在于不同pH缓冲溶液中时OTA的激发光谱图Fig. 3 Fluorescence excitation spectra of OTA in buffers at different pH values in the absence and presence of cationic surfactants

图4 不同表面活性剂存在于不同pH缓冲溶液中时340和390 nm处OTA的荧光强度柱状分析图Fig. 4 Fluorescence intensities of OTA at 340 and 390 nm in buffers at different pH values in the absence and presence of cationic surfactants
为了进一步考察在pH 6.0弱酸性环境中不同浓度的PEI、CTAB、PDDA对OTA的去质子化影响,对3种阳离子型表面活性剂各设置了相同浓度梯度进行了荧光检测,结果如图5和图6所示。当加入PEI后,其质量分数范围为0.001%~0.020%,在340 nm处的波峰均消失,且390 nm处的波峰随PEI质量分数增大而升高,说明极少量的PEI也会使OTA-完全去质子化为OTA2-(图5a)。相比PEI,CTAB的质量分数在0~0.02%范围内,随CTAB质量分数的增大,340 nm处的波峰逐渐降低;相反,390 nm处的波峰逐渐升高,且CTAB的质量分数大于0.01%时,会使OTA-完全向OTA2-转化(图5b和图6)。而在体系溶液中加入质量分数0~0.02%的PDDA时,340和390 nm处均有波峰,随着PDDA质量分数的增大,340 nm处的波峰略有下降的趋势,但下降程度不明显,而390 nm处的波峰逐渐增大(图5c和图6)。由此可知,在酸性条件下,PDDA能够促进OTA-向OTA2-转变,但不能完全转变为OTA2-,而PEI和CTAB在一定质量分数下,均可促使OTA-完全向OTA2-转变。这可能是由于PDDA的正电荷性比PEI和CTAB弱,导致OTA的酚羟基在酸性条件下不能完全去质子化,此时OTA以OTA-和OTA2-形态共存。
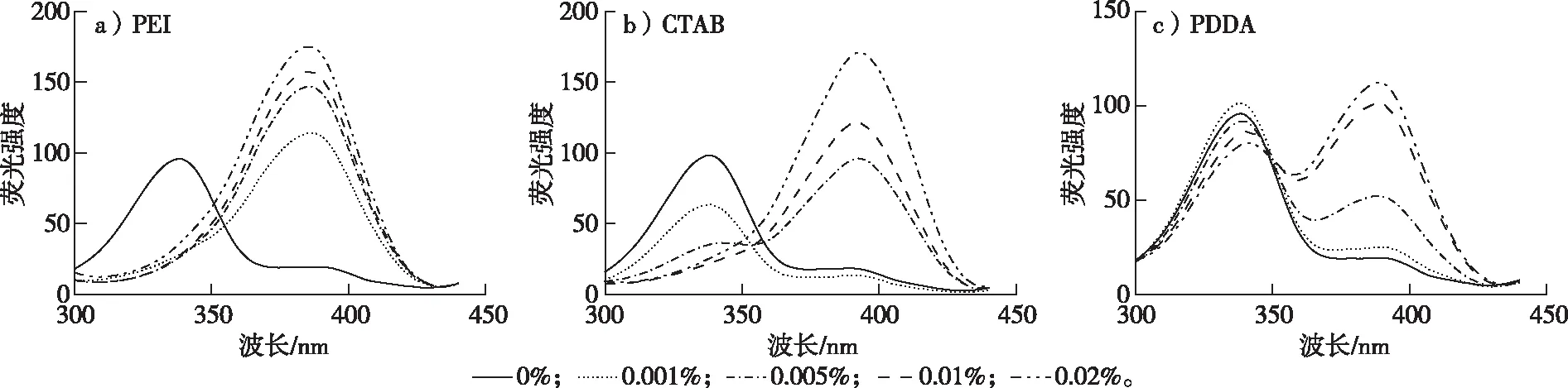
图5 不同浓度的PEI、CTAB、PDDA存在于pH 6.0缓冲溶液中时OTA的激发光谱图Fig. 5 Fluorescence spectra of OTA in pH 6.0 buffered solutions with different cationic surfactants
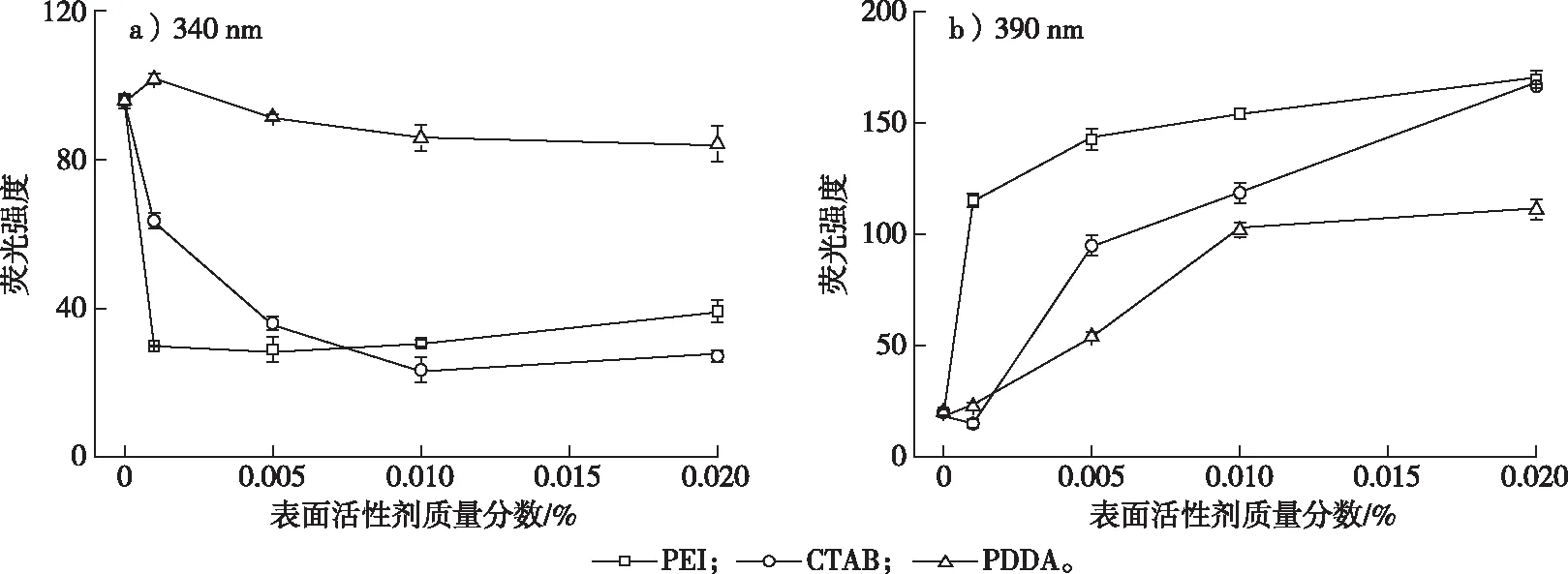
图6 不同浓度表面活性剂存在于pH 6.0缓冲溶液中时OTA在340和390 nm的荧光强度分析Fig. 6 Fluorescence intensities of OTA at 340 and 390 nm in pH 6.0 buffers with cationic surfactants at different concentrations
3 结 论
选用3种阳离子型表面活性剂探讨了它们在不同pH环境中对OTA的去质子化和荧光性质的影响,具体结论如下:
1)pH、阳离子型表面活性剂及它们结合的微环境均可改变OTA的荧光强度和最大波峰位置,对OTA的荧光性质均具有显著的影响。OTA在酸性、中性和碱性环境中存在的形态分别是:OTA-、OTA2-、OTA2-。
2)与无表面活性剂相比,在不同酸碱度缓冲溶液中3种阳离子型表面活性剂PEI、CTAB、PDDA对OTA荧光性质的影响有明显差异。在酸性溶液中,一定质量分数的PEI和CTAB均可使OTA-完全转化为OTA2-,而PDDA使OTA以OTA-和OTA2-共存;在中性条件下,3种表面活性剂均会促使OTA形态由OTA-完全向OTA2-转化。此外,在含有CTAB的3种酸碱度缓冲溶液中,OTA的波峰均出现右移的现象。
研究结果有利于了解OTA在不同微环境中的荧光性质,也为建立OTA的荧光分析方法提供了良好的思路与依据。

