甲状腺激素受体相互作用因子13在B细胞淋巴瘤组织中的表达及其临床意义
钱新月 陈丽花 周泉 沈文艳 莫娟芬 王宙政 韩艳霞 张东凯 张斌忠 胡蓓莉
B细胞淋巴瘤属于非霍奇金淋巴瘤的一种,其异质性很强,疗效差别很大。甲状腺激素受体相互作用因子 13(thyroid hormone receptor interactor 13,TRIP13)是一种AAA-ATP酶,在有丝分裂和减数分裂过程中发挥重要作用[1]。肿瘤的发生往往从DNA损伤开始,TRIP13可重塑希尔丁复合物——一种DNA损伤修复相关的重要物质,从而干扰损伤DNA的修复,导致肿瘤的发生[2]。目前已有研究发现,TRIP13不但与肺癌、胶质瘤、肾癌的发病有关[3-4],而且在惰性B细胞淋巴瘤中也有表达[5]。因此,本研究探讨TRIP13在B细胞淋巴瘤组织中的表达及其临床意义。
1 对象和方法
1.1 对象 选取2018年9月至2020年11月在嘉兴市第二医院就诊后进行淋巴结活检,并留取多余的新鲜淋巴结活检组织冻存的B细胞淋巴瘤患者44例为研究对象,其中男23例,女21例;年龄44~83(66.09±9.64)岁。所有患者病理学诊断结果均为B细胞淋巴瘤。所有患者活检前均未接受任何化疗、放疗或生物学治疗;经病理确诊后按照临床指南规范诊治,接受标准化疗至少2个疗程。参照2016年WHO对B细胞淋巴瘤分型诊断标准,将44例患者分为惰性淋巴瘤组(包括3a级及以下的滤泡淋巴瘤、边缘区淋巴瘤、淋巴浆细胞性淋巴瘤、慢性淋巴细胞白血病、小B细胞淋巴瘤、惰性套细胞淋巴瘤)20例和侵袭性淋巴瘤组(包括3b级滤泡淋巴瘤、弥漫大B细胞淋巴瘤、经典型套细胞淋巴瘤、高级别B细胞淋巴瘤、伯基特淋巴瘤)24例。本研究经嘉兴市第二医院医学伦理委员会审查通过,所有研究对象均签署知情同意书。
1.2 试剂和仪器 Trizol试剂购自美国Sigma公司;PrimeScriptRTMaster Mix逆转录试剂、SYBR Fast qPCR Mix荧光定量PCR试剂盒均购自日本Takara公司;TRIP13 antibody试剂购自美国GeneTex公司;二抗山羊抗兔IgG(H+L)、HRP试剂均购自北京康为世纪生物科技有限公司;NanoDrop分光光度仪购自美国Thermo Scientific公司;ABI Stepone Plus荧光定量PCR仪购自美国ABI公司;Axio LabA1显微镜购自德国蔡司公司。
1.3 TRIP13 mRNA表达水平检测 采用RT-PCR法。使用Trizol试剂提取淋巴结活检组织RNA,并使用NanoDrop分光光度仪检测RNA浓度。按照Prime-ScriptRTMaster Mix逆转录试剂盒说明书所述方法,在冰上配制10 μl的逆转录反应液,37℃ 15 min,85℃5 s,4℃结束反应。反应结束后按照SYBR Fast qPCR Mix荧光定量PCR试剂盒说明在冰上配制20 μl反应体系。以甘油醛-3-磷酸脱氢酶(glyceraldehyde 3-phosphate dehydrogenase,GAPDH)为内参,引物序列由上海生工科技生物公司合成。GAPDH上游引物:5'-GGAAGCTTGTCATCAATGGAAATC-3',下游引物:5'-TGATGACCCTTTTGGCTCCC-3';TRIP13 上游引物:5'-TGCAGCAAATCACTGGGTTCT-3', 下 游 引 物 :5'-GGTTCCAGGTGATGAGGTTGC-3'。将逆转录反应液与反应体系轻轻混匀后放置在ABI Stepone Plus荧光定量PCR仪上。PCR扩增标准程序:95℃预变性30 s;PCR反应:95℃ 5 s,60℃ 30 s,共40个循环。反应结束确认熔解曲线,采用2-ΔΔCt法计算RNA的相对表达量。
1.4 TRIP13蛋白表达检测 采用En Vison免疫组化染色法。淋巴瘤组织石蜡切片脱蜡至水。3%过氧化氢室温孵育消除内源性过氧化物酶的活性。蒸馏水冲洗3遍后PBS浸泡,5%正常山羊血清封闭,室温孵育后弃血清。滴加一抗工作液,4℃过夜。洗涤,滴加二抗,37℃孵育30 min。洗涤,滴加适量辣根酶,37℃孵育30 min。洗涤,滴加显色剂显色。在Axio LabA1显微镜下,每张切片随机选取至少4个不同高倍视野(×400),每个视野计数200个肿瘤细胞。阳性细胞的胞质或胞核着色,淡黄色为弱染色,棕黄色为中度染色,棕褐色为强染色。无染色为0,<25%的肿瘤细胞呈弱染色为1+,25%~50%的肿瘤细胞呈中度染色为2+,>50%~100%的肿瘤细胞呈强染色为3+。根据TRIP13免疫组化表达情况,将B细胞淋巴瘤患者分为TRIP13阴性组(0)和TRIP13阳性组(≥1+),比较两组患者的临床特征;再根据TRIP13免疫组化表达强度,将TRIP13阳性患者分为TRIP13弱阳性组(1+)和TRIP13强阳性组(≥2+),比较两组患者的临床特征。
1.5 临床资料收集 收集所有患者性别、年龄、B细胞淋巴瘤分型情况、增殖指数(Ki-67)、乳酸脱氢酶、β2微球蛋白、白蛋白水平、外周血淋巴细胞计数、外周血淋巴细胞亚群指标包括T淋巴细胞比例、T辅助细胞比例、T抑制细胞比例、B细胞比例、NK细胞比例、活化CD4+细胞比例、活化CD8+细胞比例及CD4+/CD8+。按照《美国国立综合癌症网络B细胞淋巴瘤治疗指南》规范治疗2个疗程后采用Lugarno评估标准评估疗效[6],统计2个疗程达完全缓解(complete response,CR)及未达CR的例数。
1.6 统计学处理 采用SPSS 20.0统计软件。符合正态分布的计量资料以表示,组间比较采用两独立样本t检验;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-Whitney U检验。计数资料组间比较采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 惰性淋巴瘤组和侵袭性淋巴瘤组TRIP13 mRNA表达水平比较 惰性淋巴瘤组和侵袭性淋巴瘤组TRIP13 mRNA表达水平分别为0.37(0.17,1.36)和0.69(0.28,1.15),两组比较差异无统计学意义(Z=-0.141,P>0.05)。
2.2 B细胞淋巴瘤患者TRIP13蛋白表达情况分析免疫组化染色显示,TRIP13可表达于淋巴瘤细胞的细胞核中,也可表达于淋巴瘤细胞的胞质中。根据TRIP13 免疫组化表达情况,分为 0、1+、2+、3+四个等级,见图1(插页)。TRIP13免疫组化为0者12例,1+者20例,2+者9例,3+者3例。
2.3 不同TRIP13免疫组化表达强度B细胞淋巴瘤患者的临床特征比较
2.3.1 TRIP13阴性组和TRIP13阳性组患者临床特征比较 44例B细胞淋巴瘤患者中,TRIP13阴性组12例,TRIP13阳性组 32例。TRIP13阳性组患者TRIP13 mRNA表达水平、Ki-67水平及活化CD8+细胞比例均高于TRIP13阴性组,T辅助细胞比例、活化CD4+细胞比例、CD4+/CD8+均低于TRIP13阴性组,差异均有统计学意义(均P<0.05)。而两组患者性别、年龄、B细胞淋巴瘤分型、乳酸脱氢酶水平、β2微球蛋白水平、白蛋白水平、外周血淋巴细胞计数、T淋巴细胞比例、T抑制细胞比例、B细胞比例、NK细胞比例、2个疗程达CR例数比较差异均无统计学意义(均P>0.05),见表1。
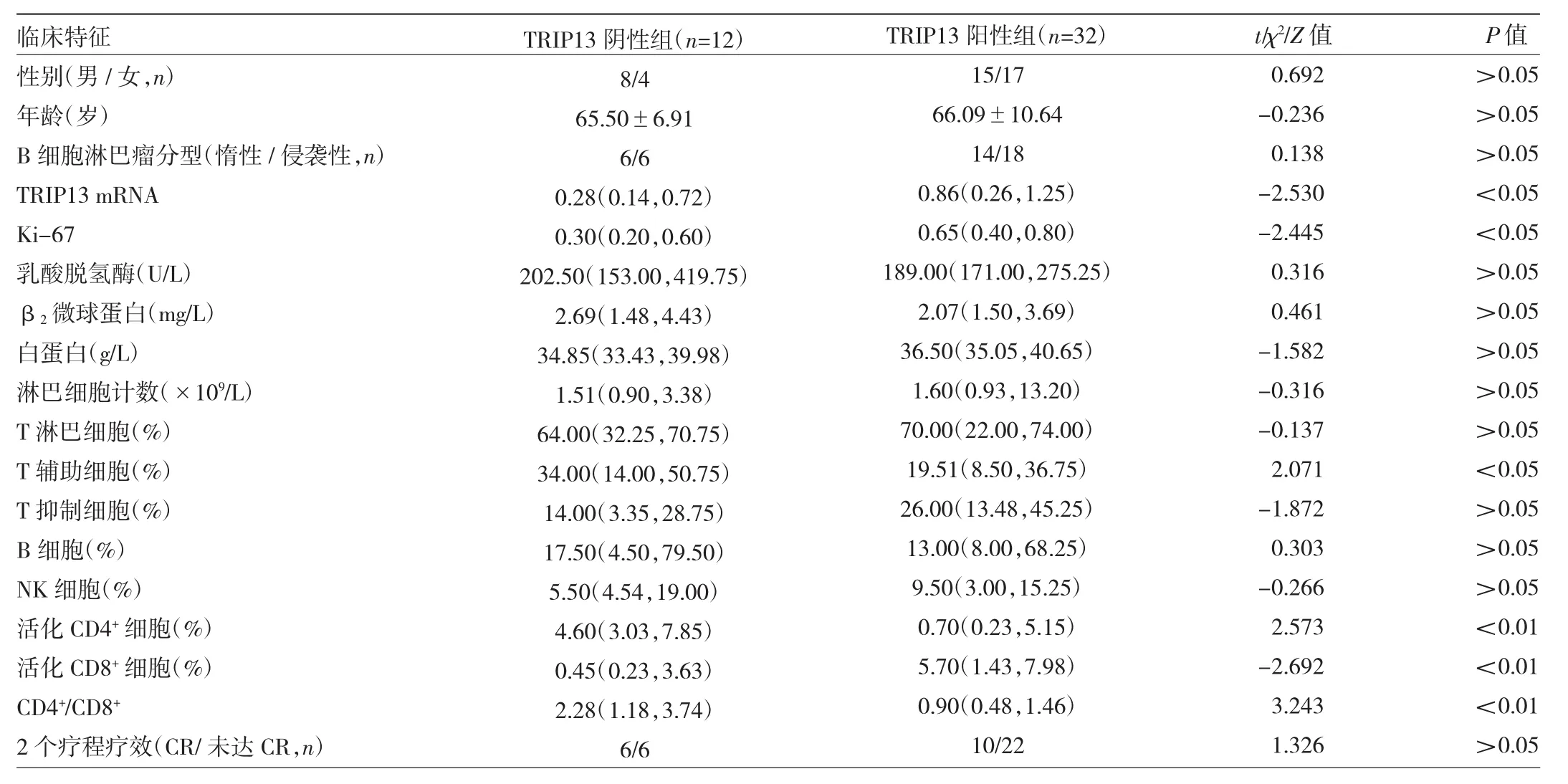
表1 TRIP13阴性组和TRIP13阳性组患者临床特征比较
2.3.2 TRIP13弱阳性组和TRIP13强阳性组患者临床特征比较 32例TRIP13阳性患者中,TRIP13弱阳性组20例,TRIP13强阳性组12例。TRIP13弱阳性组患者TRIP13 mRNA表达水平、Ki-67水平、活化CD8+细胞比例均低于TRIP13强阳性组,活化CD4+细胞比例、CD4+/CD8+均高于TRIP13强阳性组,差异均有统计学意义(均P<0.05)。而两组患者性别、年龄、B细胞淋巴瘤分型、乳酸脱氢酶水平、β2微球蛋白水平、白蛋白水平、外周血淋巴细胞计数、T淋巴细胞比例、T辅助细胞比例、T抑制细胞比例、B细胞比例、NK细胞比例、2个疗程达CR例数比较差异均无统计学意义(均 P>0.05),见表 2。
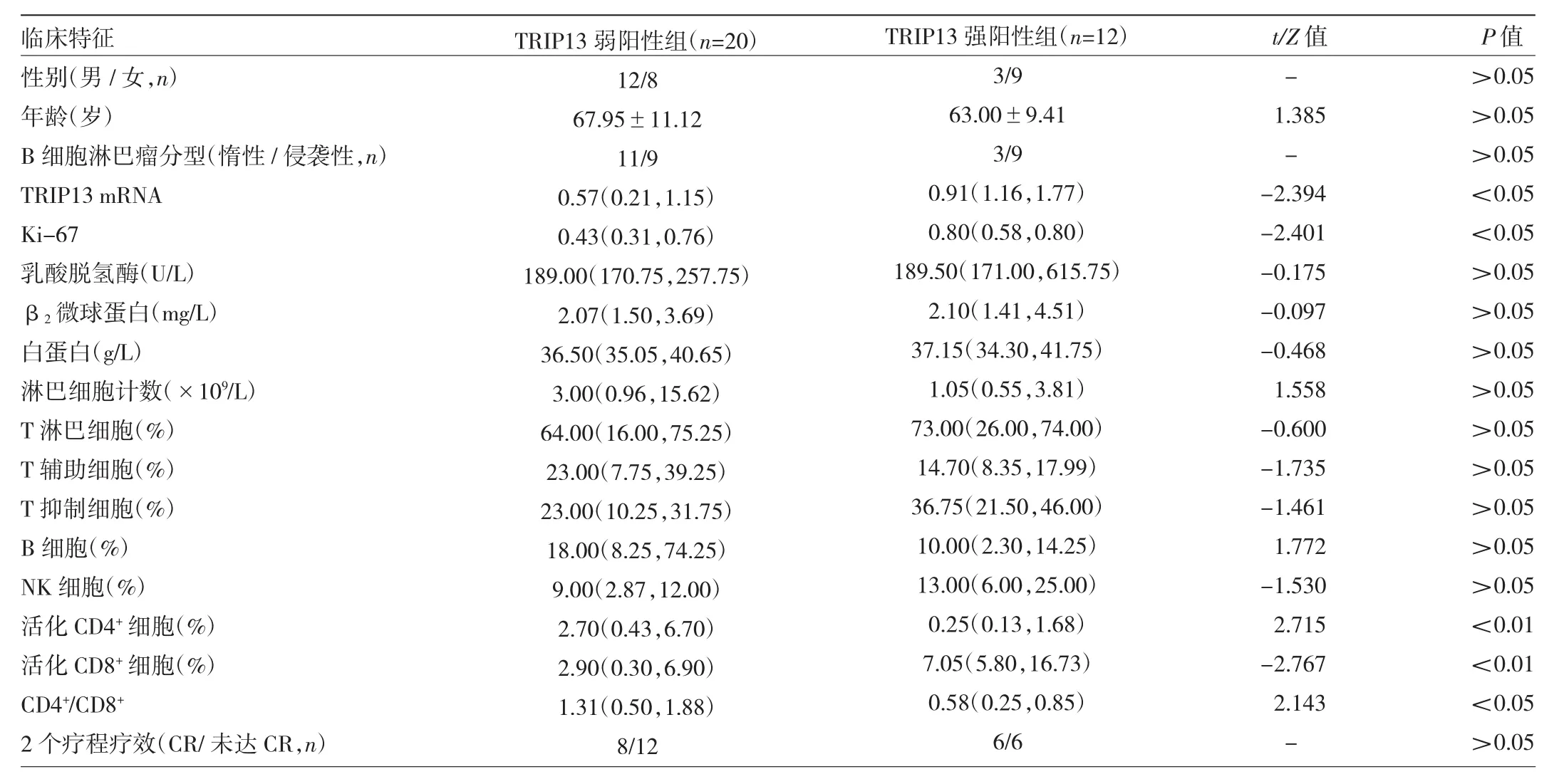
表2 TRIP13弱阳性组和TRIP13强阳性组患者临床特征比较
3 讨论
TRIP13作为一种新型的有丝分裂检查点沉默蛋白,是一种AAA-ATP酶。它与亚基闭合型有丝分裂阻滞缺陷蛋白2(closed mitotic arrest deficiency protein 2,c-Mad2)结合能够导致有丝分裂检查点复合物(mitotic checkpoint complex,MCC)的失活,从而导致姐妹染色单体错误分离[7]。
本研究结果显示,免疫组化TRIP13阴性组和阳性组之间、TRIP13弱阳性组和强阳性组患者之间TRIP13 mRNA表达水平比较差异均有统计学意义,提示免疫组化法测定TRIP13在淋巴瘤组织中的表达情况与使用RT-PCR方法检测组织中TRIP13的mRNA水平具有较好的一致性,免疫组化法测定TIRP13的表达情况一定程度上可以反映其组织中的基因水平。在临床特征上,本研究结果显示,TRIP13阳性组和阴性组相比、TRIP13强阳性组与弱阳性组相比,具有更高的Ki-67水平,提示TRIP13的表达与B细胞淋巴瘤的癌细胞具有更高增殖速度存在一定的内在联系。这和实体瘤的研究结果一致,即染色体不稳定是癌细胞产生的遗传学机制,TRIP13过表达触发有丝分裂检查点过早的沉默可能促进癌症发展及肿瘤细胞的增殖[8]。这一点已在很多实体瘤中被证实[9-12]。在血液系统肿瘤中,TRIP13是高危多发性骨髓瘤(multiple myeloma,MM)中过度表达的 70个基因之一[13],也是构成 MM染色体不稳定性特征的10个基因之一[14]。研究发现,在T细胞淋巴瘤中,蕈样真菌病肿瘤组织中TIRP13表达水平高于对照组[15]。
本研究还发现,TRIP13的免疫组化情况和淋巴细胞亚群有关。TRIP13阳性组和阴性组相比、TRIP13强阳性组与弱阳性组相比,活化CD4+细胞比例更低,活化CD8+细胞比例更高。以往研究发现,CD4+T淋巴细胞数越低,CD8+T淋巴细胞数越高,分期越晚,预后越差[16]。提示细胞免疫与B细胞淋巴瘤的进展有一定相关性。研究发现,与健康人群相比,弥漫大B细胞淋巴瘤患者外周血淋巴细胞亚群具有更低的CD4+T细胞比例和更高的CD8+T细胞比例[17]。可能和淋巴瘤的发生过程中,淋巴细胞亚群发生应激性变化有关。本研究发现,TRIP13表达强度不但与淋巴瘤细胞Ki-67水平有关,而且与T淋巴细胞亚群的应激性反应程度有关。TRIP13阳性组和阴性组相比、TRIP13强阳性组与弱阳性组相比,T细胞免疫应激情况更紊乱。研究发现在MM中,CD4+细胞比例、CD4+/CD8+下降,也提示存在免疫紊乱[18],和本研究结果相符。但在胶质瘤中,与低 TRIP13水平肿瘤组织相比,高TRIP13水平肿瘤组织CD8+T细胞特异性基因与调节性 T细胞特异性基因mRNA水平降低[19],似乎和本研究不符。这可能与胶质瘤和淋巴瘤在肿瘤发生、发展中细胞免疫反应存在一定差异有关。
本研究还发现TRIP13阴性组和TRIP13阳性组、TRIP13弱阳性组和TRIP13强阳性组患者2个疗程达CR例数比较差异均无统计学意义。虽然有研究表明TRIP13可激活Akt信号通路,导致包括MAD在内的蛋白质的泛素化、磷酸化和降解,从而导致肿瘤的化学抗药性[20],但本研究结果并未反映这一点,考虑可能与样本量较小有关。
综上所述,本研究采用免疫组化法分析B细胞淋巴瘤组织中TRIP13蛋白表达情况,发现TRIP13蛋白表达水平与mRNA水平一致,且TRIP13阳性及强阳性与更高的Ki-67水平、活化CD8+细胞比例及更低的活化CD4+细胞比例有关。提示TRIP13阳性可能和肿瘤细胞增殖及免疫调控异常等发病机制有关。

