骨保护素保护关节软骨细胞作用机制研究
高智 徐洪伟 徐宏光 张晓玲 马明明 徐永明
膝关节骨性关节炎(knee osteoarthritis,KOA)是老年退变性疾病中最常见的炎症性疾病之一,发病率逐年升高,发病年龄呈年轻化趋势[1-2]。研究表明我国40岁以上人群KOA的发病率已达15.6%,KOA引发的疼痛困扰着约8.1%的国人[3-4]。KOA的主要病理特征表现为关节软骨退变和损伤,它可以导致关节疼痛、活动受限、甚至关节畸形等,最终导致关节活动能力丧失[5-6]。因为KOA病因不明,目前尚无特效药物能够治疗[6]。研究表明,TNF-α、IL-1β、IL-6 等细胞因子直接或间接参与关节的炎症反应及退变进程,并最终引起关节软骨和滑膜的破坏,导致KOA的发生[7-8]。NF-κB信号通路在调控关节软骨细胞的炎症中处于主导地位[9-10]。有研究表明,骨保护素(osteoprotegerin,OPG)在一定程度上能缓解KOA的病情,但其具体作用机制尚不明确[11-12]。OPG能竞争性阻断NF-κB受体活化因子配体(receptor activator of NF-κB ligand,RANKL)与其受体的相互结合,调控NF-κB信号通路,抑制破骨细胞进一步分化成熟,最终导致破骨细胞发生凋亡[13]。OPG是否通过调控NF-κB信号通路延缓关节软骨的破坏值得进一步研究。本研究团队前期使用FX-5000TM细胞体外力学刺激装置建立模型,对体外培养的关节软骨细胞应用不同力学试验,选取合适的力学刺激及频率(在不影响细胞存活率的情况下关节软骨细胞逐渐开始退变)作用关节软骨细胞引起NF-κB信号通路的激活并使关节软骨细胞退变[14]。本研究在此模型基础上进一步研究OPG保护关节软骨细胞的具体作用机制。
1 材料和方法
1.1 实验动物 清洁级SD成年大鼠8只,7周龄,体重(140±20)g,由上海斯莱克实验动物有限公司提供[SCXK(沪)2014-0002]。大鼠饲养环境严格遵守《实验动物管理条例》,专用鼠类动物饲养笼内饲养,自由进食复合型鼠粮,自由饮水,室温控制在24℃左右,12 h光照12 h黑暗交替。所有操作均符合中国科学院上海生命科学院动物实验研究相关伦理学要求。
1.2 试剂和仪器 二型胶原酶(美国Sigma公司,批号:C6885);胰蛋白酶(美国 Gibco公司,批号:R001100);FBS(美国 Gibco 公司,批号:10099);DMEM/F12(美国 Hyclone公司,批号:SH30023.01B);OPG(美国Minneapolis公司,批号:CB35786656);Trizol(美国Invitrogen公司,批号:15596026);Real-Time PCR 试剂盒(中国TOYOBO公司,批号:QPK-201);细胞核蛋白提取试剂盒(中国生工公司,批号:C50009);兔抗鼠磷酸化 p65(p-p65)抗体(美国 Cell Signaling Technology公司,批号:3036);兔抗鼠p65抗体(美国Cell Signaling Technology 公司,批号:9460);兔抗鼠基质金属蛋白酶 13(matrix metalloproteinase 13,MMP-13)抗体(美国 Bioworld Technology公司,批号:BS1231);山羊抗兔二抗(美国Bioworld Technology公司,批号:BS10003);细胞计数仪(美国Invitrogen公司,型号:countess3);超微量分光光度计(美国Thermo& Scientific公司,型号:NanoDrop 2000);WB 凝胶成像系统(中国 Tanon公司,型号:T1600);Real-Time PCR 仪(德国Roche公司,型号:Roche LightCycler480);TaKaRa反转录试剂盒(日本 TaKaRa公司,批号:6210A-1);细胞体外力学刺激装置(美国Flexcell公司,型号:Flexcell FX-5000TM);表面附着鼠尾胶原的BioFlexTM6孔多向加力板(美国Fexcell公司,型号:BF-4002C)。
1.3 分离培养大鼠原代膝关节软骨细胞 取8只清洁级SD大鼠,颈椎脱臼法处死后消毒,于负压超净台内取出关节软骨,剪碎,胰蛋白酶恒温震荡消化30 min,含10%FBS的DMEM/F12培养液终止消化,PBS仔细清洗后加入0.2%二型胶原酶消化,消化期间,每隔约15 min轻轻震荡培养皿1次,6 h后将培养皿内液体倒入70目的滤筛中过滤离心后均匀播种于10 cm培养皿内,用含10%FBS的DMEM/F12培养液培养传代至P2代进行实验。
1.4 实验分组 将P2代大鼠关节软骨细胞随机分为对照组、间歇性循环牵张力(intermittent cyclic mechanical tension,ICMT)加力组(ICMT组)、OPG组、ICMT 3 d+OPG组。对照组:在含10%FBS的DMEM/F12细胞培养液的BioFlexTM6孔多向加力板上接种培养关节软骨细胞,在37℃、5% CO2的培养箱中培养,培养3 d;其他各组基础培养条件均与对照组相同。ICMT组:将接种后的细胞放置在细胞体外力学刺激装置内,设置加力参数:8%压强的ICMT,0.5 Hz,10 h/d,即0.5 Hz频率,8%压强的ICMT对细胞每天力学刺激10 h,对细胞加力1 d设为ICMT 1 d组,加力2 d设为ICMT 2 d组,加力3 d设为ICMT 3 d组。OPG组:使用含浓度为5、10、20 ng/ml OPG的细胞培养液分别处理关节软骨细胞,根据OPG浓度设为5 ng OPG组、10 ng OPG组和20 ng OPG组,培养时间为3 d。ICMT 3 d+OPG组:在对细胞进行加力前3 h使用含浓度为5、10、20 ng/ml OPG的细胞培养液分别处理关节软骨细胞,分别设为ICMT 3 d+5 ng OPG组、ICMT 3 d+10 ng OPG组、ICMT 3 d+20 ng OPG组。
1.5 关节软骨细胞形态学观察 采用甲苯胺蓝染色法。取对照组、ICMT 3 d组、ICMT 3 d+20 ng OPG组软骨细胞。PBS洗涤细胞2次,4%多聚甲醛固定细胞,适量的甲苯胺蓝染色细胞1 h,晾干后用倒置相差光学显微镜进行观察并拍照。观察染色前各组细胞形态学变化及染色后各组细胞表型的变化。
1.6 细胞存活率检测 采用四噻唑蓝[3-(4,5-dimethylthiazol-2-yl) -2,5-diphenyltetrazolium bromide,MMT]法。将对照组、ICMT 1 d 组、ICMT 2 d 组、ICMT 3 d组、5 ng OPG组、10 ng OPG组和20 ng OPG组关节软骨细胞分别接种在96孔板中培养,各孔加入100 μl MTT并孵育4 h后用DMSO处理细胞。酶标仪测定各孔波长630 nm处吸光度(OD)值。细胞存活率=实验组OD值/对照组OD值×100%。
1.7 关节软骨细胞中二型胶原、蛋白聚糖、SRY相关高迁移率族盒蛋白9(SRY-related high-mobility-group box gene 9,SOX-9)、MMP-13 mRNA 表达水平检测采用RT-PCR法。取对照组、ICMT 1 d组、ICMT 3 d组、ICMT 3 d+5 ng OPG组、ICMT 3 d+10 ng OPG组、ICMT 3 d+20 ng OPG组关节软骨细胞,分别在各细胞培养孔中加入1 ml Trizol,充分裂解后,提取RNA,30 μl DEPC水溶解RNA,Nano-Drop 2000超微量分光光度计检测RNA的纯度,选取合格样品(RNA OD260/OD280值为 1.8~2.0)。取 1 μg关节软骨细胞的 RNA,按照20 μl反转体系反转成cDNA,用稀释10倍的cDNA进行RT-PCR。RT-PCR扩增体系量为10 μl[SYBR Premix ExTaqTM(2X)5 μl,ROX Reference Dye(50X)0.2 μl,PCR 上游引物(10 mol/L)0.4 μl,PCR 下游引物(10 mol/L)0.4 μl,稀释的 cDNA 模板 4 μl]。同一样品需要设置3个重复孔,点样混匀放入Real-Time PCR仪中。按照设定好的程序进行转录(95℃预变性30 s,95℃变性5 s,60℃退火延伸25 s,扩增50个循环,溶解曲线分析:95 ℃ 0 s,65 ℃15 s,95 ℃ 0 s)。所得结果用Real-Time PCR仪自带软件Roche LightCycler480 进行分析,计算 2-ΔΔCt值,获得关节软骨细胞各基因的表达情况。RT-PCR引物序列见表1。

表1 RT-PCR引物序列
1.8 关节软骨细胞中 MMP-13、p65、p-p65蛋白表达水平检测 采用Western blot法。取ICMT 3 d组、ICMT 3 d+5 ng OPG组、ICMT 3 d+10 ng OPG组、ICMT 3 d+20 ng OPG组细胞,用200 μl蛋白提取裂解液(RIPA)和 2 μl 100×PMSF 加入各孔裂解 30 min后移入EP管中,12 000 r/min离心15 min,留取上清液为软骨细胞蛋白;用BCA定量法检测各组蛋白浓度。根据所测的蛋白浓度,按照20 μg每组的蛋白量,计算取液量。SDS-PAGE凝胶电泳后转膜,5%BSA液封闭膜后抗体孵育,洗膜,凝胶成像系统显影成像并拍照。应用Image J软件分析Western blot条带灰度值。p65蛋白磷酸化后变成p-p65蛋白代表NF-κB信号通路的激活,激活后会引起细胞内MMP-13蛋白的升高。
1.9 统计学处理 采用SPSS 18.0统计软件。计量资料以表示,组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 关节软骨细胞形态学观察 显微镜下观察关节软骨细胞受到ICMT 3 d刺激后,细胞形态发生变化,呈鹅卵石样排布,形态近似圆形的关节软骨细胞开始出现排布散乱并呈现出偏似于梭形的形态。染色后可以发现力学刺激后关节软骨细胞的细胞外基质出现淡染现象。在ICMT的作用下,关节软骨细胞发生了退变,而用OPG预处理后的ICMT组细胞,这种现象得到一定程度的逆转,见图1(插页)。
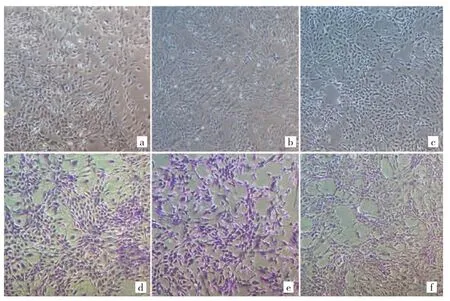
图1 关节软骨细胞形态及表型鉴定(a:对照组;b:ICMT 3 d组;c:ICMT 3 d+20 ng OPG组;倒置相差光学显微镜,×40;d:对照组;e:ICMT 3 d 组;f:ICMT 3 d+20 ng OPG 组;甲苯胺蓝染色,×40)
2.2 各组关节软骨细胞存活率比较 ICMT 1 d组、ICMT 2 d组、ICMT 3 d组与对照组关节软骨细胞存活率比较,差异均无统计学意义(均P>0.05),见图2。5 ng OPG组、10 ng OPG组和20 ng OPG组与对照组关节软骨细胞存活率比较,差异均无统计学意义(均 P>0.05),见图 3。
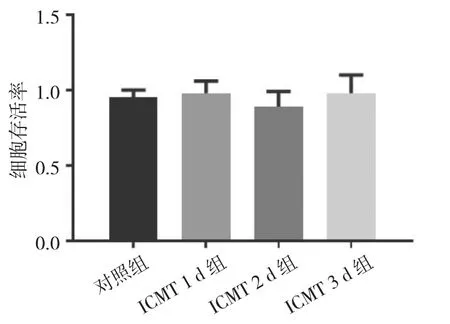
图2 ICMT刺激下各组关节软骨细胞存活率比较
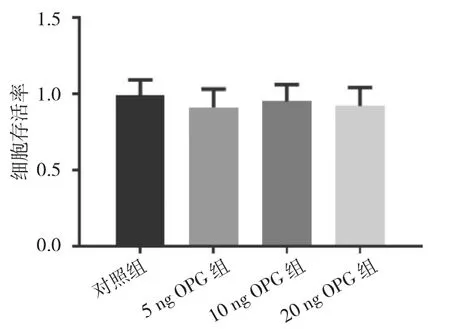
图3 不同浓度OPG作用下各组关节软骨细胞存活率比较
2.3 各组关节软骨细胞中二型胶原、蛋白聚糖、SOX-9、MMP-13 mRNA表达水平比较 与对照组比较,ICMT 1 d组、ICMT 3 d组细胞中二型胶原、蛋白聚糖、SOX-9 mRNA表达水平均下降,ICMT 3 d组细胞中MMP-13 mRNA表达水平升高,差异均有统计学意义(均 P<0.05),见图 4。与 ICMT 3 d组比较,ICMT 3 d+10 ng OPG组细胞中二型胶原、SOX-9 mRNA表达水平均升高,ICMT 3 d+20 ng OPG组细胞中二型胶原、蛋白聚糖、SOX-9 mRNA表达水平均升高,ICMT 3 d+10 ng OPG组、ICMT 3 d+20 ng OPG组细胞中MMP-13 mRNA表达水平均下降,差异均有统计学意义(均 P<0.05),见图 5。
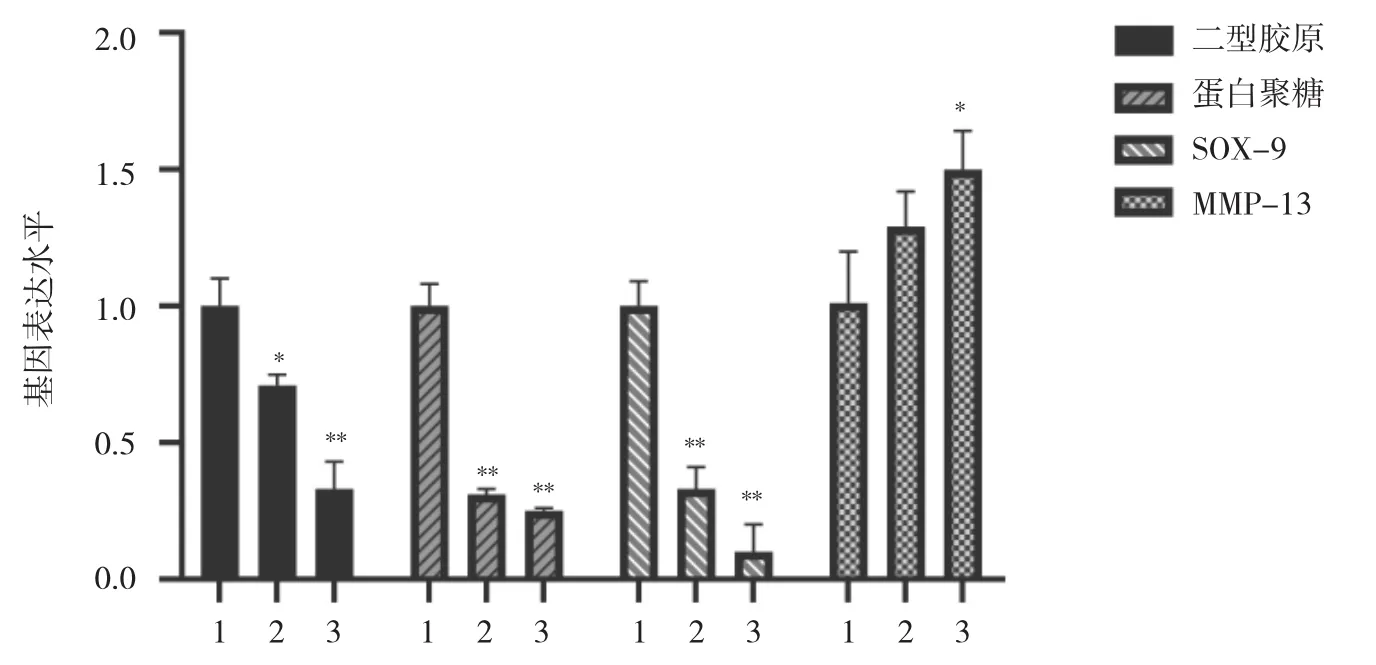
图4 ICMT刺激下各组关节软骨细胞相关基因表达变化
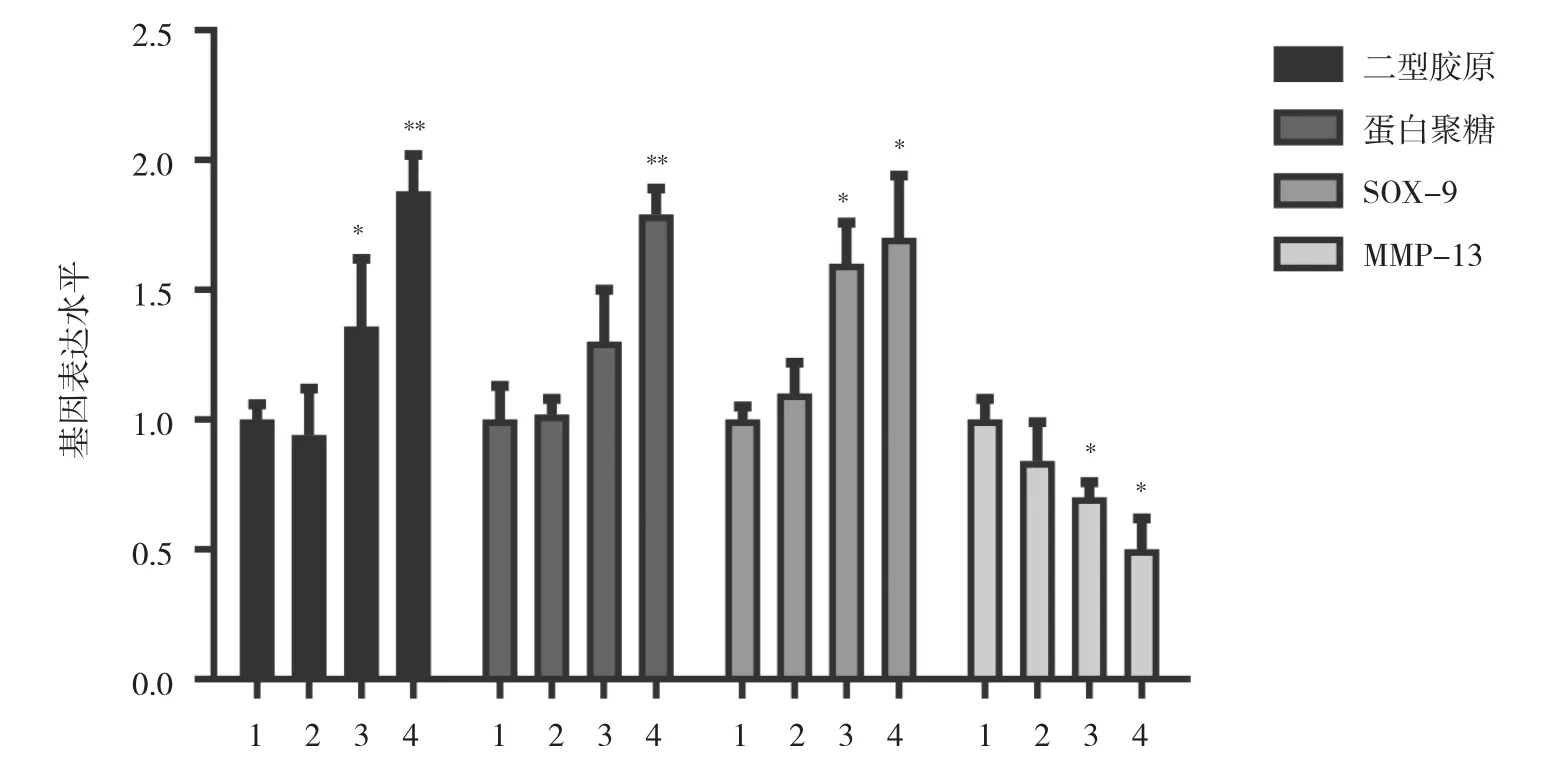
图5 OPG处理下ICMT刺激关节软骨细胞相关基因表达变化
2.4 各组关节软骨细胞中MMP-13、p-p65蛋白表达水平比较 与ICMT 3 d组比较,ICMT 3 d+5 ng OPG 组、ICMT 3 d+10 ng OPG 组、ICMT 3 d+20 ng OPG组MMP-13蛋白表达水平均下降,差异均有统计学意义(均P<0.05),见图6和表2。与ICMT 3 d组比较,ICMT 3 d+10 ng OPG组、ICMT 3 d+20 ng OPG组p-p65蛋白表达水平均下降,差异均有统计学意义(均 P<0.05),见图 7和表 2。
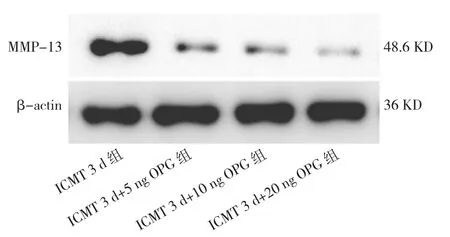
图6 各组细胞中MMP-13蛋白表达的电泳图
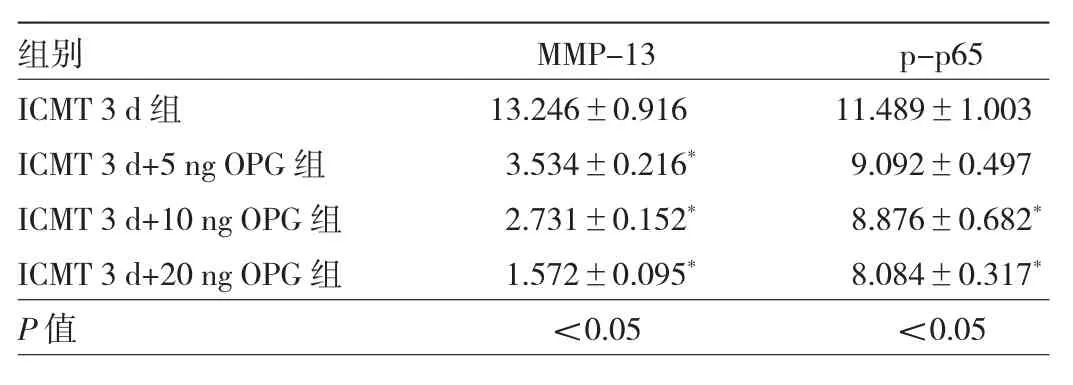
表2 各组细胞中MMP-13和p-p65蛋白表达水平比较

图7 各组细胞中p-p65蛋白表达的电泳图
3 讨论
KOA的病因主要为关节软骨的破坏,不恰当的力学刺激会导致关节软骨的破坏,进而使关节软骨无法缓解运动过程中的正常力学刺激,导致关节出现功能障碍并引起疼痛[15-16]。目前认为,不恰当的力学刺激除了对关节软骨产生直接破坏外,其也会导致关节内的炎症因子释放并使关节发生慢性炎症反应,逐步引起关节的退变[17-19]。
本研究模拟生物膝关节力学产生原理,给体外的关节软骨细胞以0.5 Hz,8%压强的ICMT,通过各种不同的实验方法,证明了力学刺激在不引起软骨细胞发生凋亡的前提下,细胞逐渐出现自然退变。本研究发现在细胞退变的过程中,NF-κB信号通路起主导作用,NF-κB信号通路激活后,通过调控表达一系列降解酶的产生,分解细胞基质中细胞赖以生存的物质,引起细胞的退变、裂解、坏死,其中MMP-13是NF-κB信号通路激活后导致细胞退变的关键性物质,其产生的多少与信号通路的激活程度呈正相关[20-21]。
OPG作为一种生长因子受体,在多种细胞中具有抑制NF-κB信号通路的能力[13]。目前OPG在关节软骨细胞退变中的作用机制缺乏相关研究,本研究通过力学的作用模拟出关节软骨细胞体外退变的过程发现,力学刺激后关节软骨细胞中NF-κB信号通路激活,软骨细胞发生炎症反应和退变,MMP-13表达升高,引起细胞外基质二型胶原、蛋白聚糖、SOX-9的降解,细胞形态学改变。而在细胞受到力学刺激过程中,应用合适浓度的OPG处理细胞,可观察到NF-κB信号通路被抑制,MMP-13表达降低,关节软骨细胞中重要物质二型胶原、蛋白聚糖、SOX-9未随着力学刺激发生明显降解。
综上所述,本研究认为OPG通过调控NF-κB信号通路延缓力学刺激引起的关节软骨细胞退变,起到保护关节软骨和膝关节的重要作用,在治疗膝关节炎和预防膝关节退变中具有广阔的前景。

