黄芪甲苷对STZ诱导的1型糖尿病小鼠肾组织galectin-3/ERK1/2信号通路的影响
★ 宋高峰 翁文慈 王文静 彭玲(.深圳市中医院肾病科 广东 深圳 58033;.广州中医药大学第四临床医学院 广东 深圳 58033)
糖尿病肾病(diabetic kidney disease,DKD)是糖尿病最常见且严重的微血管并发症之一,是导致终末期肾病的主要原因,严重影响患者的生活质量[1]。DKD的发病机制甚为复杂,涉及血流动力学异常、线粒体功能失调、脂代谢紊乱、晚期糖基化终末产物(AGEs)形成增加、氧化应激等多种因素,目前尚缺乏特效的治疗药物。
半乳糖凝集素-3(galectin-3)是半乳糖结合素家族的的重要成员之一,主要由巨噬细胞分泌,其在细胞黏附、增殖、活化和凋亡等方面发挥着重要的调节作用,参与了炎症及纤维化等病理过程,可能成为癌症、免疫炎性及代谢性疾病治疗的新型靶标[2]。研究表明,galectin-3与DKD关系密切。galectin-3与DKD患者尿蛋白及血肌酐存在显著相关性,随着病情的加重,galectin-3在血清中的表达逐渐升高,其表达量与尿蛋白呈正相关,与血肌酐呈负相关[3]。galectin-3可能参与了DKD的发生、发展,但其具体作用机制目前尚不明确。
黄芪甲苷(Astragaloside Ⅳ,AS-Ⅳ)是黄芪药理活性的主要成分之一,近年来AS-Ⅳ的肾脏保护作用越来越受到重视。AS-Ⅳ可通过抗氧化[4]、减轻炎症反应[5]等多种作用机制发挥保护肾功能、减轻蛋白尿,治疗DKD的作用。然而AS-Ⅳ对DKD的保护作用是否与调控galectin-3有关尚未见报道。本研究基于galectin-3/ERK1/2信号通路进一步研究AS-Ⅳ对小鼠DKD的保护作用及机制。
1 材料与方法
1.1 实验动物
5~6 周龄雄性 C57BL /6J小鼠,体重为 16~18 g,购自广东省医学实验动物中心。
1.2 主要药物与试剂
链脲佐菌素(streptozotocin,STZ,美国Sigma-Aldrich公司);AS-Ⅳ(成都康邦生物科技有限公司);galectin-3一抗(美国abcam公司);p-ERK1/2一抗(美国Cell Signaling Technology公司);尿白蛋白ELISA试剂盒(美国Bethyl公司);β-actin抗体(美国Sigma-Aldrich公司);二抗(美国Cell Signaling Technology公司)。
1.3 主要仪器
垂直电泳仪、转膜仪、全自动凝胶成像和化学发光图像分析系统(美国Bio-Rad Laboratories公司);荧光显微镜及成像系统(日本NIKON公司);血糖仪及试纸(瑞士Roche公司)。
1.4 造模与分组
C57BL/6J小鼠30只,适应性饲养1周后,采用随机数字表法,取10只为正常组,其余20只为模型组。造模前禁食不禁水12 h,糖尿病模型组小鼠给予一次性腹腔注射STZ(溶解于0.1 mol/L枸橼酸盐缓冲液中,pH值4.6,200 mg/kg),正常对照组注射相当体积的枸橼酸盐缓冲液,于72 h后小鼠尾静脉取血测血糖,随机血糖>16.7 mmol/L,则确认模型成功。剔除血糖未达标的小鼠。取造模成功的小鼠,采用随机数字表法,分为模型组(STZ组,n=6),AS-Ⅳ治疗组(STZ+AS-Ⅳ组,n=6)。另外从正常小鼠选组6只作为对照组(Control组)。Control 组和STZ组给予标准饲料喂养,STZ + AS-Ⅳ组给予添加AS-Ⅳ的饲料喂养(按5 g∶1 kg比例将AS-Ⅳ和饲料混匀,塑形封装后经钴60照射),共计观察8周。
1.5 标本采集及保存
在给药8周后,于实验动物处死前1 d将各组大鼠分别放置于代谢笼中,收集24 h尿液并记录尿量,采集小鼠8周时血清及肾脏组织标本。步骤如下:水合氯醛麻醉后,摘除眼球快速留取血液标本1 mL,4 ℃,3 000 r/min,离心10 min,取血清装入1.5 mL EP管中,-80 ℃冻存备用。取血结束后立即断颈处死,沿腹正中线剖开腹腔,取出肾脏,去掉被膜,滤纸吸干血迹后左肾纵向切为两半,取一半置于10%中性甲醛固定做病理检查。另一半及右肾组织分离皮髓质后装入1.5 mL EP管中,液氮快速冷冻后保存于-80 ℃超低温冰箱,用于Western blotting检测。
1.6 标本检测
血肌酐及尿素氮由深圳市中医院检验科检测,尿白蛋白使用ELISA方法测定,各组小鼠禁食6 h后用罗氏血糖仪测定空腹血糖,各指标检测均按照相应的试剂盒说明书进行操作。免疫组化染色鉴定galectin-3及p-ERK1/2在肾组织中的表达定位,Western blot方法检测肾皮质组织中galectin-3、p-ERK1/2的蛋白含量。
1.7 肾组织病理学检查
肾组织石蜡切片行PAS染色后,每组随机选取3个样本,使用荧光显微镜下测量30个肾小球血管襻面积,用成像系统拍照,将拍好的照片导入计算机中,用NIS-Elements图像处理软件(Nikon Corporation,Tokyo,Japan)进行图片统计分析。
1.8 免疫组化检测肾组织galectin-3及p-ERK1/2表达
(1)石蜡切片进行脱蜡;(2)抗原用柠檬酸缓冲液修复;(3)3%双氧水(H2O2)灭活内源性过氧化物酶;(4)galectin-3(1∶100),p-ERK1/2(1∶200)4 ℃孵育过夜;(5)37 ℃复温,PBS 洗涤,二抗(1∶1 000)37 ℃孵育 30 min;(6)PBS 洗涤,DAB显色;(7)苏木素复染,中性树胶封片。
1.9 Western blot检测肾组织galectin-3,p-ERK1/2蛋白的表达
(1)取冷冻保存的小鼠肾皮质组织,称重,加入适量蛋白裂解液,冰上匀浆,在4 ℃下12 000 r/min条件下离心10 min后取上清液提取总蛋白,以BCA方法对上清进行蛋白定量;(2)制备分离胶和浓缩胶,蛋白上样,SDS-PAGE凝胶电泳至溴酚蓝跑出分离胶后,将蛋白转移至PVDF膜上;(3)TBS 洗膜,5%脱脂奶粉室温下封闭1 h;(4)根据目的蛋白分子量裁剪条带,分别加入稀释后的一抗,4 ℃孵育过夜;(5)次日用TBS液洗涤条带4次,每次10 min,加入二抗室温下孵育1 h;(6)TBS液洗4次,每次10 min,之后在Bio-Rad全能成像仪上观察、分析条带;(7)β-actin作为内参,以目的蛋白灰度值/内参灰度值反映蛋白的相对表达水平。
1.10 统计学方法
应用SPSS 17.0软件分析系统进行统计学处理。计量资料用均数±标准差(±s)表示,当数据符合正态和方差齐时,各组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 AS-Ⅳ对STZ诱导的1型糖尿病小鼠24 h尿白蛋白的影响
与Control组比较,STZ组小鼠24 h尿白蛋白明显升高(P<0.001);与STZ组比较,STZ+AS-Ⅳ组小鼠24 h尿白蛋白明显下降(P<0.05)。见图1。

图1 各组小鼠24 h尿白蛋白比较
2.2 AS-Ⅳ对STZ诱导的1型糖尿病小鼠血肌酐、血尿素氮及血糖的影响
与Control组比较,STZ组小鼠血肌酐升高,但差异无统计学意义;与STZ组比较,STZ+AS-Ⅳ组小鼠血肌酐明显下降,差异有统计学意义(P<0.05)。与Control组比较,STZ组小鼠血尿素氮明显升高(P<0.01);与STZ组比较,STZ+AS-Ⅳ组小鼠血尿素氮未见明显下降。与Control组比较,STZ组小鼠血糖明显升高(P<0.001);与STZ组比较,STZ+AS-Ⅳ组小鼠血糖无明显差异。见表1。
表1 各组小鼠血肌酐、血尿素氮及血糖比较(±s,n=6)
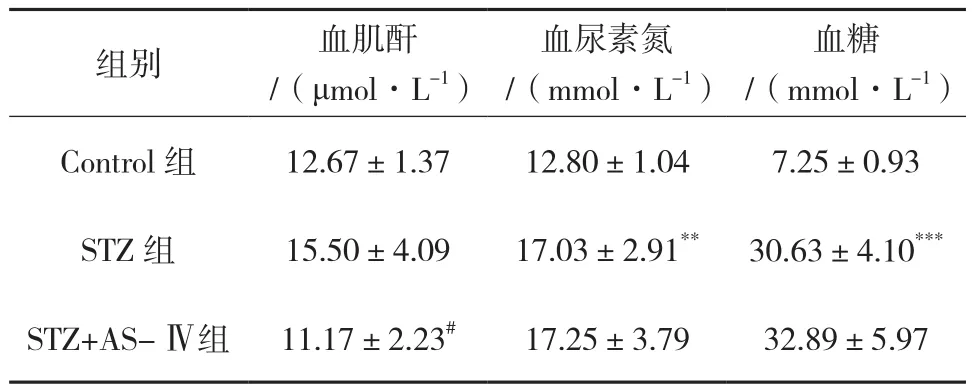
表1 各组小鼠血肌酐、血尿素氮及血糖比较(±s,n=6)
注:与Control组比较,**P<0.01,***P<0.001;与STZ组比较,#P<0.05。
组别 血肌酐/(μmol·L-1)血尿素氮/(mmol·L-1)血糖/(mmol·L-1)Control组 12.67±1.37 12.80±1.04 7.25±0.93 STZ 组 15.50±4.09 17.03±2.91** 30.63±4.10***STZ+AS- Ⅳ组 11.17±2.23# 17.25±3.79 32.89±5.97
2.3 AS-Ⅳ对STZ诱导的1型糖尿病小鼠肾组织galectin-3/ERK1/2信号通路相关蛋白表达的影响
Western blot结果所示,与Control组比较,STZ组肾皮质组织中galectin-3蛋白表达明显增加(P<0.001);与STZ组比较,STZ+AS-Ⅳ组肾皮质组织中galectin-3蛋白表达被抑制(P<0.001)。与Control组比较,STZ组肾皮质组织中p-ERK1/2蛋白表达明显增加(P<0.01);与STZ组比较,STZ+AS-Ⅳ组肾皮质组织中p-ERK1/2蛋白表达被抑制(P<0.001)。见图2。免疫组化染色结果显示galectin-3主要表达于肾小球中,肾小管中未见表达。见图3。p-ERK1/2主要表达在肾小球中,肾小管亦有少量表达。见图4。
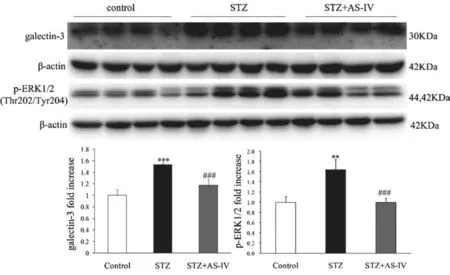
图2 各组小鼠肾皮质中galectin-3与p-ERK1/2蛋白Western blot结果

图3 各组小鼠肾皮质galectin-3免疫组化染色结果
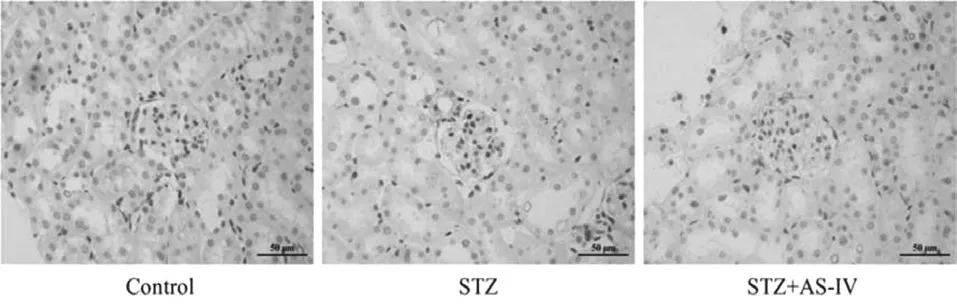
图4 各组小鼠肾皮质p-ERK1/2免疫组化染色结果
2.4 AS-Ⅳ对STZ诱导的1型糖尿病小鼠肾组织病理学形态的影响
对肾脏组织切片分别进行PAS染色可见Control组肾内结构清晰完整,形状规则,肾小球系膜基质未见增生;STZ组中可见系膜基质增多,系膜扩张,与正常组比较,差异有统计学意义(P<0.05);与STZ组比较,STZ+AS-Ⅳ组系膜基质沉积程度明显减轻,差异有统计学意义(P<0.05)。见图5-6。

图5 各组小鼠肾组织切片PAS染色
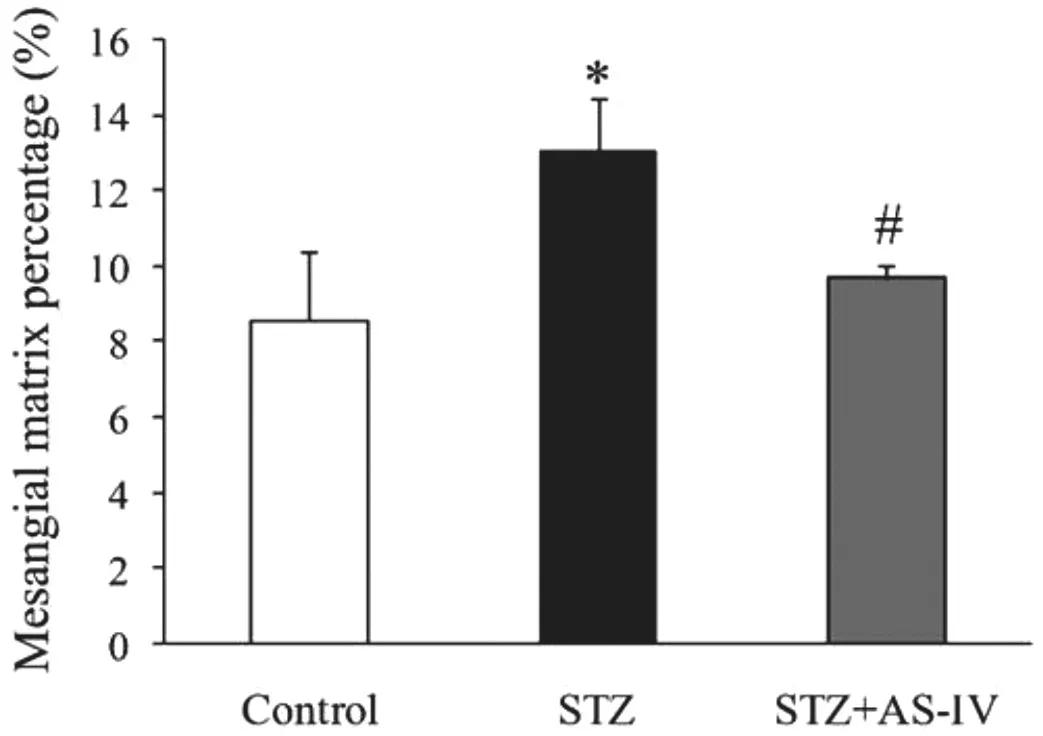
图6 各组小鼠肾小球系膜基质面积比较
3 讨论
肾小球肥大是DKD早期的形态学特征表现,是引起肾脏结构不可逆改变的始动因素,是最终引起终末期肾病的初始病理表现。在这一变化中,肾小球系膜细胞增殖及细胞外基质(extracellularmatrix,ECM)聚集起了重要的作用。作为AGEs的受体之一,galectin-3与糖尿病及其并发症关系密切,galectin-3通过其介导的免疫炎症反应及AGEs受体作用等多种生物学效应参与了DKD的发生、发展,可能成为该病治疗的潜在新靶点。研究表明,galectin-3在2型DKD中的表达较正常人明显增多,且与蛋白尿呈正相关,与肾功能呈负相关,galectin-3与2型DKD的进展呈独立相关性[3]。与其他肾脏疾病比较,DKD患者肾组织内galectin-3的表达明显升高[6]。Galectin-3在 DKD高糖培养的肾小球系膜细胞中表达显著上调,高表达的galectin-3可促进系膜细胞的增殖[7]。与既往研究一致,本研究显示1型糖尿病小鼠肾小球存在系膜细胞增殖及系膜基质增生,肾皮质组织中galectin-3蛋白含量显著增加,这提示糖尿病系膜基质增生可能与galectin-3的高表达有关。
ERK1/2信号通路在DKD的发生、发展过程中发挥重要作用。ERK1/2信号通路的活化可导致DKD早期ECM增生[8]。高糖刺激下肾小球系膜细胞ERK1/2信号通路被激活,可促进ECM的合成并抑制其降解[9]。高糖环境下多种细胞因子均可激活ERK1/2信号通路,galectin-3可能是激活ERK1/2信号通路的重要细胞因子之一。既往研究表明: galectin-3的下调导致MEK/ERK信号通路活性降低,并抑制肝癌细胞的增殖、迁移和侵袭[10]。Galectin-3可通过激活MEK/ERK信号通路促进体外高糖培养的系膜细胞的增殖,沉默galectin-3后,MEK/ERK信号通路受到抑制[11]。本研究结果显示1型糖尿病小鼠肾组织中ERK1/2信号通路存在显著活化,galectin-3可能通过提高ERK1/2磷酸化水平,激活ERK1/2,从而调控DKD肾小球系膜细胞的增殖和细胞外基质的增生,进而影响DKD的发生、发展。
AS-IV是黄芪的主要活性成分之一,具有抗炎、免疫调节、抗氧化、清除氧自由基、降血糖及抗衰老等多种药理作用[12]。越来越多的研究表明,AS-IV对DKD肾脏具有保护作用,其保护作用与抑制MEK1/2-ERK1/2-RSK2信号通路[13]、减轻炎症反应[5]、抑制足细胞凋亡[14]、调节线粒体质量调控[15]等多种机制有关。在本研究中首次发现AS-Ⅳ对galectin-3、ERK1/2均有显著抑制作用,这提示AS-Ⅳ对DKD肾脏的保护机制可能与抑制galectin-3/ ERK1/2信号通路有关。
综上所述,AS-Ⅳ对STZ诱导的1型糖尿病小鼠肾脏有明显的保护作用,可减少蛋白尿,减轻肾组织损伤,其作用机制可能与抑制galectin-3/ERK1/2信号通路,进而抑制肾小球系膜细胞的增殖和细胞外基质的增生有关。该研究为AS-IV防治DKD提供了新的证据及可能靶点。

