1 株淡水微藻的分离鉴定及其耐强碱、耐低温突变株的诱变筛选
徐靖昂,王雪儿,祝倩倩,范美华,严小军,张晓林
(1.浙江海洋大学水产学院,浙江舟山 316022;2.浙江海洋大学国家海洋设施养殖工程技术研究中心,浙江舟山 316022)
水产养殖业是我国重要的经济发展产业之一,是中国经济可持续提高的主要增长点。近年来,我国淡水池塘集约化、规模化养殖业迅猛发展,养殖技术与水平提高,各种新型高产效的养殖模式兴起[1]。池塘养殖的水体既是养殖对象的生存场所,又是残饵和养殖对象粪便的分解场所[2]。在高密度水产养殖模式下,养殖对象产生的代谢物不能被及时降解,导致水体中氨氮和亚硝氮等有害物质逐渐增多,水体pH 偏高,进而出现水体富营养化现象,对水产养殖的经济效益和人类健康发展造成严重危害[3]。有研究认为绿藻类和硅藻类具有吸收有害物质、保持水质“活、爽”的功能,是可用来构建优良藻相的备选种类[4]。此外,在水产养殖过程中,温度也是一项很重要的环境因素,它影响着养殖水体中浮游微藻的分布。对于大多数微藻来说,最适温度在18~25 ℃[5],但冬季水体温度较低,对浮游微藻的分布生长有一定影响。目前,水产养殖业中应对水质恶化等生态问题,物化处理法存在投入成本高、实践操作复杂、易产生二次污染等问题,实际应用范围局限;而生物法具有运行成本较低,使用安全,无化学试剂添加,二次污染可能性低,能获得安全、高品质的产品等优点而被广泛应用[6]。现有的试验结果表明微藻有调节水体中的氮磷元素含量[7],抑菌[8],改善养殖水环境等方面的功能。
栅藻Scenedesmus sp.作为一种耐受性强,去除水体污染物效果好的绿藻[9],常被用于水体净化。程海翔[10]使用栅藻去除适当灭菌后的养猪场沼液中的氮磷,去除率分别可达到98.2%、80.4%。刘林林等[11]比较了15种微藻对养猪废水中总氮、总磷的去除能力,发现多棘栅藻Scenedesmus spinosus 的总氮去除率最高(93.25%),多棘栅藻和四尾栅藻S.quadricauda 的总磷去除率可达到97%以上。栅藻在适合的条件下,也可以产生油脂和蛋白质等附加产物[12-13]。
本文主要针对1 株分离自淡水养殖池塘的微藻,首先对其进行形态学和分子生物学鉴定,然后探究其细胞形态特征和不同条件下的生长规律,最后采用紫外(UV)诱变和化学(EMS)诱变技术,对该藻株进行随机诱变,获得大量突变株,通过强碱、低温等极端条件培养对突变株进行筛选,获得能够耐受强碱和低温的优良藻株。以期为该栅藻在水产养殖水质调控中的广泛适用性提供参考。
1 材料与方法
1.1 藻株分离及纯化
实验藻株由武汉中易天地物联科技有限公司提供。藻种接种于15 mL BG11 液体培养基,4 000 lx 光强的光照培养箱(ZRG-250B-L3)中复苏培养,光暗周期为12 h(L/D:12/12 h),25±1 ℃。将活化后的藻株转接至250 mL BG11 培养基培养,培养7 d,梯度稀释后涂布,选择长势优良的单藻落连续划线分离,将单克隆藻株进行扩大培养。为确保藻株的纯度,利用96 孔板梯度稀释分离法对该藻株再次分离纯化,取100 μL藻液于96 孔板中,加入100 μL 无菌BG11 培养液混匀,取100 μL 已稀释藻液连续梯度稀释,直到最后1个稀释梯度长出的为单个藻细胞为止。吸取该孔内的藻液进行扩大培养并在固定平板上保存藻种。
1.2 形态学和分子生物学鉴定
收集一定数量的藻液,离心弃上清,采用光学显微镜与电子显微镜相结合的方法,观察微藻形态结构与周期性形态变化。微藻形态学鉴定后,对其进行分子生物学鉴定。收集藻液50 mL,4 000 r·min-1离心5 min,弃上清,液氮速冻后研磨成粉。将TaKaRaMiniBEST Plant Genomic DNA Extraction Kit 提取的DNA 作为模板,使用18S rRNA(F:CGGGATCCGTAGTCATATGCTTGTCTC;R:CGGAATTCCTTCTGCAGGTTCACC)和SSU rRNA(F:GTAGTCATATGCTTGTCTC;R:TCACCAGCACACCCAAT)特异性引物对微藻的18S rRNA 和SSU rRNA 基因序列进行扩增。PCR 扩增体系为50 μL,其中双蒸无菌水34.75 μL,dNTP 4 μL,10×Ex taq buffer 2 μL,DNA 模板2 μL,Ex taq 酶0.25 μL,正反引物各2 μL。18S rRNA 扩增程序:95 ℃预变性5 min,94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸2 min,72 ℃再延伸10 min,30 个循环。SSU rRNA 扩增程序:95 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸100 s,72 ℃再延伸10 min,30 个循环。扩增后的PCR 经1.3%的琼脂糖凝胶电泳验证后,送至上海生工生物工程公司测序。将微藻的18S rRNA 和SSU rRNA 序列与GenBank中的一些近缘藻序列用MEGA7.0 进行多序列比对分析,并采用邻接法(neighbor-joining method)构建进化树。
1.3 生长曲线测定及强碱、低温下的生长情况
将栅藻接种到BG11 液体培养基中培养39 d。每天重复取样品3 次,以空白BG11 液体培养基作为对照,采用紫外分光光度计测定样品在波长为680 nm[14]处的OD 值,OD 值取平均值。同时采用LUNA 自动细胞计数仪对3 个重复样品进行细胞计数,记录测得的藻细胞密度并取平均值。设置强碱(pH 10,25 ℃)、低温(pH 7,10 ℃)、强碱与低温协同(pH 10,10 ℃)3 组实验,定时测定藻液的OD680,平行3 组,方法同生长曲线测定。
1.4 紫外(UV)诱变及甲基磺酸乙酯(EMS)诱变
各取3 mL 对数生长期的藻液均匀平铺于六孔板,19 W 紫外光强垂直于六孔板上方30 cm 进行0、5、10、15、20、25 min 梯度照射,平行3 组。暗处理12 h 后按原条件培养。
各取6 组50 mL 处于对数生长期的藻液于50 mL 离心管,4 000 r·min-1离心5 min,弃上清,PBS 缓冲液(pH 7)重悬,设置诱变剂EMS 浓度梯度:0%、0.2%、0.4%、0.6%、0.8%、1.0%,紧盖,暗环境摇床摇晃诱变60 min。各管加入3 mL 5%硫代硫酸钠溶液终止反应。原速离心5 min 去除诱变液,各管以50 mL PBS 缓冲液冲洗藻细胞,4 000 r·min-1离心5 min,弃上清,即为第1 次洗涤。各管内加入50 mL BG11 液体培养基,以上述离心条件进行第2 次洗涤。用培养基洗涤2 次后将所得藻细胞加培养基悬浮至50 mL,依次加入六孔板中,每孔5 mL,平行3 组,封口膜封边后按原条件培养。
1.5 耐强碱、低温突变株的筛选
将六孔板分别转至10 ℃、pH 10 环境培养,其他条件不变。与未经诱变处理的藻液对比,长势较好的藻为突变株。吸取六孔板中的突变藻株进行扩大培养,并做好相关保种工作,备用。
分别设置强碱(pH 10,25 ℃)、低温(pH 7,10 ℃)、强碱与低温协同(pH 10,10 ℃),其他同原培养条件。各取3 mL 相同浓度对数生长期的野生型藻株与突变型藻株藻液至250 mL 培养液中,每天或隔天定时测定藻液的OD680,平行3 组,方法同生长曲线测定。
2 结果
2.1 微藻形态结构及其周期性变化
栅藻在光学显微镜下呈绿色,细胞形状呈卵形,常聚集成群,个别细胞单生。电子显微镜下观察,单个细胞呈椭圆形,细胞表面平滑,细胞表面含有多个周生。光镜(图1)与电镜(图2)相结合观察发现:藻细胞壁不同程度胶化。两端具短锥状增厚,分裂过程中(图1)母细胞壁作为子细胞的似亲孢子囊。光镜观察藻细胞形态发现:大量藻细胞聚集,细胞中央近圆且饱满,处快速分裂时期,囊中含有2-4-8 个似亲孢子,贴合紧密但互不相连(图1D);边缘细胞形态不规则,细胞衰老,具大量细胞破裂后释放的内含物质(图1 E、F)。细胞成熟后具蛋白核、淀粉鞘、淀粉粒等组成,其中淀粉鞘与淀粉粒具有较强的折光性。栅藻是淡水水体中常见的微藻,常常以聚集的方式存在。但是在实验室条件下培养,出现了单生藻细胞,有研究表明,栅藻在室内培养,可以形成单生细胞,不聚集生长[15]。
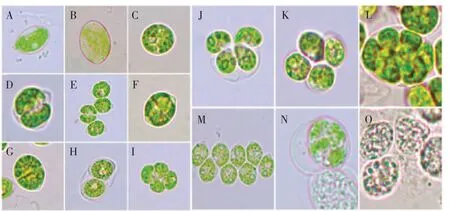
图1 栅藻光学显微镜下的形态Fig.1 OM graphed of Scenedesmus sp.
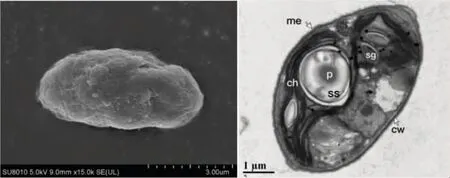
图2 栅藻扫描电镜(左)及透射电镜(右)Fig.2 Scenedesmus sp.scanning electron microscope(left)and transmission electron microscope(right)
2.2 18S rRNA 和SSU rRNA 基因扩增及系统发育进化树
对微藻的18S rRNA 和SSU rRNA 序列扩增,得到的序列用BLAST 进行分析,选取GenBank 中已有的近缘藻株序列,用邻接法构建18S rRNA 和SSU rRNA 系统发育树。分离纯化所得微藻与已知藻株Scenedesmus raciborskii(登录号:AB037094.1)位于系统发育树的同一个分支上,具有较近的亲缘关系(图3)。因此,基于18S rRNA 和SSU rRNA 的序列相似性和其他相似序列多序列比对的系统发育分析表明本研究中分离到的藻株属于栅藻。将该栅藻正式命名为Scenedesmus sp.ZJZY091,18S rRNA 和SSU rRNA测序结果已提交至GenBank(18S rRNA 登录号:OK 644024;SSU rRNA 登录号:OL813869)。
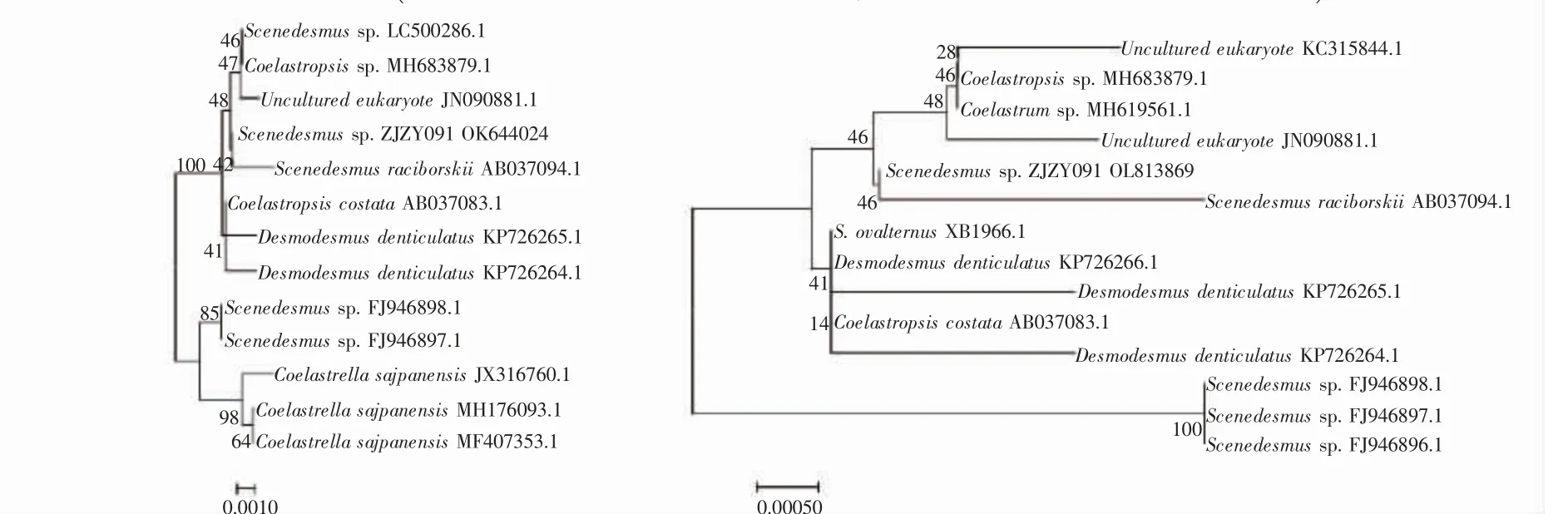
图3 基于18S rRNA 部分序列(左)及SSU rRNA 部分序列(右)构建的系统发育树Fig.3 Phylogenetic tree constructed based on the partial sequence of 18S rRNA(left)and the partial sequence of SSU rRNA(right)
2.3 栅藻生长曲线的测定
测定了该栅藻的生长曲线,发现栅藻的生长周期较长,以测定数据下降为数据测定终点,该培养条件下栅藻的生长周期达39 d。从图4 可以看出,栅藻在接种后6~7 d 时进入缓慢生长期,自第14 天开始,藻细胞开始快速扩增,进入对数生长期,在第30 天,藻细胞增殖的速度减慢,进入平台期,在接种后第39 天进入衰退期。在实验室培养条件下,该栅藻的最大OD 值可达到1.2 左右。
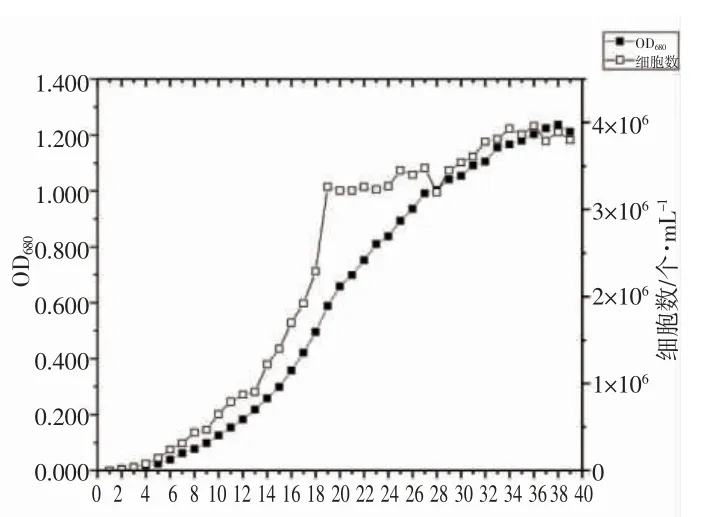
图4 栅藻的生长曲线Fig.4 The growth curve of Scenedesmus sp.
2.4 不同培养条件对栅藻生长的影响
测定了该栅藻在高pH、低温以及2 个条件共同作用下的生长情况。结果显示栅藻细胞在pH 10 的条件下生长受到抑制,且藻细胞发生聚团现象,培养基底与表面贴壁部位均有分布,摇晃后藻团不分散(图5A)。进入衰老期后,藻液转为黄绿色,经摇晃后,藻聚团沉底(图5B,C),藻细胞破碎后会释放内含物质(图5E,F)。有研究表明,pH 一般通过影响细胞内代谢酶的活性和藻细胞对离子的吸收利用,从而影响微藻的生理代谢[16]。不同的藻类生长的最佳pH 不同,偏离最佳pH,微藻生长和体内有关代谢活动会受到抑制[17]。例如,钝顶螺旋藻Spirulina platensis最适生长的pH 为9.0~9.6,高pH 会影响细胞的形态[18],这与本研究的结果一致。
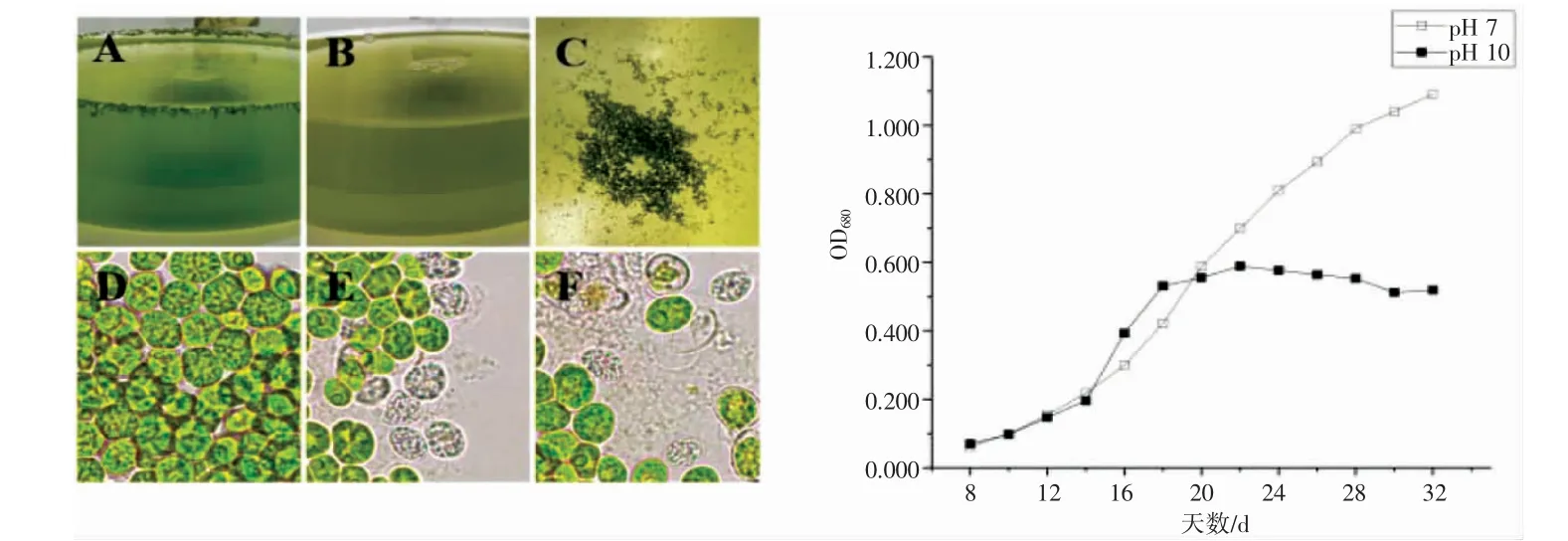
图5 强碱对栅藻形态及生长的影响Fig.5 The effect of strong alkali on the morphology and growth of Scenedesmus sp.
在10 ℃条件下培养的栅藻与对照组(25 ℃)相比,生长也被明显抑制(图6)。有研究表明温度是影响微藻生长和代谢的重要环境因子之一[19]。各类藻对温度的适应范围不同,如小新月菱形藻Nitzschia closterium f.minutissima 适应温度范围为10~25 ℃[20],小球藻Chlorella sp.温度范围为20~35 ℃[21]。如果温度超过微藻的最适范围,微藻的生长将受到不同程度的影响[22]。高温和低温对微藻的危害不相同,高温对微藻是化学性破坏,而低温对微藻是机械性破坏,微藻一般对低温的忍耐性较强[23]。本研究中,在低温条件下,栅藻的生长受到抑制,这一结果与叶丽等[24]的研究结果一致。

图6 低温对栅藻生长的影响Fig.6 The effect of low temperature on growth of Scenedesmus sp.
栅藻在pH 10,10 ℃条件下生长受到明显抑制,藻细胞出现聚团现象,藻团沉底(图7C),摇晃后能较均匀分布于培养基中。结果显示,强碱、低温共同作用与原培养相比,二因素协同影响下的藻生长更迟缓。
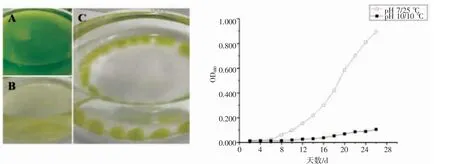
图7 强碱、低温对栅藻生长的影响Fig.7 The effect of strong alkali and low temperature on the growth of Scenedesmus sp.
2.5 栅藻的诱变及耐强碱、低温突变株的筛选
通过紫外和EMS 诱变后的突变株经pH 10 以及10 ℃培养条件下的筛选,结果如图8 所示,在强碱条件下,迟缓期与对数生长期间,野生株生长略优于突变株,二者无明显差异;平台期突变株生长优于野生株,突变株具有较好的强碱耐受性。如图15 所示,自第18 天,突变株仍较野生株具有一定耐低温的特性。与单一胁迫因素作用相比,强碱和低温的协同作用使得2 种类型的栅藻比较明显的某个时期更具生长优势,突变株栅藻生长出现波动,具有不稳定性。紫外线辐照是目前使用最久且成本低廉的一种物理诱变方法[25-26]。甲基磺酸乙酯(EMS)是一种常用的化学诱变剂,主要原理是在DNA 复制的过程中,通过改变碱基的结构而达到诱变的目的[5]。有研究表明,紫外线辐照对不同微藻的生长速率、色素及代谢产物会产生不同程度的促进作用和危害作用。在钝顶螺旋藻的研究中[27],紫外线辐照的突变株与野生株比较,藻丝长度增长,叶绿素含量、生长速率及光合速率均显著提高。与单一诱变相比,复合诱变可以增加基因突变类型。经过紫外诱变和EMS 诱变处理的水云属褐藻Ectocarpus confervoides,发现紫外诱变比EMS 诱变产生更多的基因突变[28]。复合诱变更有利于筛选获得性状优良的突变藻株[29-30]。本研究中,使用紫外和EMS 复合诱变筛选出了分别对强碱和低温有抗逆性的藻株。
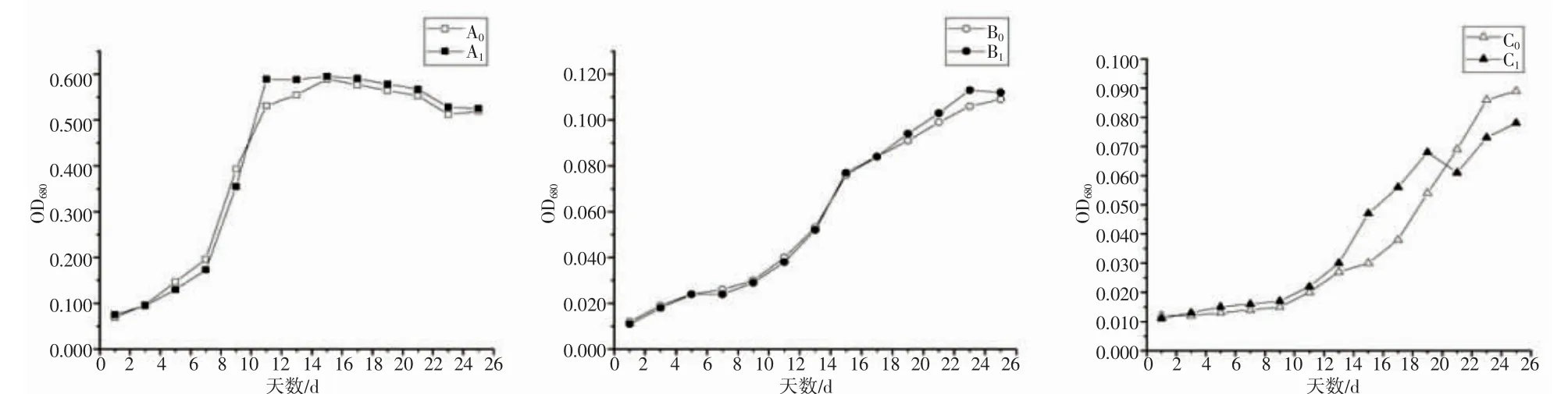
图8 不同条件下野生株与突变株的生长情况Fig.8 Growth of wild type and mutant type under different environmental conditions
3 结论
本文从克氏原螯虾养殖水体中分离到1 株微藻株,通过分离纯化和鉴定,确定该藻隶属于栅藻属,该栅藻细胞含色素体、蛋白核、淀粉粒等微观结构,细胞形态具周期性变化;且生长周期长,有明显的迟缓期、对数期,稳定期;强碱与低温对栅藻的生长具有明显的抑制作用,且强碱导致藻细胞聚团;通过紫外和化学诱变处理藻株,并通过高pH 和低温条件的筛选获得耐强碱、耐低温等具有适应极端条件的突变株。本文的研究结果对于该栅藻在水产养殖极端条件下的应用提供可能。

