基于提高乙醇产率的常压室温等离子体微藻诱变育种
孙 哲,孙 昕,李鹏飞,刘明文,李 盟,张清宇 (西安建筑科技大学环境与市政工程学院,陕西 西安 710055)
传统化石能源的持续消耗引发了能源危机,带来了温室效应、雾霾等问题,开发可再生的替代能源迫在眉睫[1].乙醇作为一种辛烷值高达115且可再生的绿色清洁燃料受到广泛关注[2].微藻作为第三代生物质能源,分布广泛、生长速度快、不占用耕地,细胞中含有较多的可溶性多糖,藻类所含的纤维素相对陆生植物而言氢键更弱,更易于预处理,是制备生物乙醇的良好原料[3].
利用微藻制备乙醇主要依靠藻细胞内碳水化合物,获取高含碳水化合物的藻株对制备生物乙醇具有重要意义.由于藻细胞内碳水化合物是最直接的供能物质,而碳水化合物的积累通常发生在对细胞生长不利的环境下,这一定程度上限制了微藻生物量的积累,对选育优势藻株带来了阻碍[4].目前常用的是对藻类进行氮、磷胁迫使藻细胞内淀粉含量增加[5],但会以减少生物量作为代价[6].
常压室温等离子体(ARTP)是一种安全高效的新型诱变装置,通过改变细胞理化特性引起组织损伤,迫使细胞启动SOS修复机制,进而改变生物细胞内遗传物质[7-8].相比于紫外线、射线、激光等诱变方法,ARTP辐射均匀,突变率高并具有多样性[9],同时该方法操作简单,工作温度低(<40℃),安全系数高,不涉及有毒有害物质,比化学诱变更加环保[10].
诱变育种目前在微藻领域已经得到广泛应用,包括提高藻细胞生长速率[11]、油脂含量[12-13]、光和活性[14]以及氨基酸产量[15]等,特别是在提高细胞油脂含量方面的应用较多,然而有关利用诱变提高藻细胞碳水化合物的报道较少[16].相关研究已经证实ARTP在提高藻细胞多糖以及胞外聚合物(EPS)方面取得了一定的效果.Liu等[17]利用 ARTP诱变寇氏隐甲藻葡萄糖含量提高了 57.17%,但最终含量仅达到9.4%.Fang等[18]最先利用ARTP诱变钝顶螺旋藻,获得碳水化合物占比 33.1%的藻株,但未验证藻株实际发酵性能,并且发现 ARTP更适用于单细胞微生物,然而钝顶螺旋藻是一种多细胞微生物,且难以实现单细胞的分离.
小球藻属于绿藻,具有高质子效率,能够合成大量碳水化合物并将其转化为生物乙醇[19].本研究以普通小球藻为研究对象,在不同功率条件下利用ARTP对小球藻进行辐射,筛选出碳水化合物含量高、生长速率快的优势藻株,并进行生物乙醇制备实验,旨在为制备生物乙醇提供优势原材料.
1 材料与方法
1.1 实验材料
1.1.1 实验藻株 实验藻株为普通小球藻,购于中国科学院武汉水生生物研究所,编号为FACHB-25.
1.1.2 实验试剂 无水乙醇、甘油、三氯甲烷、浓硫酸、苯酚、甲醇、丙酮、BG11培养基配制试剂等,以上试剂均为分析纯.
1.2 实验方法
1.2.1 等离子体诱变 将小球藻培养至对数生长期备用.ARTP装置预热 30min,诱变平台距辐射口5mm,进气量为300L/h,电流为1.0A,时间为40s,功率依次为0,20,40,60,80,100,120,140,160W,其中0W为对照.
每次取 0.1mL藻液进行辐射处理,然后转移到10mL含有 5%甘油的培养基中避光放置数小时,以防止光修复[20-21].稀释100倍后取0.1mL置于琼脂固体培养基进行平板涂布.根据固体培养基上长出的藻落个数计算不同功率条件下的致死率[4].致死率计算公式如下:

式中:B为诱变后在固体培养基上长出的藻株数; C为对照组长出的藻株数.
1.2.2 诱变后小球藻的筛选 在固体培养基上进行初次筛选时,选取藻落大(生长快)、相对独立(纯度高)的藻株,用接种环取出后进行孔板扩培,同时以未处理的藻落作为对照.培养 2周左右,测定各藻株的OD680和多糖产量,选出生长速率或多糖产量高于原始藻株 20%以上的藻株,将筛选后的藻株多次传代培养,以保证藻株的遗传稳定性.
1.2.3 生长曲线与生物量测定 将各藻株在波长680nm处以相同吸光度接种于 250mL锥形瓶中扩培,每天在同一时刻测量各藻株的 OD 值,绘制生长曲线.生物量测定方法采用差重法[22],利用下式计算生物量.

式中:B为生物量,g/L;M1为滤膜烘干后质量,g;M2为藻液烘干后滤膜质量,g;V 为藻液体积,L.
1.2.4 藻细胞组分测定 总糖测量方法采用苯酚-硫酸法[23],在 490nm 吸光度下检测波长,带入葡萄糖标准曲线计算总糖产量以及产率(单位时间、单位体积的藻液中总糖增加的质量).淀粉含量的测定采用Solarbio淀粉含量检测试剂盒.脂肪含量采用氯仿-甲醇法测定[24].蛋白质含量采用Bradford法测定[25].
1.2.5 叶绿素荧光及叶绿素含量测定 利用调制叶绿素成像系统评价微藻光合性能.在藻细胞对数生长期设定相关参数,Meas.Light为3, Act.Light为4,Ext.Ligh为3,Sat.Pluse为5,Gain为1.叶绿素的提取采用 De Souza[4]的方法,在 653nm、666nm、750nm处测量上清液吸光度,带入下式计算叶绿素含量.
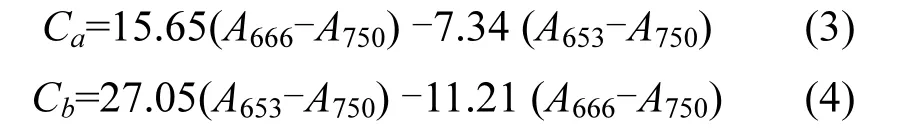
1.2.6 藻细胞干重中元素占比测定 利用稳定同位素比质谱仪测定不同藻株干重细胞中 C、N、P元素占细胞干重百分比[26].
1.2.7 微藻发酵方法 在培养末期,通过离心、冷冻干燥将藻液制成藻粉,分别取10g藻粉,根据Chai等[18]的方法,利用5%(V/V)硫酸进行预处理,利用α-淀粉酶和淀粉葡萄糖苷酶进行糖化.
采用同步糖化发酵(SSF)工艺,发酵参数参考Dahnum 等[27],料液比为 1:10,发酵过程在水浴锅中进行,恒温 30℃,持续 84h.发酵罐中按 1:20(g/mL)加入酵母细胞和酿酒酵母,同时添加酵母菌生存所需要的营养物质,包括酵母提取物、KH2PO4和NH4Cl等[19].
1.2.8 乙醇得率计算方法 乙醇浓度测定采用气相色谱法[19],乙醇得率和单位体积藻液可获得乙醇产量根据下式计算:

式中:Y为乙醇产量,g/10gDW;CEtOH为测得的乙醇浓度,×10-6;ρEtOH为乙醇密度,0.789g/cm3;V为发酵液体积,mL.

式中:YL为单位体积藻液可获得乙醇产量,g/L; Y为乙醇产量,g/10gDW;DW 为单位体积微藻生物量,mg/L.
2 结果与分析
2.1 诱变功率条件确定
根据1.2.1诱变方法,在不同功率下进行辐射并计算致死率.图1表明,致死率随功率的增加而提高,当功率升至 100,120,140,160W 时,致死率分别达到92.13%,96.52%,99.34%,100%.根据现代育种理论,致死率在 95%以上获得正向突变株(高产多糖藻株)几率最大[10],同时为了保证诱变藻株的生存能力,最终确定功率条件为100W和120W.

图1 不同功率下小球藻致死率对比Fig.1 Comparison of the lethality rate of Chlorella under different power
2.2 不同藻株生长曲线与多糖对比
不同藻株生长曲线对比如图 2所示.其中S120-9藻株在对数生长期内生长迅速,在 25d时生物量达到820mg/L,相对于原始藻株的700mg/L提高了17.14%;S100-7藻株前期OD值高于原始藻株,随后速率变缓,25d时OD值已经低于原始藻株,生物量仅有 600mg/L.而 S120-4藻细胞在增殖分裂方面受到了抑制,生长曲线增长缓慢,末期生物量仅500mg/L,这很可能是细胞以生物量为代价应对外界环境的一种保护机制,从而更好地抵抗逆境.

图2 不同藻株生长曲线对比Fig.2 Comparison of growth curves of different algae strains
图3为不同藻株多糖产量对比.前期各藻株多糖产量相近,一方面该阶段各藻株的生物量差异不明显,另一方面是进入对数生长期,细胞增殖分裂比较旺盛,消耗细胞内较多营养物质,多糖得不到有效积累.随着藻株不断生长,25d时,各藻株多糖产量达到峰值,其中S120-9藻株多糖产量达到237.98mg/L,是原始藻株多糖产量的1.34倍.

图3 不同藻株多糖产量对比Fig.3 Comparison of polysaccharide yield of different algae strains
不同藻株多糖含量及多糖产率对比如图 4所示.S100-7、S120-4藻株多糖含量分别达到34.64%、37.55%,相对于原始藻株分别提高了 32.37%、43.48%.S120-9藻株产率最高为10.09mg/(L·d),其次是 S100-7藻株的 9.18mg/(L·d),较原始藻株的 7.44 mg/(L·d)均有所提高.

图4 不同藻株多糖含量及产率对比Fig.4 Comparison of polysaccharide content and yield of different algae strains
2.3 不同藻株光合性能比较
叶绿素对于藻类的光合作用进程起到至关重要的作用[28],微藻吸收的光能除了光化学反应外,部分光能也会以荧光形式释放,利用叶绿素荧光衡量不同藻株对光能的吸收利用情况[29].
通过图5(a)可以发现S120-9藻株的Y(Ⅱ)值较高,开放的 PSⅡ反应中心捕获光能并用于光化学反应[20],较高的光合作用效率有助于藻细胞生长代谢,为生物量获取打下基础,同时也加快了碳水化合物的合成.而S120-4藻株实际光合作用效率较弱,这也使得该藻株生物量有所减少.
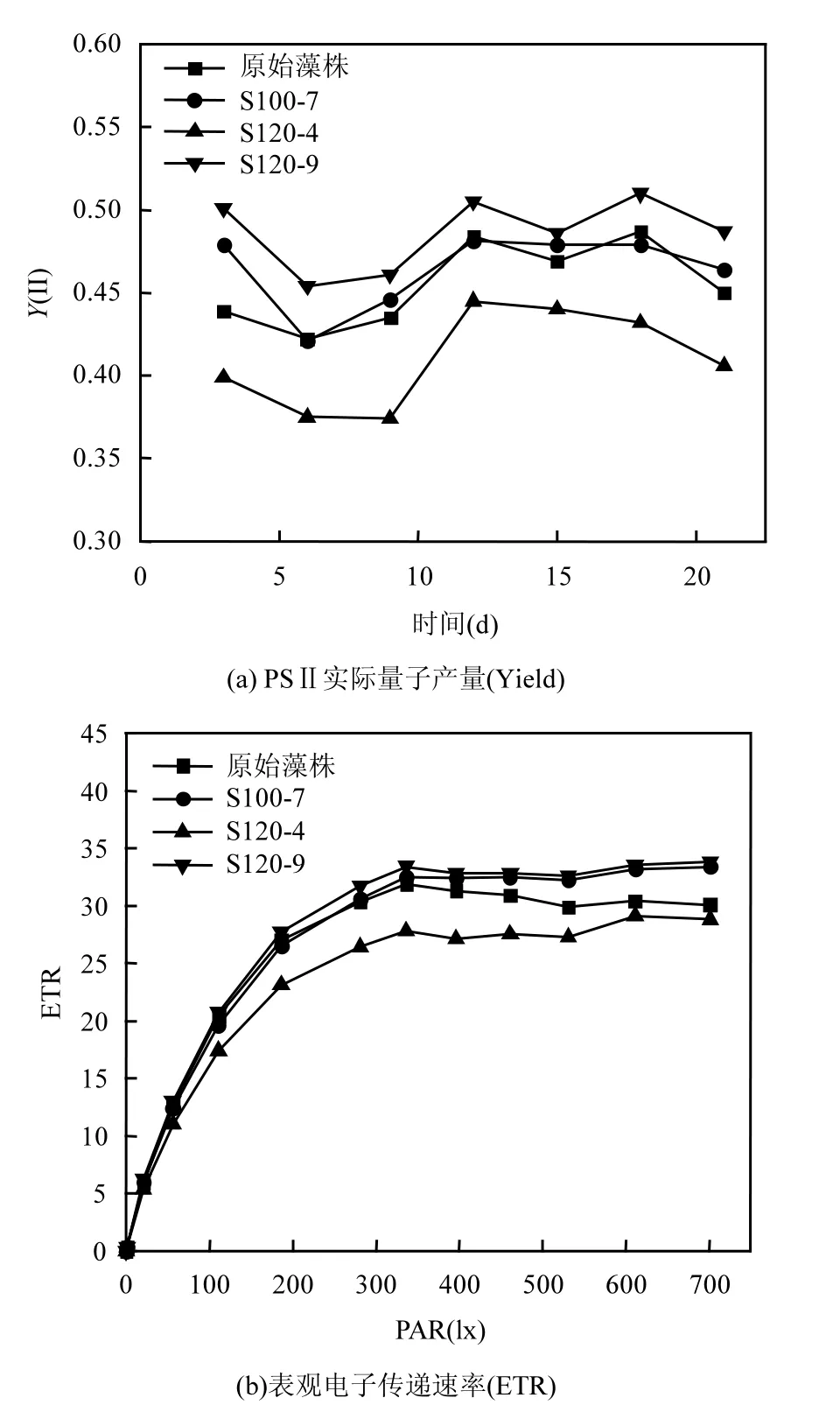

图5 不同藻株光合参数对比Fig.5 Comparison of photosynthetic parameters of different algae strains
图 5(b)中 S100-7、S120-9两株藻的表观电子传递速率(ETR)较原始藻株得到提高,由此经过光反应得到更多的 ATP和 NADPH,后者驱动 Calvin—Benson—basham 循环在暗相产生碳水化合物[30].Gupta等[31]发现微藻细胞通过氧化磷酸化进一步分解细胞内葡萄糖,生成ATP用于细胞分裂,这也解释了藻株进入对数生长期后多糖含量增加不明显但生物量快速增加的原因.图 5(c)为不同藻株的叶绿素含量对比,S100-7、S120-9藻株的叶绿素a、叶绿素 b含量较原始藻株有所提高,这有利于加强光能转化为化学能,从而加快葡萄糖、淀粉等碳水化合物合成.
2.4 不同藻株细胞组分含量分析
藻细胞代谢过程中,淀粉和脂类的合成过程中有相同的 C3前体[32],首先积累淀粉颗粒,然后积累含有三酰甘油酯的脂质体,其代谢过程高度相关[33].图 6为各藻株细胞组分含量对比情况,筛选藻株的淀粉含量均有所增加,特别是S120-4藻株淀粉含量达到24.04%,比原始藻株提高了41.66%.同时发现筛选藻株的油脂含量有所降低,这表明细胞在吸收利用的碳源更多的流向合成淀粉的方向.蛋白质的含量与细胞分裂有密切联系[34],各藻株的蛋白质含量差异不大,但S120-4藻株略有减少,这也一定程度上导致该藻株生物量较少.

图6 不同藻细胞组分含量对比Fig.6 Comparison of the content of different algae cell components
C的吸收利用与细胞内淀粉、油脂等储能物质的合成息息相关;N有助于微藻生物量生产和能量传输,是藻细胞中蛋白质、酶以及叶绿素在内重要元素[35];P参与ATP的合成,在藻细胞能量循环中充当重要角色[36].各藻细胞干重中元素占比情况如图 7所示.S120-4藻株中C增加最为明显,高达47.57%,这与其较高碳水化合物含量相一致.N含量对比中,S120-4藻株最少仅有 3.75%,因此该藻细胞内蛋白质以及叶绿素较少.S100-7、S120-9藻株P比例分别为 0.51%、0.56%,较原始藻株的 0.49%有所提高,这也解释了这两株藻对数期生长较快的原因.

图7 不同藻细胞干重中C、N、P元素占比Fig.7 The proportion of C, N, P in the dry weight of different algae cells
2.5 不同藻株形态差异对比
从表 1可以看出原始藻株 90%的细胞粒径在7nm 以下,3~11nm 范围内包含了 99.36%的藻细胞,普通小球藻细胞粒径一般在 3~8nm范围内.S100-7藻株粒径则整体偏大,7nm以下的在细胞仅占52.28%,11nm 以下的藻细胞也只占到 73.23%,这表明 ARTP诱变对细胞形态产生了较大影响,一方面可能是影响细胞的分裂增殖,改善了细胞增殖分裂能力,另一方面就是改变了单个细胞的形态大小.S120-4与 S120-9细胞粒径分布比例较为相近,7nm 以下比例分别为 55.65%和 65.37%,粒径在15nm以下的藻细胞分别占比为 94.75%和 96.34%,藻细胞粒径整体要大于原始藻株.通过图 8的电镜图片可以对比藻细胞形态变化,相比于原始藻株(a),S100-7(b)藻细胞更加饱满,S120-4(c)和 S120-9(d)表面则相对粗糙一些,这部分可能是藻细胞产生的胞外聚合物.

表1 不同藻株粒径分布Table 1 Particle size distribution of different algae strains

图8 扫描电镜下各藻株形态对比Fig.8 Morphological comparison of different algae under scanning electron microscope
2.6 不同藻株乙醇产量分析
图9为各藻株制备乙醇情况对比.经过84h的发酵过程,原始藻株、S100-7、S120-4、S120-9四株藻每10g藻粉得到生物乙醇产量分别为1.12、1.41、1.58、1.26g,多糖含量最高的S120-4藻株乙醇制备量最高,是原始藻株的1.41倍.
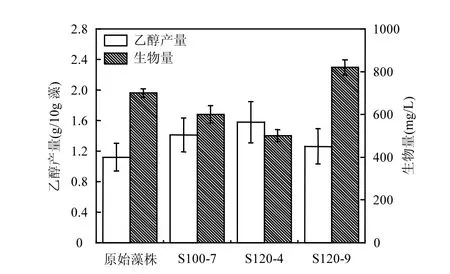
图9 不同藻株乙醇产量以及生物量对比Fig.9 Comparisons of ethanol production and biomass of different algae strains
由于 S120-4藻株在培养周期内生物量积累受限,因此结合各藻株培养阶段生物量积累情况,最终推算出原始藻株、S100-7、S120-4、S120-9单位体积藻液乙醇产量分别为 0.0784、0.0846、0.079、0.1033g/L.综合比较而言,S120-9藻株在制备乙醇方面具有显著的优势,是经过 ARTP诱变筛选后取得的优势藻株.
3 结论
3.1 利用ARTP在功率100W和120W条件下辐射小球藻 FACHB-25,筛选出了较为理想的诱变藻株,其中S120-4藻株碳水化合物含量达到37.55%,提高了 43.48%; S120-9藻株生物量达到 820mg/L,多糖产量是原始藻株 1.34倍.目前各藻株相关数据均在实验室内完成,需要后续在大规模微藻培养过程中得到各藻株性能的进一步验证.
3.2 藻株的筛选必须在生物量和碳水化合物含量之间做好权衡.S120-4藻株在相同干重下,乙醇产量是原始藻株的 1.41倍,就提高藻细胞碳水化合物含量而言,S120-4藻株是筛选出的优势藻株.但藻细胞内碳水化合物积累越多,生物量限制越明显.结合各藻株生物量,推算出理论上乙醇产量最多的是S120-9藻株,为0.1033g/L,具有较好的应用前景.

