核酸适配体比色传感器快速检测贝类中大田软海绵酸
王晓煜,劳敏军,胡慧利,周 勇,吴益春,邓尚贵,胡 艺,于 瑾
(1.浙江海洋大学食品与药学学院,浙江舟山 316022;2.浙江兴业集团有限公司,浙江舟山 316000;3.杭州市质量技术协会,浙江杭州 310019;4.舟山市食品药品检验检测研究院,浙江舟山 316000;5.浙江恒和食品有限公司,浙江舟山 316000;6.龙游县养殖业发展中心,浙江龙游 324000)
大田软海绵酸(okadaic acid,OA)是腹泻性贝毒(diarrhetic shellfish poisons,DSP)的1 种,是一种主要存在于藻类植物中的小分子腹泻性贝类毒素,主要是由利玛原甲藻Procentrum lima 产生[1],经贝类摄入后富集在消化腺内[2]。OA 是无色晶体,能溶于甲醇、乙醇和乙醚等有机溶剂,不溶于水,无色,无味,容易误食,导致食物中毒[3],引起腹泻、恶心、呕吐、腹痛等症状[4]。此外,OA 具有脂溶性和热稳定性,在加工过程中很难通过寻常的加工技术将其去除,甚至可能因贝类脱水及酯化态毒素向游离态的转化,从而导致毒素的毒性增强。
目前OA 常见的检测方法如小鼠生物测定法(MBA)[5]、酶联免疫吸附试验(ELISA)[6]、液相色谱-质谱(LC-MS)[7]、蛋白质磷酸酶抑制分析(PPIA)[8]、高效液相色谱(HPLC)[9]、电泳法[10]等。传统的OA 检测技术存在一定的局限性,通常需要昂贵的仪器,或者需要较长的检测时间,无法满足快速检测的要求。
生物传感器因其灵敏度高、快速便携等优势在检测领域得到广泛关注,核酸适配体也因其能与目标物如重金属离子、毒素、抗生素或病毒等高亲和力、高特异性结合的特点,得到广泛的应用[11]。本研究基于磁分离富集核酸适配体技术,构建了一种核酸适配体比色传感器,用于快速检测大田软海绵酸。
1 材料与方法
1.1 材料与试剂
大田软海绵酸(okadaic acid,OA,(8.4±0.4)μg·mL-1)、鳍藻毒素-1(dinophysistoxin1-b,DTX-1(10.4±0.8)μg·mL-1)和鳍藻毒素-2(dinophysistoxin2-b,DTX-2,(3.8±0.2)μg·mL-1)标准品购自加拿大国家海洋研究中心,大田软海绵酸适配体序列为5′-GGTCACCAACAACAGGGAGCGCTACGCGAAGGGTCAATGTGACGTCATGCGGATGTGTGG-3′,固定链序列为5′-GTAGCGCTCCCTGTTGTTGGTGACC-(CH)3-SH-3′,探针链序列为5′-SH-(CH)6-CCACACATCCGCATGACGTCACATTGAC-3′由上海生工生物工程股份有限公司合成,Tris-EDTA 缓冲液,四氧化三铁磁性纳米微球(-NH,5 mg·mL-1),6-巯基-1-己醇(MCH,98%),三(2-羧乙基)膦盐酸盐(TCEP,98%),均购自百塞生物,过氧化物酶购自阿拉丁,实验所需其他分析纯级化学品和试剂均购自国药集团化学试剂有限公司,样本来源于舟山市市场在售贝类。
1.2 仪器与设备
UV-2600 紫外可见光分光光度计(日本岛津企业管理有限公司);MS-3 涡旋振荡器(德国IKA 公司);UVR 超纯水机(法国Millipore 公司);电子天平(瑞士Mettler-Toledo 公司);KQ-600DV 型数控超声波清洗器(昆山市超声仪器有限公司);离心机Centrifuge 5920R 型(德国Eppendorf 公司);万用电热器(嘉兴市凤桥电热器厂)。
1.3 实验方法
1.3.1 标准溶液的制备
分别吸取一定体积的大田软海绵酸标准品溶于甲醇制备成1.0 μg·mL-1和100 ng·mL-1浓度的大田软海绵酸标准溶液,储存于4 ℃以下避光。
吸取一定体积的鳍藻毒素-1 标准品溶于甲醇制备成100 ng·mL-1浓度的鳍藻毒素-1 标准溶液,储存于4 ℃以下避光。
吸取一定体积的鳍藻毒素-2 标准品溶于甲醇制备成100 ng·mL-1浓度的鳍藻毒素-2 标准溶液,储存于4 ℃以下避光。
1.3.2 样品制备
该研究的社会经济数据来源为2005—2013年《山东省统计年鉴》。区域土地利用结构的变化由自然因素和社会经济因素共同决定,由于研究期内区域内自然因素条件的变化很小,所以该研究主要考察社会经济因素指标的影响,选择了11项社会经济发展指标[12-13]:总人口(X1)、人口密度(X2)、农村人口(X3)、地区总产值(X4)、粮食总产量(X5)、城镇居民人均可支配收入(X6)、第一产业总产值(X7)、第二产业总产值(X8)、第三产业总产值(X9)、人均GDP(X10)、固定资产总投资(X11)。
根据《GB 5009.212-2016 贝类中腹泻性贝类毒素的测定》对样品进行制备。用清水洗净贝类样品外表,切断闭壳肌,开壳,用清水淋洗内部去除泥沙及其他异物,取出贝肉。不要破坏闭壳肌以外的组织,尤其是中肠腺(组织呈暗绿色或褐绿色)。将去壳贝肉置于筛网上,沥水5 min,将贝肉剪碎。-20 ℃密封保存。
1.3.3 毒素提取
将处理后的试样解冻后均质,准确称取2 g(精确至0.1 g)于50 mL 带盖离心管中,加入9 mL 80%甲醇,涡旋混合1 min,超声提取10 min,8 000 r·min-1离心5 min,移出上清液于20 mL 刻度玻璃器皿中。残渣中加入9 mL 80%甲醇,重复提取1 次,合并提取液,用80%甲醇定容至20 mL。
1.3.4 纳米金制备
参考张万方等[12]的方法进行适当修改,具体如下:首先将需要使用的玻璃器皿在王水里面浸泡不少于12 h,用超纯水清洗,干燥备用。将1 g 氯金酸溶解在100 mL 超纯水中,配成1%(g/g)的氯金酸贮存液,储存于避光4 ℃以下。取4.12 mL 的氯金酸贮存液加入100 mL 超纯水溶液中搅拌加热至沸腾。然后快速加入10 mL 1%(g/g)的柠檬酸三钠溶液,发现溶液在5 min 内由无色变成黑色再变成酒红色。煮沸15 min 后,停止加热,冷却至室温,并在4 ℃避光保存。
1.3.5 纳米金标记活化巯基探针链
参考DITTMER W U[13]和关桦楠[14]方法进行适当结合修改,具体如下:取15 mL 的带具塞离心管加入1 mol·L-1氢氧化钠溶液里面浸泡1 h 后用纯水冲洗干净,干燥备用。将探针链1 000 r·min-1离心60 s 后,使用TE缓冲液配制成100 μmol·L-1的储备液。取9 μL 浓度为1 μmol·L-1的巯基化的探针链加入1.5 mL 的离心管中,然后再加入10 μL 500 mmol·L-1醋酸钠溶液(pH 5.2)和15 μL 10 mmol·L-1TCEP 溶液,室温下孵育活化1 h,孵育结束后,将上述反应液与5 mL 纳米金溶液(用K2CO3调节pH 为9.0)加入被氢氧化钠浸泡过的带具塞离心管中,盖上盖子后轻轻摇匀,再加入10 μL 0.5 mg·mL-1HRP 室温下避光孵育16 h。
1.3.6 制备纳米金磁珠(AuMNPs)
取1 mL 5 mg·mL-1四氧化三铁磁性纳米微球,磁分离后去除上清液,用纯水洗涤后加入3 mL 纳米金溶液,避光保存8 h。
1.3.7 AuMNPs-Apt 的合成
先将固定链1 000 r·min-1离心60 s 后,使用TE 缓冲液配制成100 μmol·L-1的储备液。再将100 μmol·L-1的储备液稀释成50 μmol·L-1。取9 μL 50 μmol·L-1固定链和10 μL 10 mmol·L-1TCEP,活化1 h。磁珠与纳米金混合液离心后用纯水重悬,加入活化后的固定链,4 ℃孵育过夜。加入500 μL 1 mmol·L-1MCH 30 min以封闭多余活性点位。用纯水冲洗2~3 次,加入10 μL 1 μmol·L-1OA 适配体链,孵育8 h。
1.3.8 制备检测OA 的比色适配体传感器
取过量的含活化探针链的纳米金溶液和200 μL AuMNPs 于1.5 mL 离心管孵育2 h。配制待测溶液,加入上述溶液混匀1 h。加入100 μL 显色液(15% H2O2,2 mmol·L-1TMB,pH 4.0)混匀。等待10~15 min,测定吸光度。
2 结果与分析
2.1 检测原理
DNA 适配体能识别和靶向特异性分子并形成特异性三级结构,DNA 适配体同时也能形成双链结构及其互补链,但适配体链与靶分子间的结合作用大于双链DNA,因此,由于它处于互补的双链核酸适配体中,并且处于靶分子环境中,它们更有可能特异性地与靶分子结合,形成适配体靶分子的三级结构。因此,利用这一特性,设计了一种夹心式DNA 适配体来检测溶液中OA 的浓度。首先,通过Au-S 键将补充OA适体5 端的巯基修饰的固定链自组装到磁珠上[15]。然后用MCH 阻断多余活性位点,与适体链进行杂交。与OA 适配体链杂交后,加入一定浓度的HRP-金纳米颗粒标记的探针链,与OA 适配体链的3 端结合,因此,形成了具有HRP 纳米金标记的适体传感器。探针链能够特异性识别OA 分子,适配体链与OA 结合并在磁性作用下分离。溶液中存在HRP 酶,HRP 对TMB-H2O2混合溶液发生氧化还原反应,产生颜色变化[16]。
2.2 实验条件优化
2.2.1 核酸适配体浓度的优化
适配体含量对检测结果有显著影响。当适体含量过低时,它不能与纳米金胶体溶液完全连接。因此,不管目标物是否存在,纳米金胶体溶液在盐溶液的作用下都会聚集变色,导致假阳性结果[17]。适体的含量太高时,溶液中的游离适体首先与靶目标完全结合,使得吸附在金纳米孔胶体溶液表面的适体不能完全解吸,导致纳米金胶体溶液的分离受到适体的保护,导致假阴性结果[18]。因此,需要优化适体的浓度。
分别取50 μL 不同浓度的核酸适配体溶液,浓度分别为0.1、1、10 和100 μmol·L-1。进行1.3.5~1.3.8 步骤实验进行,最后,分别扫描400~800 nm 波长范围内的吸收光谱,重复3 次,结果如图1。随着适体含量的增加,AuNPs 溶液在520 nm 波长处的吸光度值逐渐增大,而在650 nm 波长处吸光度值逐渐减小。结果表明,随着适体浓度的增加AuNPs 的聚集被逐渐抑制。因此,最佳的适体浓度为1.0 μmol·L-1AuNPs。

图1 核酸适配体溶液对吸光度的影响(n=3)Fig.1 Influence of aptamer solution on absorbance(n=3)
2.2.2 HRP 浓度的优化
HRP 对TMB-H2O2混合溶液会产生氧化还原反应变色,而HRP 的浓度会对变色反应产生影响[19]。保持其他条件不变,只改变HRP 浓度进行实验。如图2,可得HRP 的浓度对整体的显色反应影响不大,通过吸光度来看0.5 mg·mL-1的HRP 对显色效果较好。如图3,随着HRP 的浓度增大,反应时间缩短,但浓度过大会抑制反应速率,从而增加反应时间。因此,选择0.5 mg·mL-1为最佳的HRP 浓度。
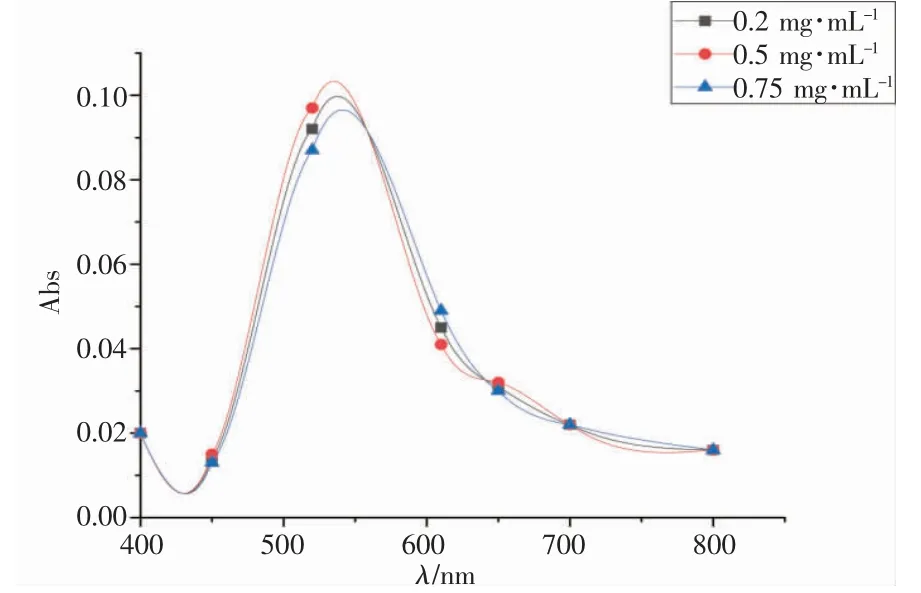
图2 HRP 的浓度对吸光度的影响Fig.2 Influence of HRP concentration on absorbance
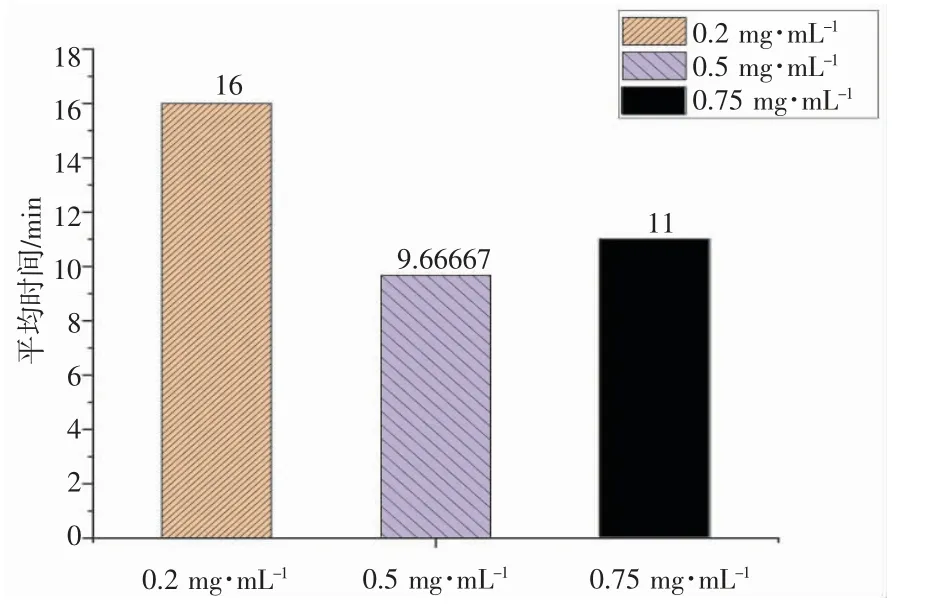
图3 HRP 的浓度对反应时间的影响(n=3)Fig.3 Influence of HRP concentration on reaction time(n=3)
2.3 标准溶剂曲线
在最佳条件下,采用610 nm 和520 nm 之间的吸收比(A610/A520)来确定OA 浓度。配置不同浓度的OA 溶液(0.2、0.5、1.0、2.0、5.0、10、20、50 和100 ng·mL-1),加入制备好的比色生物传感器,再加入显色液,进紫外分光光度计检测。见图4,5 显示了不同OA 浓度的生物传感器的吸附光谱和颜色变化,随着OA 浓度的增加,观察到传感器的明显分散现象,610 nm 处的吸光值(表示聚集的AuNP)和520 nm 处的吸光度增加(表示分散的AuNP)。图6 表示OA 浓度在0~10 ng·mL-1范围内吸光度比(A610/A520)可以看出0.2~2.0 ng·mL-1范围内具有线性关系,图7 表示在0.2~2.0 ng·mL-1范围内具有良好的线性关系R2=0.995 8。根据分光光度法检出限计算,算得检出限(LOD)为0.045 ng·mL-1。
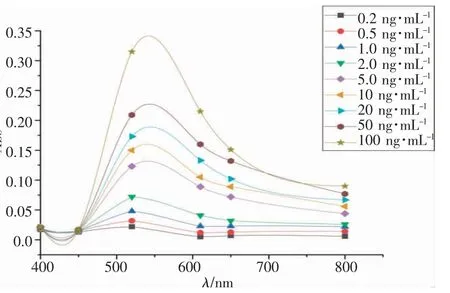
图4 不同浓度OA 溶液的吸收光谱图Fig.4 Absorption spectra of OA solutions with different concentrations

图5 不同浓度OA 溶液的颜色Fig.5 Colors of OA solutions with different concentrations

图6 OA 浓度在0 到10 ng·mL-1 范围内吸光度比(A610/A520)Fig.6 Absorbance ratio of OA concentration in the range of 0 to 10 ng·mL-1(A610/A520)
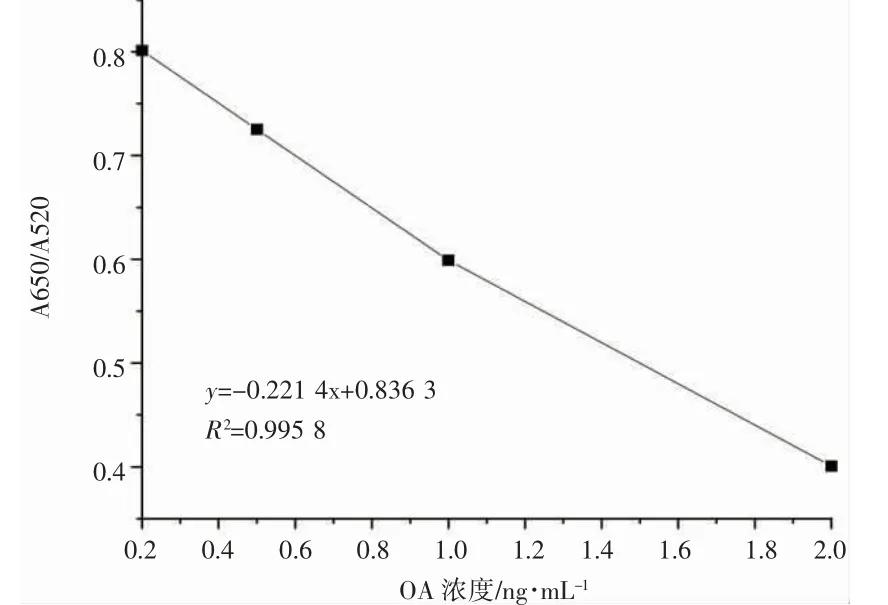
图7 OA 浓度在0.2 到2.0 ng·mL-1 范围内吸光度比(A610/A520)Fig.7 Absorbance ratio of OA concentration in the range of 0.2 to 2.0 ng·mL-1(A610/A520)
2.4 传感器分析性能
根据2.3 在最佳条件下,采用吸光度比值(A610/A520)来确定OA 浓度。用阴性的贻贝基质配置不同浓度的OA 溶液(0.2、0.5、1.0、2.0、5.0、10 和20 ng·mL-1),加入制备好的比色生物传感器,再加入显色液,进行紫外分光光度计检测。图8 表示在0.2~2.0 ng·mL-1范围内具有良好的线性关系R2=0.998 9。根据分光光度法进行检出限计算,算得检出限(LOD)为0.044 ng·mL-1。从图8 可以得出基质效应对本方法的OA 影响较小。
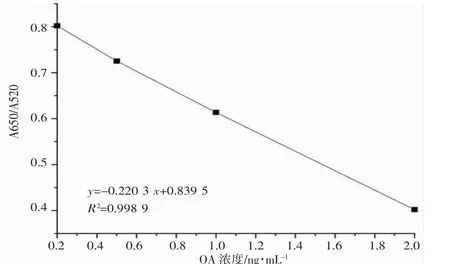
图8 OA 浓度在0.2 到2.0 ng·mL-1 范围内吸光度比(A610/A520)Fig.8 Absorbance ratio of OA concentration in the range of 0.1 to 2.0 ng·mL-1(A610/A520)
为了进一步检验检测实际样品中OA 的新方法的可行性,选取3 种阴性的贝类样本进行加标回收,设置(0.5、1.0、2.0 ng·mL-1)3 个浓度,每个浓度3 个平行,按照最佳的试验方案进行,计算回收率,如表1,平均回收率为82.23%~98.73%,相对标准偏差RSD 为3.34%~10.88%,表明本方法有较好回收率和精密度。
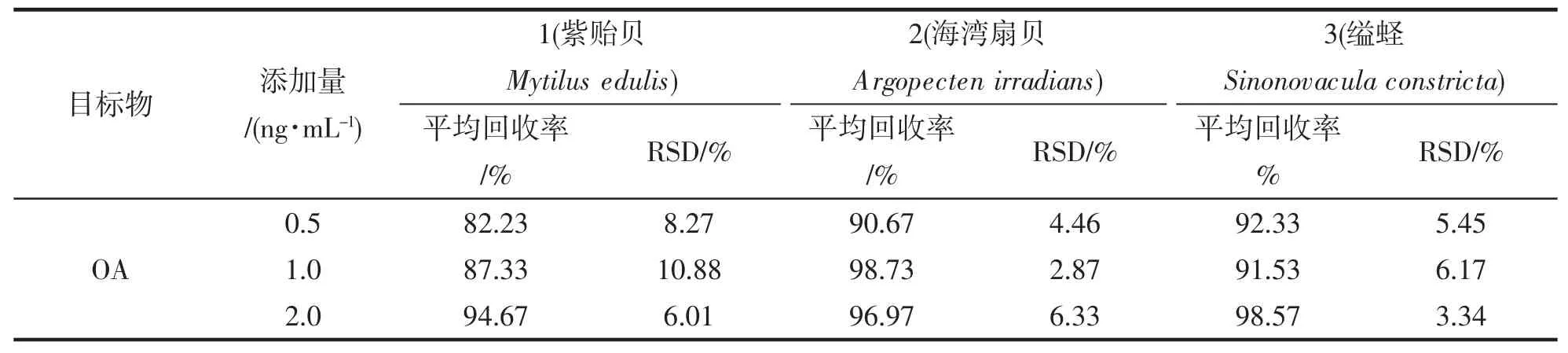
表1 样品加标回收率试验结果(n=3)Tab.1 Sample spiked recovery test results(n=3)
2.5 特异性研究
OA 与其衍生物鳍藻毒素DTX-1 和DTX-2 的分子结构非常相似,分别配制浓度为10 ng·mL-1的DTX-1 和DTX-2 进行测试,以考察传感器的特异性。结果如图9 表明,研制的传感器对OA 具有高度特异性,对DTX-1 和DTX-2 的吸光度接近纳米金的测试背景值,表明此传感器能够专一性识别OA,其衍生物毒素的存在不干扰OA 的检测。
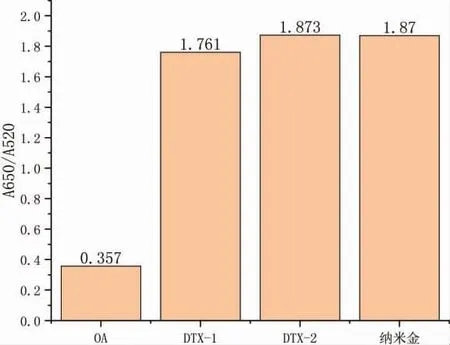
图9 核酸适配体传感器对不同贝类毒素和纳米金溶液的吸光度比(A610/A520)Fig.9 Absorbance ratio of nucleic acid aptamer sensor to different shellfish toxin and nano-gold solution(A610/A520)
2.6 实际样品检测结果
采用自制的比色型适配体生物传感器对市售的4 种贝类样品测定,结果见表2。10 个实际样品中,除9、10 号盲样外均未检出。

表2 实际样品检测Tab.2 Actual sample detection
3 总结
本次研究开发了一种用于检测大田软海绵酸的快速且灵敏的比色适配体生物传感器。在0.2~2.0 ng·mL-1范围内具有良好的线性关系,线性相关系数R2=0.998 9,检测限为0.044 ng·mL-1。在对实际样品的检测中平均回收率在82.23%~98.73%之间,表明该方法具有较好的回收率。适配体的特异性识别与显色反应体系保证了生物传感器检测OA 有良好选择性和准确性。结果表明,该方法快速、方便、灵敏,为OA 的快速现场检测提供了新思路。

