基于线粒体和核糖体分子标记研究我国南海方斑东风螺群体遗传结构
夏立萍,颜成瑞,朱爱意,叶莹莹
(浙江海洋大学国家海洋设施养殖工程技术研究中心,浙江舟山 316022)
方斑东风螺Babylonia areolata 简称东风螺,俗称花螺,隶属于腹足纲Gastropods,新腹足目Neogastropoda,蛾螺科Buccinidae,东风螺属Babylonia[1]。我国主要在福建、海南、广西和广东等省的沿海地区大量分布,是我国分布的几种东风螺中生长较快、个体较大、抗病能力强的一种优质贝类[2]。方斑东风螺因其外壳鲜艳漂亮、肉质肥厚、口味鲜美,在海产品市场上占据很大份额。但最近这几年,由于市场需求量增加和过度捕捞,方斑东风螺的自然生存数量开始锐减[3-4]。因此,通过遗传育种,遗传改良,评估方斑东风螺遗传多样性水平对其产业的发展具有十分重要的现实意义。
目前,分子标记作为物种鉴定及遗传多样性研究的常用方法已被广泛应用,如线粒体COI 基因、16S rRNA 基因、Cytb 基因和D-Loop 基因序列已被广泛应用到贝类[5-6]、甲壳动物[7]和鱼类中[8]。在方斑东风螺中,苏天凤[9]运用PCR 扩增技术,基于COI 基因和16S rRNA 基因对采自不同地区的方斑东风螺进行序列分析。结果分析显示COI 基因序列相比16S rRNA 基因序列而言更适用于东风螺种群的遗传多样性分析。目前现有的研究中很少有将线粒体基因与核糖体基因序列结合应用于方斑东风螺遗传多样性的研究中,而线粒体Cytb 基因又是一个包含变异性和保守性双重特性的一段DNA 序列区段[10-11],适用于研究物种遗传分化、种群遗传结构的分子标记方法,因此本研究将线粒体Cytb 基因与核糖体ITS 基因结合来进一步探讨方斑东风螺在我国南海4 个种群的遗传结构具有重要研究意义。
1 材料与方法
1.1 样品采集和DNA 提取
本研究所用的方斑东风螺样品采集于4 个沿海地区:广东湛江(ZJ)、福建厦门(XM)、广西北海(BH)和海南海口(HK)。所有样本参照改良盐析法提取基因组DNA[12],琼脂糖凝胶电泳检验其纯度后-20 ℃保存备用。
1.2 线粒体Cytb 和核糖体ITS 序列PCR 扩增和测序
参照NCBI 数据库中方斑东风螺线粒体基因组序列(NC-023080.1)设计扩增Cytb 的基因序列的引物,引物序列如下:CytbF2:5’-ATCGGGTTAGCAGTTATTCT-3’,CytbR2:5’-GAGCATTGGTCTTGTAAGTC-3’;ITS 基因采用通用引物,序列如下:ITS3:5’-GCATCGATGAAGAACGCAG,ITS28:5’-CGCCGTTACTAGGGGAATCCTTGTAAG-3’[13]。PCR 扩增条件均为:95 ℃预变性5 min;95 ℃变性30 s,51 ℃复性30 s,72 ℃延伸90 s,35 个循环;最后72 ℃延伸10 min。PCR 产物经1%琼脂糖凝胶电泳检测后,交由上海美吉生物医药科技有限公司进行双向测序。
1.3 序列分析及系统发育树构建
通过ClustalX 2.1 对测序获得的Cytb 和ITS 序列进行比对矫正,并对齐全部序列片段。为鉴定物种和所得片段的准确位置,使用NCBI 数据库中在线BLAST 工具(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对所有片段进行在线比对[14]。利用MEGA v7.0 软件进行序列比对和系统发育树构建[15]。利用软件Network v5.1,基于中介邻接法(median-joining method)构建各分子标记的单倍型网络图[16]。使用软件DnaSP v5.0 对所有数据根据其群体进行分组,并计算各类遗传多样性参数,如:单倍型个数(n)、变异位点、单倍型多样性(h)、核苷酸多样性(π)和核苷酸不匹配曲线分布(Mismatch distribution)[17]。使用软件Arlequin v3.5 进行分子方差分析(AMOVA)、计算遗传分化系数(FST)、基于Tajima′s D 与Fu′s Fs 模型下,对数据进行中性检测[18]。为了进一步测试每个群体之间的遗传差异,将相应片段数据从FASTA 格式转换成STR 格式之后使用Bonferroni 进行校正及多次检测FST的P 值。
2 结果与分析
2.1 遗传多样性分析
经过PCR 扩增测序,我们从4 个群体的样品中获得了894 bp Cytb 和324 bp ITS 基因片段。数据分析显示在获得的Cytb 基因片段样本中含有36 个单倍型(表1),其中有12 个共享单倍型且Hap-4 是唯一一个被这4 个群体同时共享的单倍型。唯一一个被3 个群体(湛江、北海、海口)样本共享的单倍型是Hap-8。此外,被湛江和北海群体共享的单倍型是Hap-1、Hap-3、Hap-10、Hap-11、Hap-12,被厦门和海口群体共享的单倍型有:Hap-13、Hap-14、Hap-16 和Hap-23,被北海和海口群体共享的单倍型只有Hap-31。其余单倍型均为各个群体特有单倍型。同样在分析ITS 基因片段时,发现35 个单倍型,这其中也包含了6 个共享单倍型(表2)。其中,北海、厦门、湛江、海口这4 个群体共享同一个单倍型Hap-6。Hap-4 为北海、厦门、海口这3 个群体共享的单倍型。Hap-10 是北海和海口群体共享单倍型,Hap-16 为北海和湛江群体共享单倍型,Hap-22 和Hap-24 是湛江和海口群体共享单倍型。其余单倍型均为各个群体特有单倍型。

表1 基于Cytb 标记的方斑东风螺4 个群体的遗传学参数Tab.1 Genetic diversity parameters of partical Cytb gene in four B.areolata populations

表2 基于ITS 标记的方斑东风螺4 个群体的遗传学参数Tab.2 Genetic diversity parameters of partical ITS gene in four B.areolata populations
从表1 和表2 得到4 个群体的方斑东风螺Cytb 和ITS 基因的遗传学参数。其中方斑东风螺Cytb 序列的平均单倍型多样性处于较高水平(h=0.905 82),核苷酸多样性处于偏低的水平(π=0.003 62);而ITS 序列的平均单倍型多样性处于中等偏高水平(h=0.784 798),核苷酸多样性是偏低的(π=0.018 48)。这4 个群体的单倍型多样性比较平均,彼此之间的差别不是很大,其中单倍型多样性最高的群体是北海(BH)地区的群体(h=0.956 52),海口(HK)地区的群体单倍型多样性数值最低(h=0.865 94)。我国南海方斑东风螺群体遗传多样性均较高。
2.2 群体遗传结构分析
从表3 可以很明显地看出在Cytb 基因结果中,遗传分化系数FST值处于-0.012 12 与0.037 86 之间,表里较低水平的遗传分化,仅海口与北海和湛江群体之间的存在显著性差异,而ITS 结果表明遗传分化系数FST值处于-0.002 54 与0.237 16,厦门群体与其他3 个群体之间均存在显著的遗传分化。
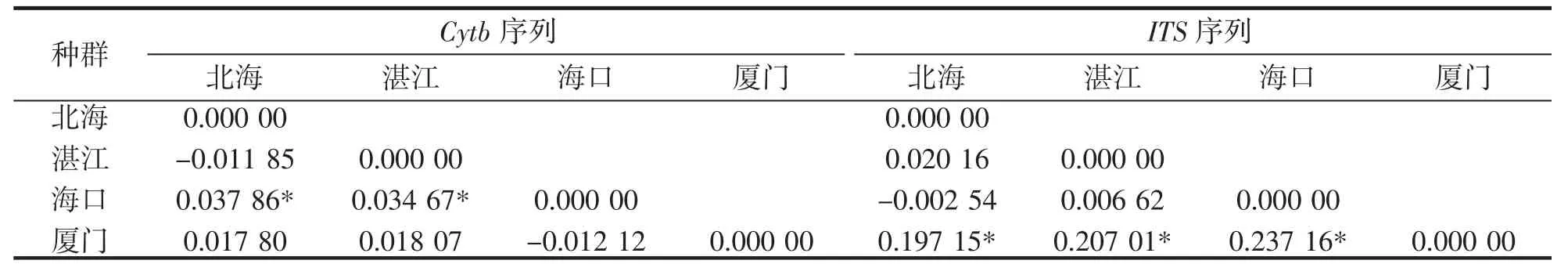
表3 基于Cytb 和ITS 的方斑东风螺的群体遗传分化系数(FST)Tab.3 Population genetic differentiation(FST)of B.areolata based on Cytb and ITS genes
利用4 个群体的Cytb 和ITS 基因的遗传距离构建NJ 系统发育树如图1、2 所示,2 个系统发育树基本一致,该系统发育树总体分为2 大支,厦门群体为单独一支,其余的3 个群体在另外一个大支上,ITS 基因的系统发育树显示这3 个群体又分了2 小支,其中北海和海口单倍型在一个小支上而湛江单独地在另外一个小支上;在Cytb 的系统发育树上显示,海口单独分在了其中的一小支上,湛江和北海共同在另外一个小支上。
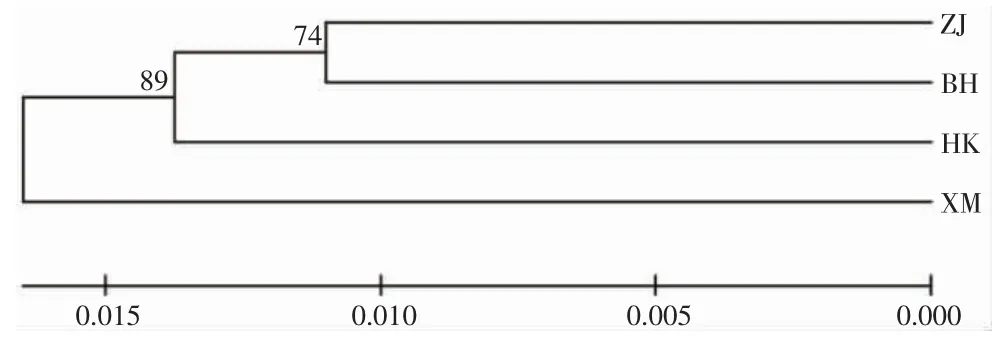
图1 4 个方斑东风螺群体Cytb 基因的NJ 系统发育树Fig.1 NJ phylogenetic tree of four populations of B.areolata based on Cytb gene
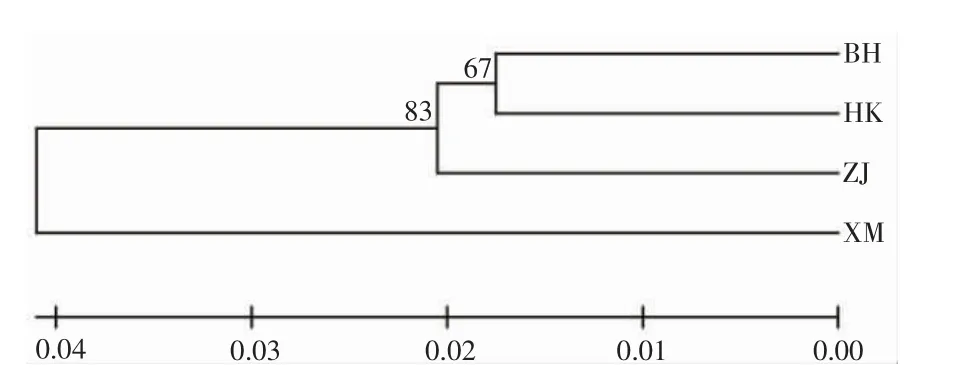
图2 4 个方斑东风螺群体ITS 基因的NJ 系统发育树Fig.2 NJ phylogenetic tree of four populations of B.areolata based on ITS gene
图3、4 为方斑东风螺群体的单倍型网络关系图,Cytb 和ITS 基因结果一致,由图可知,Cytb 基因中Hap-4 位于单倍型中央,ITS 基因中Hap-6 位于单倍型中央,为所有群体共享,呈现明显的“星状”拓扑结构。不同群体的单倍型未呈现地理分支,没有表现出显著的地理系谱结构。
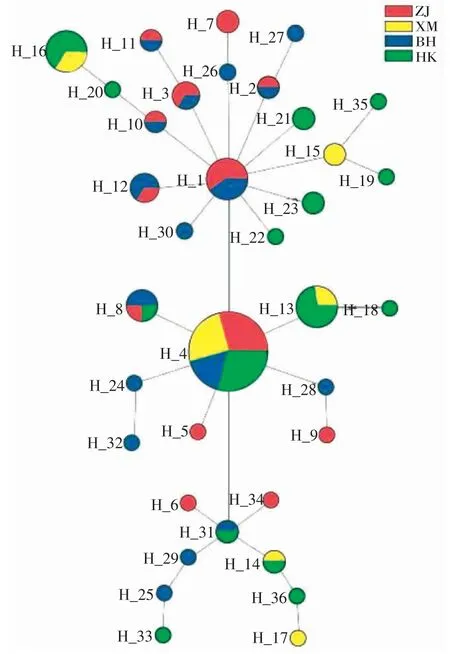
图3 4 个方斑东风螺群体的Cytb 单倍型进化网络图Fig.3 Haplotype evolutionary network of four populations of B.areolata based on Cytb gene
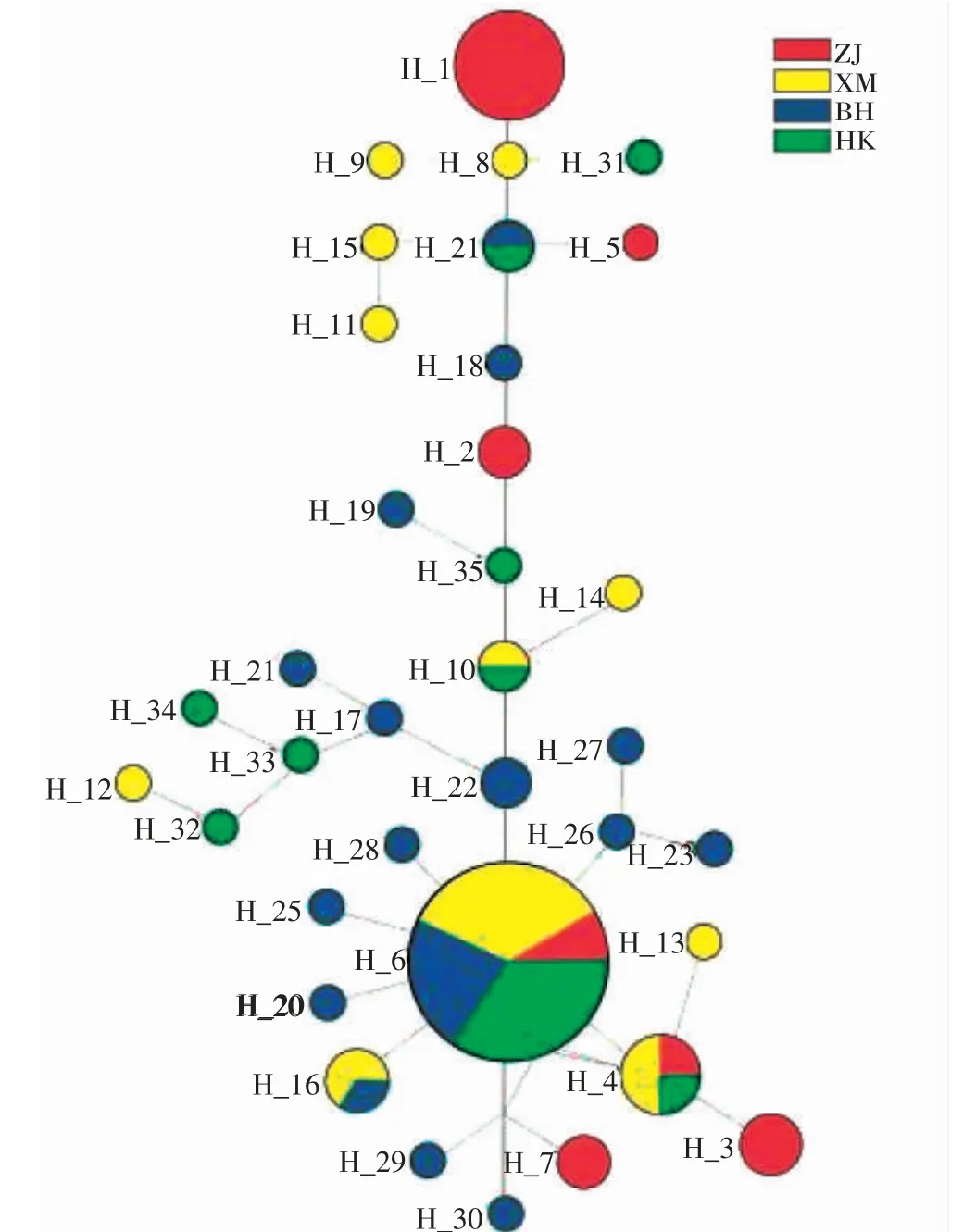
图4 4 个方斑东风螺群体的ITS 单倍型进化网络图Fig.4 Haplotype evolutionary network of four populations of B.areolata based on ITS gene
2.3 群体历史动态分析
AMOVA 分析表明(表4),我国南海方斑东风螺的遗传分化2.77%(Cytb)和12.28%(ITS)来自群体间,97.23%(Cytb)和87.72%(ITS)来自群体内。表明群体内的遗传分化比例远远大于群体间的遗传分化比例。中性检验结果显示,Tajima′s D 值以及Fu′s FS值的P 值均为负值(P<0.05),Cytb 核苷酸不匹配分布图呈现双峰型,ITS 核苷酸不匹配分布图呈现多峰型,表明4 个群体的方斑东风螺在史上均未出现种群扩张(表5、6,图5、6)。

表4 4 个方斑东风螺群体Cytb 和ITS 分子方差分析(AMOVA)Tab.4 AMOVA analysis among four populations of B.areolata based on Cytb and ITS genes
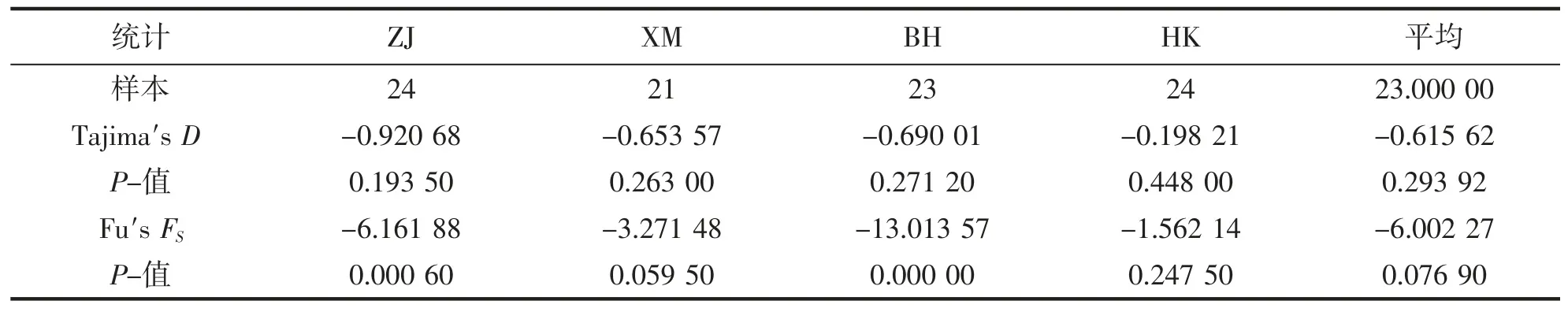
表5 4 个方斑东风螺群体的Cytb 选择中性检验Tab.5 Neutral test for four populations of B.areolata based on Cytb gene
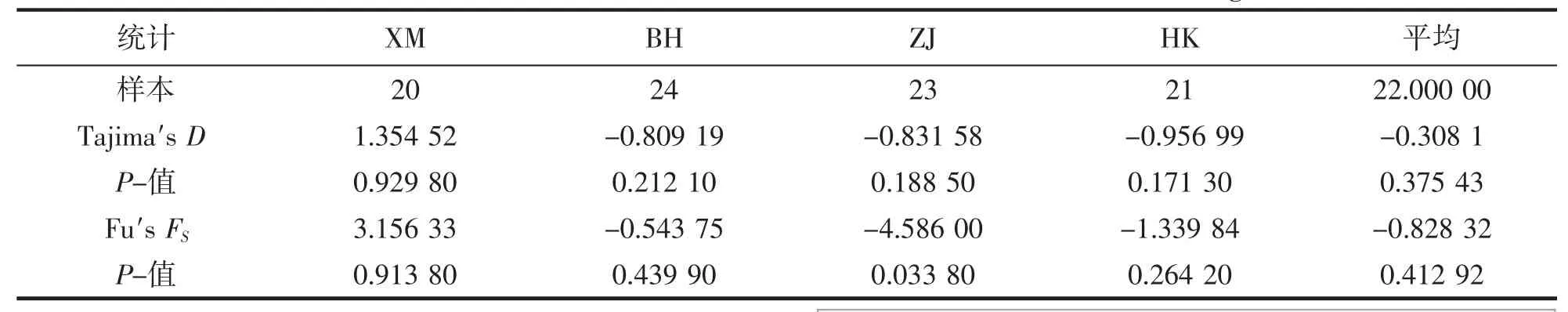
表6 4 个方斑东风螺群体的ITS 选择中性检验Tab.6 Neutral test for four populations of B.areolata based on ITS gene

图5 4 个方斑东风螺群体的Cytb 核苷酸不匹配分布图Fig.5 Nucleotide mismatch distribution of four populations of B.areolata based on Cytb gene
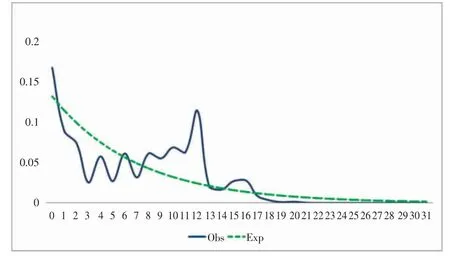
图6 4 个方斑东风螺群体的ITS 核苷酸不匹配分布图Fig.6 Nucleotide mismatch distribution of four populations of B.areolata based on ITS gene
3 讨论
3.1 遗传多样性
遗传多样性代表着物种适应环境变异的能力,是生物多样性的基础,群体遗传结构是生物多样性的保护单元,在进化上具有重要意义。目前在不断地倡导保护自然资源、保护鱼类资源,海洋鱼类数量上的锐减已经得到了很大的改善,但是随之而来问题逐渐凸显:物种的多样性是否也得到了保护?近些年来,以PCR 技术为主要试验支撑技术的分子标记实验在物种的种群遗传结构的研究中得到了越来越广泛的应用[19]。在这个过程中也出现了许多分子标记的方法,不仅有从核DNA 出发的微卫星分子标记方法,也有得到了较多应用的例如D-Loop 区、COI、Cytb、16S rRNA 等多种线粒体DNA 片段,还有利用核糖体DNA 区段。本研究利用线粒体Cytb 和核糖体ITS 基因序列研究了我南海沿海方斑东风螺的遗传多样性及遗传分化水平,结果表明我国南海的方斑东风螺有着比较丰富的遗传多样性。单倍型多样性水平和核苷酸多样性水平是评价遗传多样性水平高低的重要参数。单倍型多样性和核苷酸多样性值越大,物种的遗传多样性越丰富,本研究中Cytb 和ITS 基因在方斑东风螺群体中单倍型多样性指数分别为0.905 82 和0.784 79,核苷酸多样性指数分别为0.003 62 和0.018 48,该结果与张旦旦等[20]利用COI 和Cytb 基因研究香螺Neptunea cumingii 的遗传多样性水平相似。此外,这种情况也存在于许多海洋贝类中[21-23]。
3.2 种群遗传结构
群体遗传结构分析结果显示方斑东风螺两两群体间的FST值呈较低水平且仅少数达到显著性水平,表明方斑东风螺不同群体间没有形成显著的遗传分化,仅厦门群体与其他3 个群体间存在低程度的遗传分化。我国南海沿海方斑东风螺群体没有形成显著的遗传结构,其遗传分化水平较低,各个群体间存在频繁的基因交流。AMOVA 分析结果也证明造成遗传变异的主要因素都存在于种群的内部。
通常,海洋生物的遗传结构及遗传分化水平较之陆生生物低,这可能是由于海洋环境缺乏像陆地环境一样的有效屏障[24-25]。由于大多数的海洋生物都有浮游幼虫期,尤其是成体营固着生活的双壳类,海流的存在极大地增强了幼虫的扩散能力,使不同地理种群间产生基因交流,从而避免显著系统地理结构的出现[26]。海流对生物的遗传分化的影响是十分重要的,方斑东风螺生活史中具有12 d 左右的浮游期[27]。其繁殖期在我国为每年4-9 月[28],此期间,在浮游幼虫可在南海西南季风漂流及其分支的推动下,各群体间可以进行频繁的基因交流,从而降低遗传分化水平。

