肺癌患者化疗前后Th1/Th2细胞因子免疫反应状态变化及对预后的影响
韦安猛 张伟华 张春玲 张德震 李向向
肺癌发病率与死亡率居全球榜首,大部分患者确诊时已处于晚期,失去手术机会[1-2]。对于晚期肺癌患者,化疗仍是主要治疗手段,培美曲塞联合顺铂为一线化疗方案[3]。研究证实,肺癌患者普遍处于免疫抑制状态,是导致肿瘤细胞持续侵袭、增殖的重要因素[4]。辅助性T细胞(Th)是机体重要免疫调节细胞,Th1、Th2及其所分泌的细胞因子在抗肿瘤免疫、肿瘤微环境、肿瘤免疫逃避和耐受、机体免疫稳态等方面发挥重要作用[5-6]。为了探讨免疫功能与肿瘤疗效关系及化疗对免疫功能影响,本研究尝试分析肺癌患者化疗前后Th1/Th2细胞因子免疫反应状态变化及对预后的影响,旨在为临床提供参考依据。
1 材料与方法
1.1 一般资料
选取我院2019年7月~2019年12月收治的晚期肺癌患者90例作为观察组,另选取同期健康体检者40例作为对照组。肺癌患者均符合《中华医学会肺癌临床诊疗指南(2018版)》[7]中相关诊断标准,并经细胞学、病理学或影像学检查确诊;所有入选对象均排除各种急慢性感染及支气管哮喘、慢性阻塞性肺疾病等,排除类风湿关节炎、多发性硬化症等自身免疫病。观察组男性54例,女性36例,年龄38~79岁,平均年龄(59.48±8.39)岁,体质量指数17~27 kg/m2,平均(22.08±1.93)kg/m2,依据世界卫生组织(WHO)分类标准分型:鳞状细胞癌47例,腺癌43例,根据美国联合癌症分类委员会(AJCC)和国际抗癌联盟(UICC)TNM分期标准分期:Ⅲ期49例,Ⅳ期41例。对照组男性24例,女性16例,年龄37~80岁,平均年龄(60.27±9.15)岁,体质量指数17~27 kg/m2,平均(22.29±2.06)kg/m2。两组性别、年龄、体质量指数均衡可比(P>0.05)。
1.2 方法
1.2.1 检测方法 空腹抽取静脉血3 ml,离心(3000 r/min,5 min,离心半径5 cm),取血清,采用酶联免疫双抗夹心法(ELISA)检测IL-4、IL-6、IL-10、IFN-γ水平,标准品及检测试剂盒均购自Genezyme公司。
1.2.2 治疗方法 培美曲塞(扬子江药业集团有限公司,国药准字H20143379)500 mg/m2,静滴,d1;顺铂(南京制药厂有限公司,国药准字H20030675)75 mg/m2,静滴,d1~d3。以1个月为1个周期。
1.3 观察指标
(1)两组化疗前后血清IL-4、IL-6、IL-10、IFN-γ水平。(2)不同疗效患者化疗前后IL-4、IL-6、IL-10、IFN-γ水平。疗效标准:肿瘤病灶完全消失为完全缓解;与基线状态相比,肿瘤病灶最长径之和减少≥30%为部分缓解;与治疗开始后肿瘤最小靶病灶最长径之和相比,增加≥20%或出现新病灶为进展;介于部分缓解与进展之间为稳定,将完全缓解、部分缓解、稳定计入有效。(3)IL-4、IL-6、IL-10、IFN-γ与化疗疗效的关系。(4)血清IFN-γ与IL-4、IL-6、IL-10相关性。(5)IL-4、IL-6、IL-10、IFN-γ对疗效的预测价值。(6)生存分析。
1.4 统计学方法
2 结果
2.1 两组IL-4、IL-6、IL-10、IFN-γ水平
观察组化疗前、化疗2个周期后第4、15、21 d血清IL-4、IL-6、IL-10水平高于对照组,IFN-γ水平低于对照组,观察组化疗2个周期后第4、15、21 d血清IL-4、IL-6、IL-10水平低于化疗前,IFN-γ水平高于化疗前(P<0.05),见表1。

表1 两组IL-4、IL-6、IL-10、IFN-γ水平比较
2.2 不同疗效患者化疗前后IL-4、IL-6、IL-10、IFN-γ水平比较
化疗前有效者血清IL-4、IL-6、IL-10水平低于无效者,IFN-γ水平高于无效者(P<0.05);有效者化疗2个周期后第4 、15 、21 d血清IL-4、IL-6、IL-10水平低于化疗前及无效者,IFN-γ水平高于化疗前及无效者(P<0.05),见表2。

表2 不同疗效患者化疗前后IL-4、IL-6、IL-10、IFN-γ水平比较
2.3 IL-4、IL-6、IL-10、IFN-γ与化疗疗效的关系
Logistic回归分析,IL-4、IL-6、IL-10、IFN-γ与晚期肺腺癌患者化疗疗效显著相关(P<0.05),见表3。

表3 IL-4、IL-6、IL-10、IFN-γ与化疗疗效的关系
2.4 血清IFN-γ与IL-4、IL-6、IL-10的相关性
Pearson相关性分析,化疗前及化疗2个周期后第4、15、21 d血清IFN-γ与IL-4、IL-6、IL-10呈负相关(P<0.05),见表4。
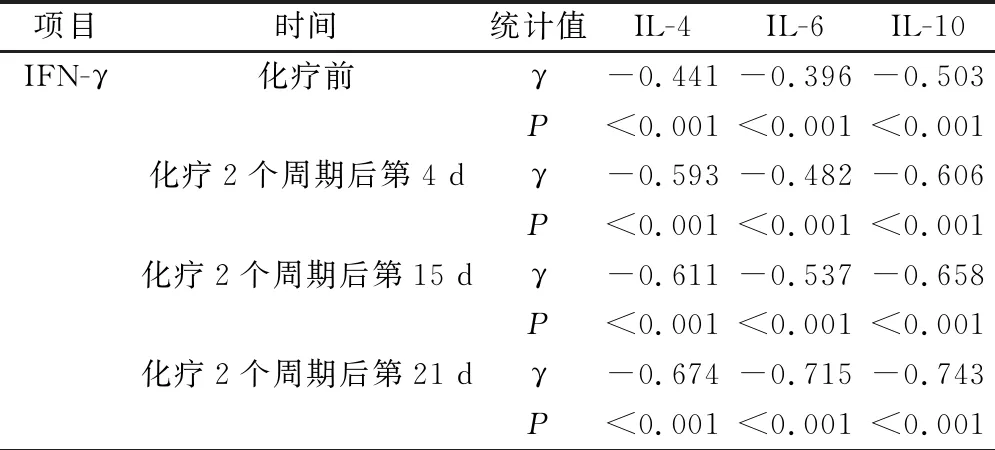
表4 血清IFN-γ与IL-4、IL-6、IL-10的相关性
2.5 IL-4、IL-6、IL-10、IFN-γ对疗效的预测价值
根据不同疗效患者化疗前血清IL-4、IL-6、IL-10、IFN-γ水平绘制ROC曲线,IL-4、IL-6、IL-10、IFN-γ预测疗效均具有较高AUC值,尤以联合预测最高,联合预测AUC值为0.852,敏感度81.58%,特异度82.69%,见表5,图1。

表5 IL-4、IL-6、IL-10、IFN-γ对疗效的预测价值

图1 IL-4、IL-6、IL-10、IFN-γ对疗效的预测价值
2.6 生存分析
根据ROC曲线最佳截断值分为高表达者、低表达者。随访6个月,Kaplan-Meier曲线分析,血清IL-4、IL-6、IL-10高表达者生存率低于低表达者,IFN-γ高表达者生存率高于低表达者(χ2=36.872、35.830、31.552、28.686,P<0.001),见图2。

注:A图为IL-6,B图为IL-4,C图为IL-10,D图为IFN-γ。
3 讨论
机体免疫状态与恶性肿瘤发生、发展密切相关,免疫耐受机制抑制有效的抗肿瘤免疫是当前困扰肿瘤治疗的难题[8-9]。Th是机体重要免疫调节细胞,存在Th1、Th2两个不同功能亚群,Th1型细胞因子(IFN-γ等)主要介导细胞免疫应答,机体抗肿瘤免疫的主要形式即是细胞免疫;Th2型细胞因子(IL-4、IL-6、IL-10等)主要介导体液免疫反应[10-11]。Th1/Th2型细胞因子动态平衡对维持机体免疫功能正常至关重要,平衡失调(即Th1/Th2漂移)可导致机体免疫调节功能紊乱,出现病理状态[12]。研究发现,Th1细胞诱导的免疫应答是抑制恶性肿瘤增生所必需的,Th1型细胞因子占优势可增强抗肿瘤免疫反应;而Th2型细胞因子占优势对肿瘤免疫耐受形成具有促进作用[13-14]。恶性肿瘤患者处于Th2细胞优势的分化状态,其产生的细胞因子可抑制Th1细胞增殖分化及细胞毒性T淋巴细胞功能,减弱机体抗肿瘤免疫功能,在肿瘤发生、发展及转归中起着重要作用[15-16]。陈钢等[17]研究显示,非小细胞肺癌患者外周血Th1淋巴细胞水平低于健康志愿者,Th2淋巴细胞水平高于健康志愿者,且Ⅲ、Ⅳ期非小细胞肺癌患者Th1淋巴细胞水平更低,Th2淋巴细胞水平更高。本研究发现,晚期肺癌患者血清IL-4、IL-6、IL-10水平高于健康体检者,IFN-γ水平低于健康体检者,表明晚期肺癌患者存在Th1抑制与Th2极化状态,出现Th1向Th2的异常漂移,提示Th1/Th2型细胞因子的平衡失调可能与肺癌发生发展有关。进一步相关性分析发现,化疗前及化疗2个周期后血清IFN-γ与IL-4、IL-6、IL-10呈负相关,提示Th1型细胞因子与Th2型细胞因子间可能存在负反馈调节关系,相关影响,共同参与肺癌发生、发展及病情转归。
化疗药物对机体免疫功能有双重作用,一方面,化疗可杀伤肿瘤细胞,减轻或解除肿瘤对机体的免疫抑制,改善T淋巴细胞的免疫功能[18];其二,化疗药物的非选择性,对增殖活跃的淋巴细胞杀伤明显,导致机体免疫功能进一步降低[19],而哪一作用处于主导地位,决定了免疫功能状态的变化趋势。培美曲塞是新型多靶点抗叶酸化疗药物,通过破坏叶酸依赖性正常代谢,抑制细胞复制,进而抑制肿瘤生长;顺铂属细胞周期非特异性药物,抑制癌细胞DNA复制,并损伤其细胞膜结构,发挥抗肿瘤作用[20]。培美曲塞联合顺铂方案以其可耐受度高、安全性好、周期短等优点,是目前晚期肺癌一线治疗中最常用方案之一。既往研究表明,培美曲塞可以改善患者免疫功能,尤其化疗后短期内免疫功能的改善更为明显[21-22]。本研究结果显示,晚期肺癌患者化疗2个周期后血清IL-4、IL-6、IL-10水平显著降低,IFN-γ水平显著升高,提示培美曲塞联合顺铂方案可改善Th1/Th2型细胞因子平衡失调。分析认为,肿瘤形成后,通过分泌Th2型细胞因子,引起Th1向Th2漂移,进一步抑制细胞免疫,形成恶性循环,而化疗药物的抗肿瘤作用可中断了Th1/Th2比例失衡的恶性循环链,但其具体机制尚需进一步研究。
进一步探讨发现血清IL-4、IL-6、IL-10、IFN-γ与化疗疗效相关,为明确IFN-γ、IL-4、IL-6、IL-10对化疗疗效的预测价值,ROC曲线显示,IL-4、IL-6、IL-10、IFN-γ预测疗效均具有较高AUC值,尤以联合预测最高,提示各指标联合检测可提高疗效预测价值。此外,Kaplan-Meier曲线分析,血清IL-4、IL-6、IL-10高表达者、IFN-γ低表达者生存率较低,表明Th1/Th2细胞因子免疫反应状态紊乱越严重,预后越差。可能为逆转肿瘤的免疫逃逸状态寻找新的靶点,且可能成为肺癌分级及评估预后的新指标。
综上可知,晚期肺癌患者存在Th1/Th2细胞因子免疫反应状态紊乱,培美曲塞联合顺铂化疗对改善机体免疫平衡有效;IFN-γ、IL-4、IL-6、IL-10与化疗疗效显著相关,联合检测可提高疗效与预后预测价值,为个体化治疗提供参考。

