高糖环境下Ndufa4线粒体复合体相关蛋白2(Ndufa4l2)对小鼠视网膜感光细胞661W的影响△
温艳君 张雪蕊 韦 严 赵培泉
糖尿病视网膜病变(DR)是中老年人群视力丧失的主要原因[1-2]。线粒体在细胞的生长和功能活性中发挥着关键作用,许多视网膜疾病是由线粒体功能障碍导致的。因此,研究线粒体在DR发生发展中的作用具有重要意义。有研究表明,高糖条件下,线粒体功能失调会导致细胞功能受损,活性氧(ROS)积累增加[3]。Taurino等[4]发现,线粒体复合体I的活性抑制是1型糖尿病患者糖尿病性脑病发病的关键因素;Pesta等[5]研究显示,Ndufb6与2型糖尿病发病相关。因此,我们推断Ndufa4线粒体复合体相关蛋白2(Ndufa4l2)作为线粒体电子转运链复合物Ⅰ的一个亚基可能参与DR的发生发展过程。然而,Ndufa4l2在DR中的作用和相关机制的报道较少。本研究旨在通过构建DR小鼠体内模型和高糖刺激感光细胞661W的体外模型探讨Ndufa4l2在DR的661W细胞中的作用及其机制。
1 材料与方法
1.1 主要材料C57BL/6J小鼠(12只,购自上海吉辉实验动物有限公司),661W细胞(实验室自存,上海交通大学医学院附属新华医院眼科实验室),胎牛血清(美国Gibco公司),DMEM 培养基(美国Hyclone公司),2.5 g·L-1胰蛋白酶、乙二胺四乙酸(EDTA)消化液、D-葡萄糖溶液(美国Thermo公司),二甲基亚砜(美国Amresco公司),NDUFA4L2 抗体、β-Actin抗体(中国爱博泰克ABclonal公司)。RNA提取试剂盒(中国EZBioscience公司),反转录cDNA 试剂盒(日本Takara公司),2×TaqMaster Mix染料(南京诺唯赞公司),链脲佐菌素(STZ)和ROS检测试剂盒(上海懋康生物科技有限公司),乳酸检测试剂盒(南京建成公司),化学发光法显色试剂盒(美国Thermo Fisher Science公司),siRNA 序列由上海吉满生物科技有限公司合成。
1.2 方法
1.2.1 生物学信息分析从GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)获取GSE160305芯片表达数据,使用R语言分析差异表达基因,差异筛选条件为校正后的P>0.05和|logFoldChange|>0.5(FoldChange:差异倍数)。
1.2.2 DR动物模型的构建及分组SPF级4周龄C57BL/6J小鼠饲养于上海交通大学医学院附属新华动物实验中心,饲养温度22~25 ℃,饲养湿度45%~55%,在安静环境下自由进食和饮水。饲养和实验过程均严格按照《上海交通大学医学院附属新华医院医学伦理委员会条例》进行。适应环境1周后开始造模。STZ溶液用柠檬酸钠溶解,现用现配。小鼠空腹24 h后,采用随机数字表法分成糖尿病组(腹腔注射50.0 mg·kg-1STZ溶液)和正常组(腹腔注射等量的柠檬酸钠溶液),每组各6只,均连续注射5 d。最后1次注射1周后剪尾测量血糖。小鼠血糖≥13.9 mmol·L-1代表造模成功,纳入后续动物实验。
1.2.3 免疫组织化学法检测小鼠视网膜中Ndufa4l2蛋白的表达水平造模后的C57BL/6J小鼠持续饲养2个月后,采取颈椎脱臼的方法处死,取小鼠眼球进行固定、包埋和切片。将切片脱蜡,抗原修复后,3.0 g·L-1H2O2室温孵育15 min,加山羊血清封闭。分别滴加一抗(Ndufa4l2 11000)、二抗、HRP标记亲和素,进行DAB染色,苏木素复染,梯度乙醇脱水,透明,中性树胶封片,晾干。显微镜下观察,拍照,采用ImageJ图像处理软件分析结果。
1.2.4 661W细胞系的培养661W细胞接种于10 cm培养皿中,细胞融合度为70%~80%时置于含体积分数10%胎牛血清、10.0 g·L-1青-链霉素溶液的DMEM培养基,在37 ℃、含体积分数5% CO2培养箱中培养。将661W细胞采用随机数字表法分为对照组(细胞采用正常培养基培养24 h)、高糖组(细胞采用含50.0 mmol·L-1葡萄糖的培养基培养24 h)、Ndufa4l2沉默对照(si-NC)组(细胞转染si-NC无序序列后,采用正常培养基培养24 h)、Ndufa4l2高糖沉默对照(si-NC+HG)组(细胞转染si-NC无序序列后,采用含50.0 mmol·L-1葡萄糖的培养基培养24 h)和Ndufa4l2高糖沉默(si-Ndufa4l2+HG)组(细胞转染si-Ndufa4l2特异敲低序列后,采用含50.0 mmol·L-1葡萄糖的培养基培养24 h)。
1.2.5 CCK-8法检测Ndufa4l2对661W细胞活性的影响si-NC组、si-NC+HG组和si-Ndufa4l2+HG组661W细胞接种于96孔板,每孔100 μL 培养基,含有2000个细胞,贴壁24 h后每孔加入10 μL CCK-8试剂,培养箱内培养1 h,采用酶标仪测量450 nm波长处的光密度(D)。相对细胞活性=(D实验组-D空白组)/(D对照组-D空白组)×100%。实验重复3次。
1.2.6 ROS检测试剂盒检测661W细胞中ROS水平采用H2DCFDA荧光法测定ROS水平,将661W细胞按照每孔0.2×106个均匀铺于12孔板爬片,贴壁24 h后将si-NC组、si-NC+HG组和si-Ndufa4l2+HG组661W细胞加入不同糖浓度的培养基(1 mL),孵育24 h后用PBS清洗2次,加入10 μmol·L-1的H2DCFDA染色液,在37 ℃、体积分数5% CO2培养箱中孵育30 min,荧光显微镜下观察荧光亮度,拍照并保存。
1.2.7 qRT-PCR 检测661W细胞中Ndufa4l2 mRNA表达水平采用RNA试剂盒提取正常组和高糖组661W细胞总 RNA。利用逆转录酶扩增 cDNA,SYBRgreen qRT-PCR混合物测定Ndufa4l2 mRNA在661W细胞中的表达,β-Actin作为内参。Ndufa4l2引物序列:上游引物为 5’-TAGGGACCCGCTTCTACCG-3’,下游引物为5’-GGCAAGTCGCAGCAAGTAGA-3’;si-Ndufa4l2引物序列:上游引物为5’-UUGCCGUUUCAACCGACUACA-3’;下游引物为5’-UGUAGUCGGUUGAAACGGCAA-3’;β-Actin序列:上游引物为5’-TTCGTTGCCGGTCCACACCC-3’;下游引物为5’-GCTTTGCACATGCCGGAGCC-3’。利用 2-ΔΔCt方法计算661W细胞中Ndufa4l2 mRNA 的相对表达水平。
1.2.8 乳酸检测试剂盒检测661W细胞上清中乳酸含量收取si-NC组、si-NC+HG组和si-Ndufa4l2+HG组细胞上清放于1.5 mL离心管中,10 000 r·min-1离心10 min。去除沉淀,将细胞培养的上清吸出转移至新的离心管中待测。按照乳酸试剂盒说明书配制所需试剂,按说明时间反应后,采用酶标仪测量450 nm波长处的D,按照公式转换成乳酸浓度:乳酸浓度=(D测定值-D空白值)/(D标准值-D空白值)×3。
1.2.9 Western blot 检测661W细胞中Ndufa4l2蛋白表达水平待661W细胞覆盖培养皿底部80%时,吸除培养皿中的完全培养基,在室温环境下,PBS清洗3次。RIPA 裂解液与蛋白酶抑制剂按体积比1001混合后,每孔加入适量的混合液,放置在冰上10 min充分裂解。用细胞刮刀将细胞刮下后转移放置在新的离心管中,在4 ℃环境下13 000 r·min-1离心15 min,取上清。上清蛋白经过SDS PAGE电泳后,将蛋白条带转至PVDF膜,使用快速封闭液封闭,分别使用兔抗小鼠Ndufa4l2一抗,山羊抗兔二抗完成孵育与洗涤,使用 ECL 化学发光显色试剂盒进行显色。显色后,条带使用ImageJ软件分析计算Ndufa4l2蛋白的相对表达水平。以各样品对应的β-Actin相对含量为基准。
1.3 统计学方法采用Graphpad 8.0软件进行实验数据的描述性统计分析,计量资料以均数±标准差表示。在计量数据符合正态分布的前提下,两组间比较采用t检验。检验水准:α=0.05。
2 结果
2.1 生物信息学工具预测可能参与增生型DR发生发展的基因在GSE160305 数据中包含 20 例正常人视网膜和 20例糖尿病但未出现DR患者的视网膜,34例非增生型DR(NPDR)患者的视网膜和5例增生型DR(PDR)患者的视网膜。利用R包(limma)做差异分析,将糖尿病但未出现DR患者的视网膜、NPDR患者的视网膜和PDR患者的视网膜分别与正常组做差异分析,取得差异表达基因。将差异表达基因取交集后得到16个差异基因(图1)。在16个差异基因间,本研究选取了与线粒体相关的Ndufa4l2基因进行差异表达验证,并进一步探究Ndufa4l2基因在DR中潜在的作用机制。
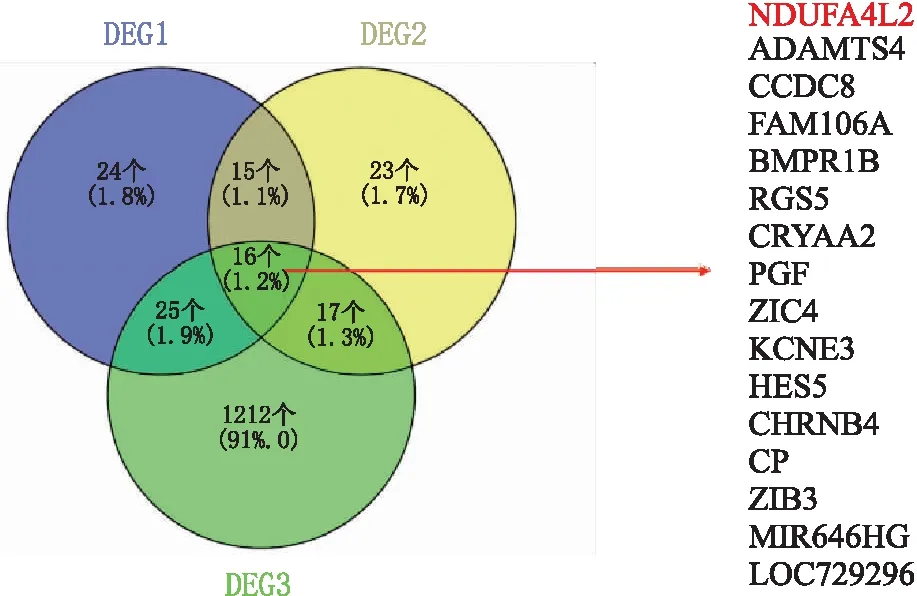
图1 差异基因取交集后的基因列表 DEG1:正常视网膜与NPDR患者视网膜的差异表达基因;DEG2:正常视网膜与PDR患者视网膜的差异表达基因;DEG3:正常视网膜与糖尿病但未出现DR患者视网膜的差异表达基因。
2.2 与Ndufa4l2表达模式相似基因的功能注释及KEGG通路富集分析通过R Studio数据整理分析,计算与Ndufa4l2基因的相关性,分析得到相关系数,取与之关系密切的基因列表(取P<0.05),再通过对这些基因进行功能注释和通路富集分析,推测Ndufa4l2在DR中可能发挥作用的方式。通过GO分析可知,在生物学进程方面,Ndufa4l2可能主要涉及膜电位调节、细胞外围的蛋白质定位和多细胞机体信号等信号通路。在细胞组分方面,主要涉及突触、跨膜转运蛋白复合体、离子通道复合体等信号通路。在分子功能方面,Ndufa4l2可能与跨膜转运蛋白的活性、离子通道活性、电压门控通道等信号通路相关。KEGG通路富集分析结果显示,Ndufa4l2可能主要与氧化磷酸化通路相关,所以后续主要分析Ndufa4l2在氧化磷酸化中的作用(图2)。
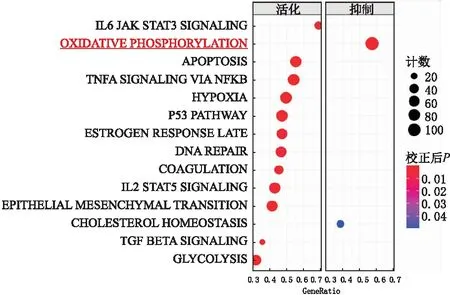
图2 KEGG富集分析与Ndufa4l2功能相近基因
2.3 小鼠视网膜中Ndufa4l2蛋白表达水平比较糖尿病组小鼠和正常组小鼠相比,体重降低,血糖升高,差异均有统计学意义(均为P<0.001),这表明糖尿病小鼠模型造模成功。免疫组织化学检测结果显示,正常组和糖尿病组小鼠的D分别为0.441±0.037 和0.354±0.002,与正常组相比,糖尿病组小鼠视网膜中Ndufa4l2蛋白表达水平降低,差异有统计学意义(P<0.05)(图3)。
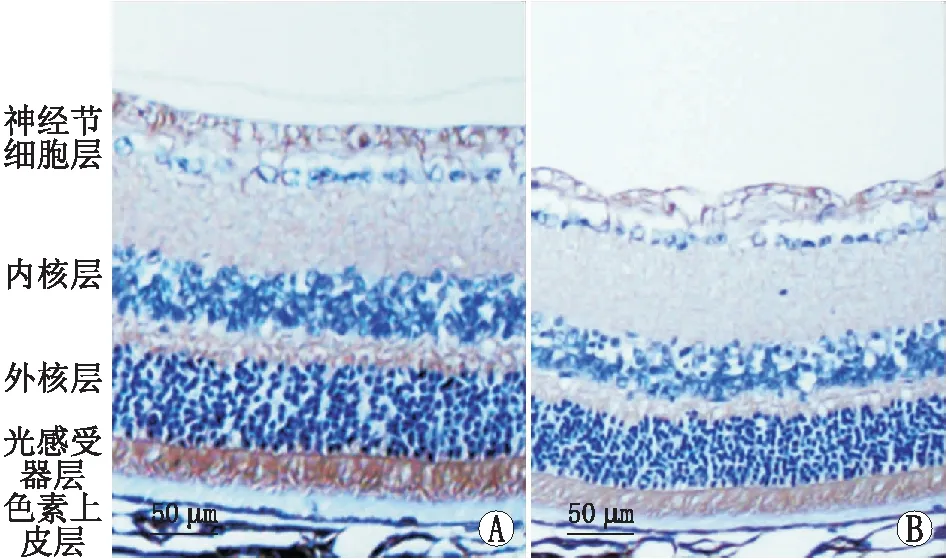
图3 免疫组织化学检测小鼠视网膜中Ndufa4l2蛋白表达情况 A:正常组;B:糖尿病组。
2.4 661W细胞中Ndufa4l2 mRNA和蛋白表达水平以对照组661W细胞中Ndufa4l2的表达量为基准,对照组和高糖组中Ndufa4l2 mRNA表达量分别为1.001±0.069 和0.360±0.070。与对照组相比,高糖组中Ndufa4l2 mRNA表达降低,差异有统计学意义(P<0.001)。对照组和高糖组661W细胞中Ndufa4l2蛋白表达水平分别为1.000±0.079和0.780±0.070,高糖组中Ndufa4l2蛋白表达水平下降,差异有统计学意义(P<0.05)。说明体外高糖条件下,661W细胞中Ndufa4l2的表达较正常培养环境降低(图4)。
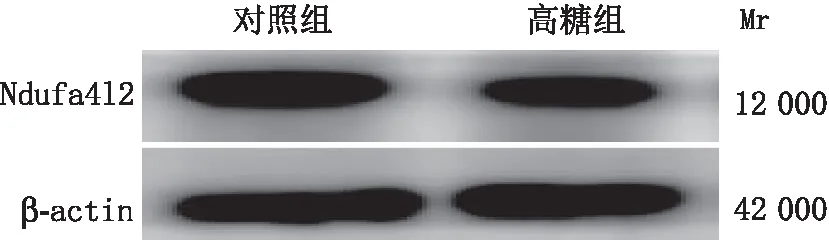
图4 661W细胞中Ndufa4l2蛋白表达
2.5 661W细胞活力比较CCK-8法检测结果显示,si-NC组、si-NC+HG组和si-Ndufa4l2+HG组细胞活力分别为99.68%±0.56%、83.82%±8.18% 和66.25%±4.26%,si-NC+HG组与si-NC组和si-Ndufa4l2+HG组661W细胞活力相比差异均有统计学意义(均为P<0.01)。以上结果表明,高糖刺激会导致661W细胞活力下降,而Ndufa4l2的表达降低会进一步加剧高糖对细胞的损伤。
2.6 Ndufa4l2沉默后对661W细胞ROS产生的影响细胞ROS检测结果显示,si-NC+HG组ROS荧光检测水平明显高于si-NC组;si-Ndufa4l2+HG组和si-NC+HG组相比,ROS荧光程度进一步提高,说明高糖条件下Ndufa4l2表达下降会进一步提高661W细胞产生的ROS水平(图5)。
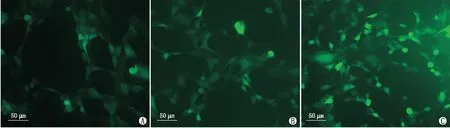
图5 沉默Ndufa4l2对661W细胞内ROS水平的影响 A:si-NC组;B:si-NC+HG组;C:si-Ndufa4l2+HG组。
2.7 Ndufa4l2沉默后对661W细胞中乳酸水平的影响si-NC组、si-NC+HG组和si-Ndufa4l2+HG组661W细胞上清中乳酸含量分别为(10.470±0.140)mmol·L-1、(7.480±0.270)mmol·L-1和(6.080±0.240)mmol·L-1,si-NC+HG组661W细胞上清中乳酸含量与si-NC组相比减少(P<0.001); si-Ndufa4l2+HG组和si-NC+HG组相比,661W细胞上清中乳酸含量进一步降低(P<0.001),这说明Ndufa4l2表达下降会进一步损害661W细胞的代谢功能。
3 讨论
DR患者在临床上尚无有效的治疗方法,因此,全面了解DR的发生发展机制可以为临床医师防治DR提供依据。线粒体是细胞功能和代谢的场所,也是细胞呼吸发生的细胞器。它的主要作用是产生三磷酸腺苷(ATP),控制细胞代谢和调节细胞凋亡。高糖状态下,ROS在视网膜长期过量产生,氧化作用增强可导致线粒体功能障碍[3]。在DR进展中,线粒体发挥着重要的作用,持续的高血糖会损害视网膜线粒体,表现为线粒体结构、功能和基因组异常。高糖条件下,线粒体细胞膜受损,细胞色素C渗出,膜电位改变[6]。有报道称,糖尿病患者视网膜线粒体mtDNA受损,碱基错配增加,mtDNA转录减少,导致电子传递链系统受损[7]。电子传递链功能失调后可引发自由基的恶性循环[8]。因此,线粒体在DR中扮演了一个重要的角色。然而,线粒体在高血糖环境中受损是一个复杂的过程。
本研究利用GEO数据库,挑选了DR患者视网膜的测序数据。通过差异分析,筛选得到Ndufa4l2,并推测该基因可能在DR的发展中发挥作用。Ndufa4l2是线粒体呼吸链复合物Ⅰ的一个亚基,能调节线粒体呼吸链复合物Ⅰ的活性,从而介导线粒体激活氧化磷酸化和ROS的产生[9],并在多种癌症的代谢中起重要作用。据报道,HIF-1α调控的Ndufa4l2通过抑制ROS生成促进骨肉瘤细胞转移和上皮间充质转化[10]。也有研究表明,Ndufa4l2不仅与乳腺癌的发生发展有关[11],还与胶质母细胞瘤相关[12]。也有研究指出,平滑肌中Ndufa4l2促进缺氧性肺动脉高压血管重构[13]。还有研究报道称,线粒体Ndufa4l2蛋白通过促进心脏干细胞存活调节心脏再生[14]。然而,Ndufa4l2在DR中的作用尚不明确。
本研究首先通过验证测序数据发现,在糖尿病组小鼠视网膜中Ndufa4l2蛋白表达明显低于正常组,表明高血糖对Ndufa4l2表达有一定的影响。此外,体外细胞实验结果显示,高糖环境下,661W感光细胞中的Ndufa4l2 mRNA和蛋白水平表达均有一定程度的下降。这些结果表明,体内高血糖和体外高糖环境均抑制了Ndufa4l2的表达。当661W细胞暴露在高糖环境下时,采用siRNA沉默Ndufa4l2的表达后,661W的细胞活力受到抑制,这表明Ndufa4l2表达降低会进一步损伤细胞活力。此外,ROS检测结果显示,Ndufa4l2表达降低会增加ROS水平。在本研究中,KEGG富集分析发现,Ndufa4l2与氧化磷酸化途径相关。因此,本研究还观察了Ndufa4l2沉默后对661W细胞上清中乳酸水平的影响,结果显示,Ndufa4l2表达水平下降会导致细胞培养上清中乳酸含量减少,乳酸在细胞内堆积会进一步损害细胞的代谢过程。这些结果说明,高糖环境会抑制661W细胞中Ndufa4l2表达,从而影响661W的细胞活力与代谢功能。
综上所述,本研究首次提出Ndufa4l2可能通过视网膜感光细胞的氧化磷酸化过程来抑制其细胞活力,为研究治疗DR的分子机制提供新的思路。

