松果菊苷对高糖诱导的人视网膜毛细血管内皮细胞增殖、迁移及新生血管形成的影响△
毛羽佳 殷 俏 郑琳璐 曾 军
糖尿病视网膜病变(DR)是糖尿病引起的常见的微血管并发症,现为世界范围内致盲的主要原因之一[1]。其中血-视网膜屏障的破坏和视网膜新生血管的增生大大增加了视力丧失的风险[2-4]。玻璃体内注射糖皮质激素和抗血管内皮生长因子(VEGF)药物是目前临床上较为常用的治疗方法,但效果仍差强人意,在相当一部分患者中无效[5]。因此,积极寻求DR的新疗法或新药物对控制DR的进展和降低失明率尤为重要。松果菊苷(ECH)是主要来源于肉苁蓉中的一种具有抗炎、抗氧化和改善微循环等作用的苯乙醇苷类化合物。近来,有研究表明ECH可通过调节肺动脉内皮细胞和血管平滑肌层功能并改善肺动脉重塑从而发挥对肺动脉高压引起的血管病变的保护作用[6];在糖尿病小鼠模型中,使用ECH可改善小鼠肥胖、血脂异常及胰岛素抵抗,并且能减轻小鼠糖尿病性肝损伤[7]、抑制糖尿病小鼠肾纤维化[8]、改善糖尿病小鼠心脏细胞脂质代谢并抑制心脏细胞凋亡[9]。此外,有报道显示ECH对缺氧大鼠肺动脉平滑肌具有抗增殖作用[10]。视网膜新生血管是增生型DR患者视力下降的常见原因,鉴于此,推测ECH对DR引起的视网膜新生血管形成可能具有一定的抑制作用,但相关研究未见报道。因此,本研究采用在体外培养人视网膜毛细血管内皮细胞(HRCECs)并给予高糖(HG)处理模拟糖尿病环境,同时给予ECH干预以观察其对HRCECs的作用并探讨相关机制。
1 材料与方法
1.1 材料HRCECs购自上海子实生物科技有限公司;ECH(纯度: 98%)购自西安天宝生物科技有限公司;1640培养基和2.5 g·L-1胰蛋白酶购自美国Gibco公司;胎牛血清购自美国Invitrogen公司;青霉素和链霉素购自美国Hyclone公司;D-葡萄糖购自生工生物工程(上海)股份有限公司;MTT细胞增殖及细胞毒性检测试剂盒购自上海碧云天生物技术有限公司;Transwell小室和基底膜购自美国BD公司;Ki67抗原(Ki67)和细胞间黏附分子-1(ICAM-1)抗体购自美国CST公司;缺氧诱导因子-1α(HIF-1α)、VEGF和甘油醛-3-磷酸脱氢酶(GAPDH)抗体购自美国Proteintech公司;辣根过氧化酶(HRP)、Alexa Fluor 647和Alexa Fluor 488标记的二抗购自万类生物(上海)科技有限公司;RIPA裂解液、ECL发光底物和Lowry蛋白浓度检测试剂盒购自北京索莱宝科技有限公司。
1.2 方法
1.2.1 细胞培养与分组将HRCECs置于1640培养基(含体积分数10%胎牛血清、100 U·mL-1青霉素和 100 mg·L-1链霉素)中,在 37 ℃、体积分数5%CO2及饱和湿度条件下培养。当细胞融合达到80%时,用2.5 g·L-1胰蛋白酶消化细胞,终止消化后收集细胞,并将HRCECs分为5组:正常对照(Con)组、高糖(HG)组、HG+1 μmol·L-1ECH组、HG+5 μmol·L-1ECH组和HG+25 μmol·L-1ECH组。Con组细胞采用正常培养基培养;HG组细胞采用含25 mmol·L-1D-葡萄糖的培养基培养;HG+1 μmol·L-1ECH组、HG+5 μmol·L-1ECH组和HG+25 μmol·L-1ECH组细胞采用分别含1 μmol·L-1、5 μmol·L-1和25 μmol·L-1ECH的高糖培养基培养。
1.2.2 细胞管腔形成实验96孔板预涂50 μL基底膜,然后在37 ℃下放置30 min固化。将各组HRCECs(每孔50×103个)接种在固化的基质凝胶上,培养48 h。利用显微镜观察并采集图像。使用ImageJ软件-“血管生成分析”工具计算各组细胞管腔结构的长度。
1.2.3 MTT法检测各组细胞活性将各组HRCECs以每孔10×103个的密度接种于96孔培养板中,培养48 h后,向每孔中加入20 μL MTT(5 g·L-1),在37 ℃下孵育4 h。然后添加150 μL二甲基亚砜,并使用Spectras Max Plus微孔板读取器在570 nm处测量每孔的吸光度(D)。相对细胞活性=D观察组/D对照组×100%。
1.2.4 细胞集落形成实验观察各组细胞集落形成能力细胞以每皿100个细胞的密度接种在35 mm的培养皿中,按分组条件进行培养2周,每5 d更换一次培养基。用40 g·L-1多聚甲醛固定15 min,用结晶紫染色10 min,对各组细胞集落进行计数。
1.2.5 免疫荧光染色观察各组细胞中ICAM-1表达将各组HRCECs以每孔10×103个的密度接种于玻片上,培养48 h后,用1 mL免疫染色固定液固定细胞15 min,体积分数5% FBS封闭30 min,分别室温孵育11000稀释比例的Ki67或ICAM-1一级抗体2 h,PBS洗涤4次后,分别室温避光孵育11000稀释比例的Alexa Fluor 647标记山羊抗兔IgG或Alexa Fluor 647标记兔抗小鼠IgG抗体1 h,PBS洗涤4次后,用DAPI染色细胞核,在激光扫描共聚焦显微镜下观察。
1.2.6 Transwell迁移实验观察各组细胞迁移能力用2.5 g·L-1胰蛋白酶消化细胞,终止消化后,1200 r·min-1离心3 min收集各组细胞,加入无血清培养基吹打细胞,制成100×103mL-1单细胞悬液。将100 μL细胞悬液加入24孔transwell板的上室(8 μm孔径聚乙烯膜),下室加入含体积分数20% FBS培养基,37 ℃培养24 h后,用棉签除去上室的聚乙烯膜上表层的细胞,用甲醇固定聚乙烯膜下表层的细胞30 min,用5 g·L-1结晶紫染色。倒置光学显微镜(Olympus,日本)下观察并计数细胞。
1.2.7 Western blot检测各组细胞中HIF-1α、VEGF蛋白表达将各组细胞在含有蛋白酶抑制剂混合物的RIPA裂解液中裂解,并在4 ℃下以15 000 r·min-1离心10 min收集蛋白。用Lowry蛋白浓度检测试剂盒测定各样本中蛋白浓度。将含等量蛋白(30 μg)的每个样品中进行120 g·L-1十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离,并转移到硝酸纤维素膜上。用50 g·L-1BSA封闭膜上蛋白,4 ℃下加HIF-1α(1500)、VEGF(11000)和GAPDH(110 000)一抗孵育过夜,洗涤后,室温孵育HRP标记兔抗小鼠IgG二抗(11000)2 h,再次洗涤后,用ECL发光底物使蛋白显像。用ImageJ软件计算各组细胞中HIF-1α、VEGF蛋白的相对表达水平。
1.3 统计学方法利用SPSS 24.0统计软件进行分析,数据采用均数±标准差表示。多组定量资料的比较采用单因素方差分析。检验水准:α=0.05。
2 结果
2.1 ECH抑制HG诱导的HRCECs新生血管形成能力细胞管腔形成实验结果显示,Con组、HG组、HG+1 μmol·L-1ECH组、HG+5 μmol·L-1ECH组和HG+25 μmol·L-1ECH组细胞相对管状结构总长度分别为(98.46±6.73)%、(212.38±10.62)%、(185.43±7.82)%、(146.51±9.43)%和(129.64±5.72)%;与Con组比较,HG组管状结构增多且管总长度明显增加(P<0.001);与HG组比较,ECH呈剂量依赖性抑制HG诱导的HRCECs管腔形成,管总长度明显缩短(P<0.05、P<0.01、P<0.001)(图1)。
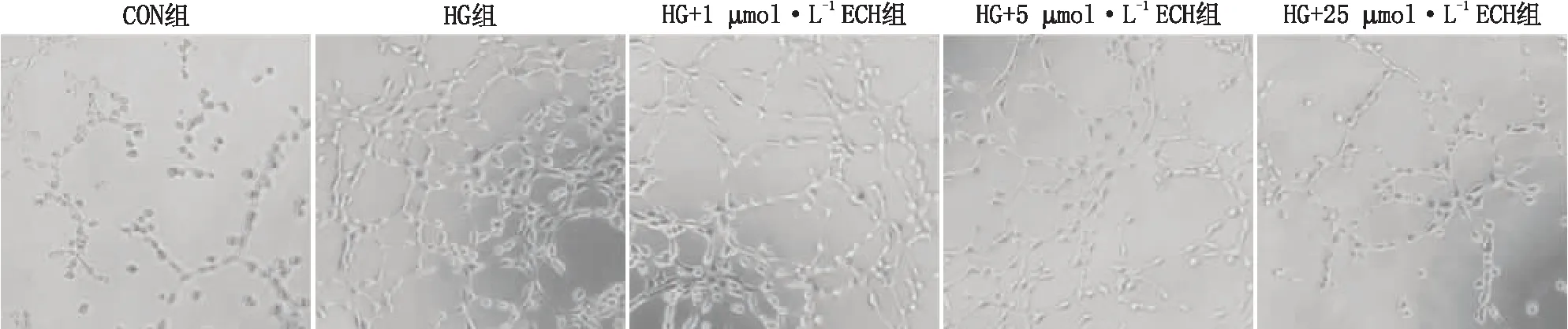
图1 各组HRCECs管腔形成图像(×100)
2.2 ECH抑制HG诱导的HRCECs增殖MTT实验、细胞集落形成实验和Ki67免疫荧光染色实验结果显示,与Con组比较,HG组HRCECs活性、集落数和Ki67阳性细胞比例均明显增加(均为P<0.001);与HG组比较,ECH能显著降低HRCECs活性、集落形成能力和Ki67阳性细胞比例,并呈剂量依赖性(P<0.05、P<0.01、P<0.001)(图2、图3和表1)。
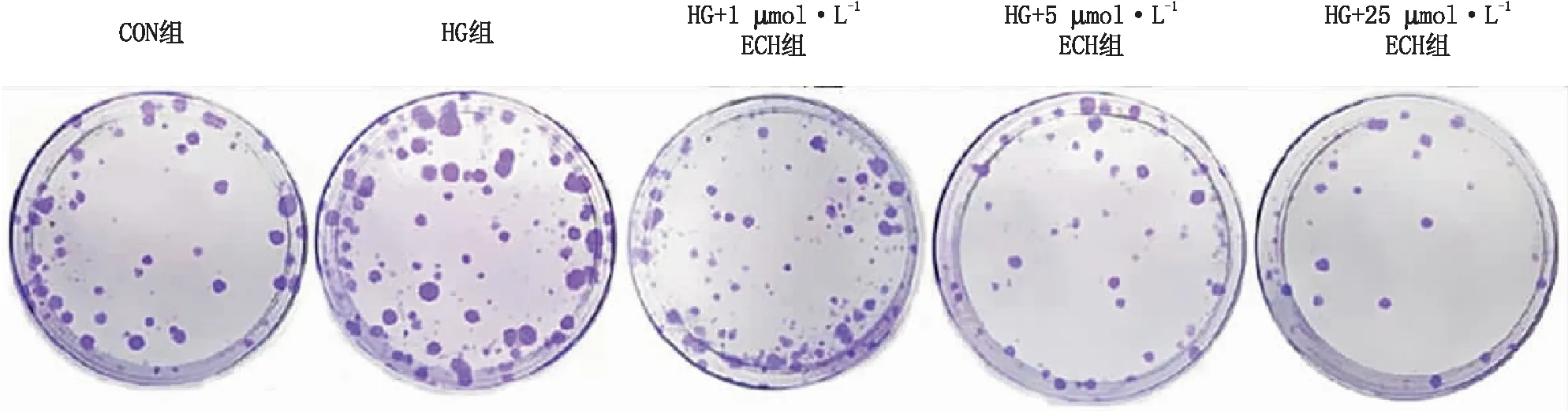
图2 各组HRCECs代表性的细胞集落
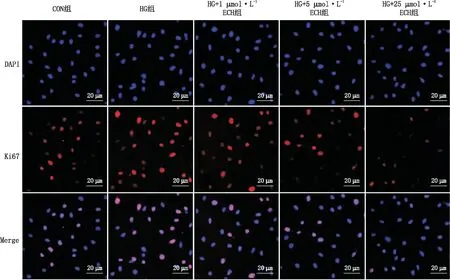
图3 各组HRCECs中Ki67免疫荧光染色图像
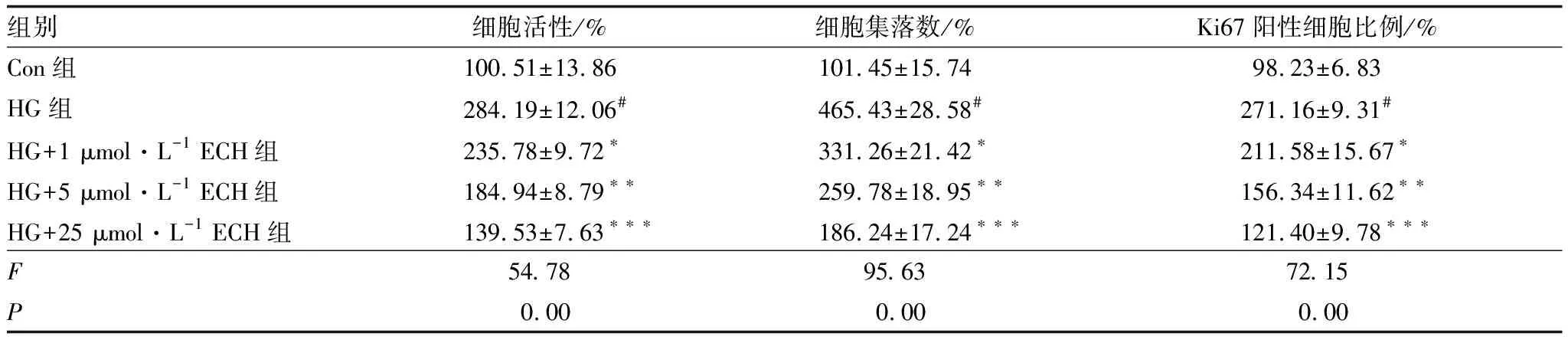
表1 各组HRCECs活性、集落数和Ki67阳性细胞比例
2.3 ECH抑制HG诱导的HRCECs迁移Transwell实验结果显示,Con组、HG组、HG+1 μmol·L-1ECH组、HG+5 μmol·L-1ECH组和HG+25 μmol·L-1ECH组细胞相对迁移率分别为(101.54±28.31)%、(727.96±59.36)%、(546.78±33.54)%、(384.15±39.94)%和(215.53±19.65)%;与Con组比较,HG可促进HRCECs的迁移(P<0.001),而ECH可呈剂量依赖性抑制HG诱导的HRCECs的迁移(均为P<0.05)(图4)。
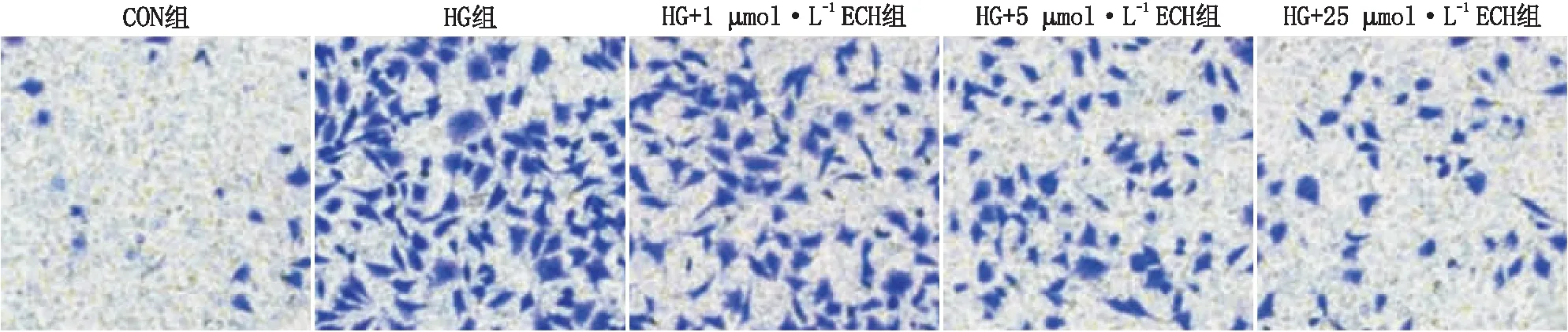
图4 各组HRCECs的迁移实验结果(×200)
2.4 ECH可抑制HIF-1α/VEGF信号通路ICAM-1免疫荧光染色结果(图5)显示,Con组细胞中ICAM-1的荧光强度较低;HG组细胞中ICAM-1的荧光强度较强;HG+1 μmol·L-1ECH组、HG+5 μmol·L-1ECH组和HG+25 μmol·L-1ECH组随着ECH浓度的增加,细胞中ICAM-1荧光强度逐渐减弱。Western blot检测结果显示,与Con组比较,HG组细胞中HIF-1α及VEGF蛋白相对表达水平均明显增加(均为P<0.001);与HG组比较,ECH可呈剂量依赖性逆转这一现象,使HIF-1α和VEGF蛋白相对表达水平均明显降低(P<0.05、P<0.01、P<0.001)(图6和表2)。

图5 各组HRCECs中ICAM-1免疫荧光染色结果
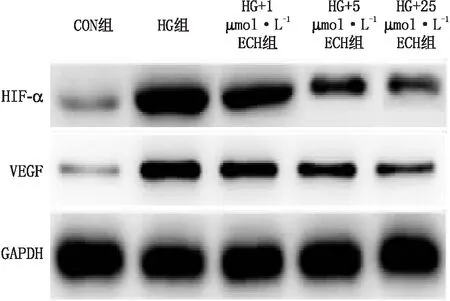
图6 Western blot检测各组HRCECs中HIF-1α和VEGF蛋白的表达
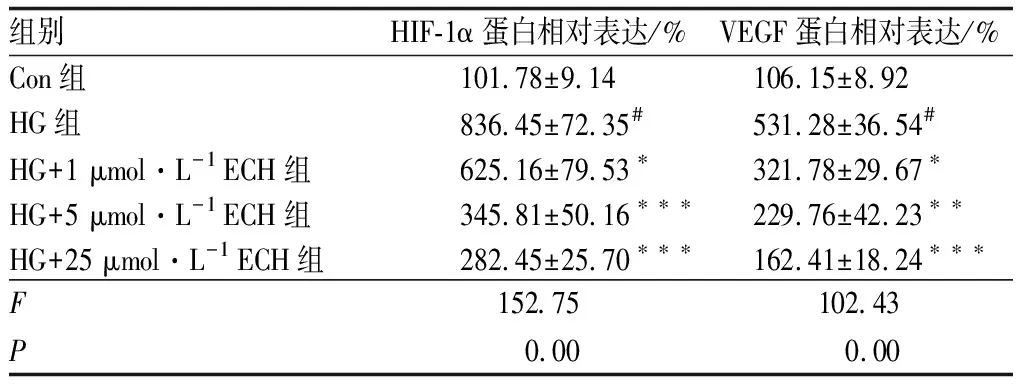
表2 各组HRCECs中HIF-1α和VEGF蛋白的相对表达水平
3 讨论
DR为视网膜细胞长期暴露在高糖环境中导致内皮细胞迁移和增殖、视网膜微血管新生、血管通透性增加和视网膜脱离等一系列眼底病理改变[11-12]。而目前对DR的防治效果尚差强人意,因此探索新的DR防治药物尤为必要。据报道,ECH对糖尿病的多种并发症具有保护作用,如能够改善糖尿病小鼠胰岛素抵抗[7]和糖耐量[13]。而ECH对DR的影响并不清楚。本研究结果表明,ECH以剂量依赖性的方式抑制HG诱导的HRCECs的增殖、迁移和新生血管形成,提示ECH可能是潜在的抗DR药物。
糖尿病引起的高糖环境可导致视网膜供血不足,使视网膜处于相对缺氧状态,视网膜中HIF-1α表达上调[14-15]。HIF-1α作为体内重要的氧含量受体和调节蛋白,在调节新生血管形成、细胞外基质代谢和炎症等过程中发挥着重要作用[16]。VEGF是新生血管形成中最重要的调节因子,也是HIF-1α重要的下游靶点,HG可通过上调HIF-1α/VEGF信号活性诱导视网膜脉络膜内皮细胞的增殖和迁移并促进新生血管的形成,而减弱HIF-1α/VEGF信号活性可抑制HG诱导的上述变化[17]。同时,在DR小鼠模型中,与野生型小鼠相比,HIF-1α敲除小鼠视网膜中VEGF表达降低,血管渗漏和新生血管形成也显著减少[18]。本研究显示,ECH可逆转HG诱导的HRCECs中HIF-1α和VEGF蛋白的高表达。ICAM-1属于黏附分子中免疫球蛋白超家族中的成员,是介导黏附反应的一个重要黏附分子。ICAM-1在正常的血管内皮细胞中呈低表达,而缺氧/HG条件能通过HIF-1α/VEGF信号通路促进内皮细胞和HRCECs中ICAM-1表达上调[19-20]。另外,ICAM-1可通过与血管内皮细胞表面上的特异性受体结合而发挥促进微血管内皮细胞迁移、新生血管形成以及招募炎症细胞的能力[21-22]。本研究结果显示,ECH处理可降低HG诱导的HRCECs中ICAM-1的表达。本研究结果提示,ECH可能通过下调HIF-1α/VEGF相关信号通路,进而抑制HG诱导的HRCECs的增殖、迁移和新生血管形成的作用。
综上所述,ECH具有抑制HG诱导的HRCECs增殖、迁移及新生血管形成的作用,且这些作用可能与其下调HIF-1α/VEGF信号通路相关。另外,本研究还提示,ECH有改善DR的潜在治疗效果,为改善DR提供了新的潜在药物。

