薯蓣皂苷对高糖诱导的视网膜色素上皮细胞损伤的保护作用△
张新霞 王小敏 陆丽红 王保君 狄文玉
薯蓣皂素(Dio)是一种高生物活性的天然甾体皂甙元,已被证明具有抗高血脂、抗炎及抗癌的特性[5-7],且其在糖尿病及并发症(包括糖尿病肾病、糖尿病肝病、糖尿病生殖功能障碍等)中的治疗作用亦有相关报道[8-13]。而Dio对DR疾病的效用以及内在分子调控机制尚未完全清楚。因此,本研究通过HG诱导法构建RPE细胞株(ARPE-19)损伤模型,观察Dio对HG诱导的细胞损伤的影响并探讨可能的分子机制。
1 材料与方法
1.1 主要试剂与仪器ARPE-19细胞购自广州吉妮欧生物科技有限公司。胎牛血清(FBS)、改良Eagle培养基(DMEM)购自美国Gibco公司。细胞计数试剂8(CCK-8)试剂盒购自德国Roche公司。FITC标记膜联蛋白-V/碘化丙啶(Annexin V-FITC/PI)凋亡检测试剂盒及流式细胞仪购自美国BD公司。丙二醛(MDA)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒购自南京建成生物工程研究所。电化学发光(ECL)试剂、JC-1线粒体膜电位检测试剂盒购自上海碧云天公司。RIPA试剂、β-actin抗体、二喹啉甲酸(BCA)蛋白定量检测试剂盒购自武汉博士德公司。B细胞淋巴瘤/白血病-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、半胱氨酸蛋白酶3(Caspase-3)、cleaved Caspase-3、Yes相关蛋白(YAP)抗体和辣根过氧化物酶(HRP)-羊抗兔IgG二抗购自美国Cell Signaling Technology公司。Alexa Fluor 647-羊抗兔IgG荧光二抗购自美国Santa Cruz公司。2’,7’-二氯二氢荧光素二乙酸酯(DCFH-DA)荧光探针、DAPI购自美国Sigma-Aldrich公司。IX83荧光显微镜购自日本Olympus公司。
1.2 方法
1.2.1 细胞培养在含有体积分数为10%FBS、体积分数为1%青链霉素的DMEM培养基中培养ARPE-19细胞,并置于37 ℃、体积分数为5%CO2培养箱进行孵育。培养基每周更新3次。
1.2.2 HG诱导的ARPE-19细胞模型构建与分组处理为探讨Dio对RPE细胞的保护作用机制,本研究首先构建了HG诱导的RPE细胞损伤模型。葡萄糖的浓度筛选:ARPE-19细胞以5×107个·L-1接种于96孔板,分别用递增浓度(5 mmol·L-1、10 mmol·L-1、20 mmol·L-1、30 mmol·L-1和50 mmol·L-1)葡萄糖处理48 h,用CCK-8试剂盒检测各浓度葡萄糖处理的细胞活性,选择最低细胞活性匹配的葡糖糖浓度。
Dio的无细胞毒性剂量范围筛选:ARPE-19细胞以5×107个·L-1接种于96孔板,分别用递增浓度(0 mmol·L-1、0.5 mmol·L-1、2.0 mmol·L-1、8.0 mmol·L-1和16.0 mmol·L-1)Dio处理48 h,用CCK-8试剂盒检测各浓度葡萄糖处理的细胞活性,选择无细胞毒性的Dio剂量范围。
根据CCK-8法筛选葡糖糖浓度和Dio无细胞毒性剂量范围后,将细胞分为对照组[仅给予正常浓度(5 mmol·L-1)葡萄糖处理ARPE-19细胞48 h]、模型组[仅给予50 mmol·L-1葡萄糖处理ARPE-19细胞48 h]和低、中、高剂量Dio处理组[分别用50 mmol·L-1葡萄糖联合0.5 mmol·L-1、2.0 mmol·L-1和8.0 mmol·L-1Dio处理ARPE-19细胞48 h]。
1.2.3 细胞活性检测用CCK-8试剂盒检测不同处理方式处理后ARPE-19细胞活性。待细胞按“1.2.2”方法分组处理后,将CCK-8溶液(每孔10 μL)添加入培养基中,并将细胞再次放置于培养箱中孵育1 h。使用酶标仪在450 nm处测量吸光度。细胞活性=各处理组吸光度/对照组吸光度×100%。
马克思主义与功利主义(实用主义)的论争也即“问题与主义”之争,是在科学社会主义传入中国之后,马克思主义与反马克思主义进行的第一次比较著名的论战,对马克思主义及其公平思想的传播产生了较大影响。
1.2.4 细胞凋亡检测用Annexin V-FITC/PI凋亡试剂盒检测各组ARPE-19细胞凋亡情况。1000 r·min-1离心5 min收集各组ARPE-19细胞后,将细胞重悬于结合缓冲液,每组各取500 μL细胞悬液,加入5 μL Annexin V-FITC和10 μL PI后室温避光孵育15 min,用流式细胞仪分析并检测各组细胞凋亡情况,用FlowJo软件分析细胞凋亡比例。
1.2.5 细胞活性氧水平检测用DCFH-DA荧光探针检测活性氧(ROS)水平。1500 r·min-1离心5 min收集各组ARPE-19细胞后,加入10 μmol·L-1DCFH-DA试剂并在黑暗条件下于37 ℃孵育20 min。PBS洗涤3次后,用流式细胞仪在激发波长和发射波长分别为488 nm和520 nm下检测细胞,并用FlowJo软件分析ROS阳性细胞比例。
1.2.6 氧化应激指标检测1000 r·min-1离心5 min收集各组ARPE-19细胞后,分别按照各检测试剂盒说明,使用MDA、CAT和GSH-Px试剂盒检测各组ARPE-19细胞的MDA水平以及CAT和GSH-Px活性情况。
1.2.7 线粒体膜电位检测用JC-1线粒体膜电位检测试剂盒检测各组ARPE-19细胞内线粒体膜电位变化情况。ARPE-19细胞按照各组分组方法处理后,PBS洗3次;向细胞中加入2 mg·L-1的JC-1染色工作液,37 ℃避光孵育30 min后,PBS洗3次;用荧光显微镜分别在488 nm激发波长和535 nm发射波长下检测JC-1单体(绿色荧光)荧光强度值;在559 nm激发波长和590 nm发射波长下检测JC-1聚集体(红色荧光)荧光强度值。用红绿荧光强度的相对比例来确定线粒体膜电位。
1.2.8 Western blot检测蛋白表达水平用RIPA裂解液萃取各组ARPE-19细胞的蛋白,并各取20 μg蛋白进行Western blot检测。封闭非特异位点后,在4 ℃下孵育一抗(Bcl-2、Bax、Caspase-3均按12000稀释;cleaved Caspase-3、YAP均按11000稀释,β-actin按18000稀释)过夜。TBST洗涤后,室温孵育HRP-羊抗兔IgG二抗1 h。加入ECL试剂后,用化学发光成像分析仪显像,用Quantity One软件定量蛋白的相对表达水平。
用免疫荧光染色法观察YAP蛋白表达情况。将各组ARPE-19细胞固定并封闭后,在4 ℃下孵育YAP一抗(1500稀释)过夜。用PBS漂洗后,室温避光孵育Alexa Fluor 647-羊抗兔IgG二抗1.5 h。加入DAPI后,在荧光显微镜下观察,用ImageJ软件量化荧光强度。

2 结果
2.1 HG诱导的ARPE-19细胞损伤模型建立CCK-8法检测不同浓度葡萄糖处理ARPE-19细胞后的细胞活性,结果显示(图1A),与5 mmol·L-1葡萄糖比较,葡萄糖浓度为30 mmol·L-1和50 mmol·L-1时ARPE-19细胞的细胞活性均明显降低(P<0.05、P<0.001),且在50 mmol·L-1时最为明显,故后续实验选择葡萄糖浓度为50 mmol·L-1。
2.2 Dio对HG诱导的ARPE-19细胞损伤的影响CCK-8法筛选Dio无细胞毒性剂量范围,结果显示(图1B),与0 mmol·L-1Dio比较,Dio浓度为16.0 mmol·L-1时的ARPE-19细胞的细胞活性明显降低(P<0.01);而与0 mmol·L-1Dio比较,0.5 mmol·L-1、2.0 mmol·L-1、8.0 mmol·L-1Dio的细胞活性均无明显改变(均为P>0.05),故后续实验选择Dio浓度为0.5 mmol·L-1、2.0 mmol·L-1、8.0 mmol·L-1。与对照组比较,模型组细胞活性明显降低(P<0.001),细胞凋亡水平明显增加(P<0.001);与模型组比较,低、中、高剂量Dio处理组细胞活性均明显增加,细胞凋亡水平均显著降低,且呈浓度依赖性(均为P<0.05)(表1)。
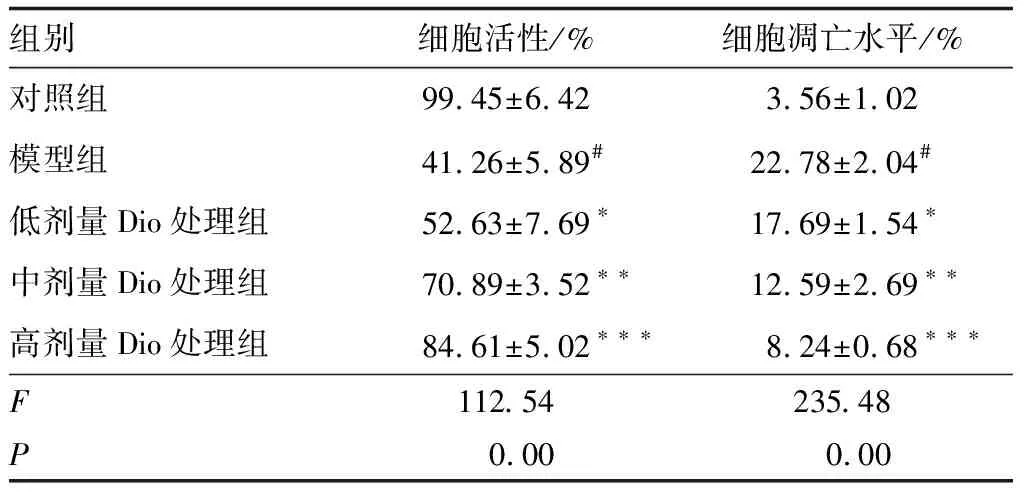
表1 各组细胞活性和细胞凋亡水平的比较 (n=3)
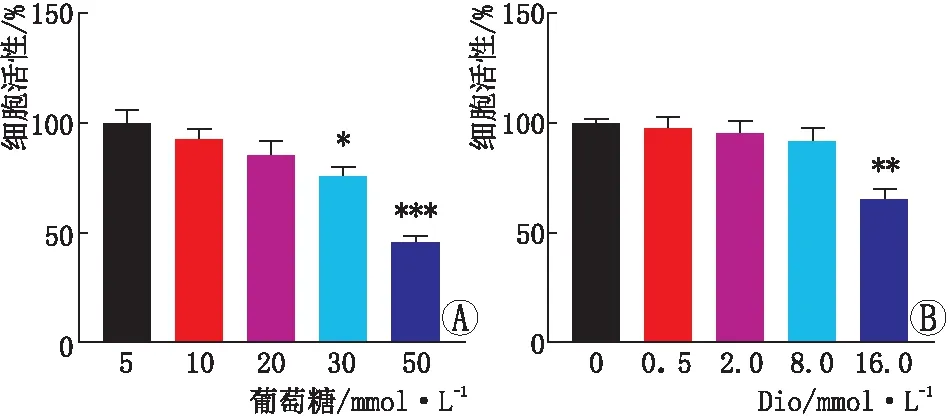
图1 不同浓度葡糖糖(A)和Dio(B)对ARPE-19细胞活性的影响 与5 mmol·L-1葡糖糖比较,*P<0.05,***P<0.001;与0 mmol·L-1Dio比较,**P<0.01。
2.3 Dio对各组ARPE-19细胞的氧化应激水平的影响与对照组比较,模型组细胞ROS和MDA水平均明显升高(均为P<0.001),细胞CAT和GSH-Px活性均明显降低(均为P<0.001);与模型组比较,低、中、高剂量Dio处理组细胞ROS和MDA水平均明显降低,CAT和GSH-Px活性均明显增加,且呈浓度依赖性(均为P<0.05)(表2)。

表2 各组细胞ROS和MDA水平以及CAT和GSH-Px活性比较 (n=3)
2.4 Dio对各组ARPE-19细胞线粒体膜电位的影响JC-1检测结果显示,对照组、模型组以及低、中、高剂量Dio处理组细胞的线粒体膜电位分别为 0.67±0.04、0.05±0.01、0.09±0.01、0.16±0.02和 0.28±0.03;与对照组比较,模型组细胞的线粒体膜电位明显降低(P<0.001);与模型组比较,低、中、高剂量Dio处理组细胞的线粒体膜电位均明显增加,且呈浓度依赖性(均为P<0.05)(图2)。
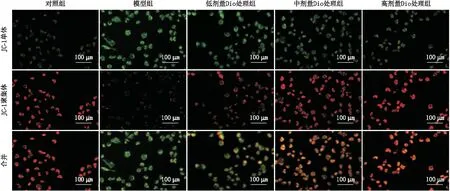
图2 各组细胞代表性JC-1免疫荧光染色图
2.5 Dio对各组ARPE-19细胞中Bcl-2、Bax、cleaved-Caspase-3和YAP蛋白表达的影响Western blot检测结果显示(图3、表3),与对照组比较,模型组细胞中cleaved-Caspase-3蛋白和Bax蛋白表达水平均明显升高(均为P<0.001),细胞中Bcl-2蛋白和YAP蛋白表达水平均明显降低(均为P<0.001);与模型组比较,低、中、高剂量Dio处理组细胞中cleaved Caspase-3蛋白和Bax蛋白表达水平均明显降低,细胞中Bcl-2和YAP蛋白表达水平均明显升高,且呈浓度依赖性(均为P<0.05)。YAP蛋白免疫荧光染色结果显示(图4,表3),对照组细胞中YAP蛋白荧光强度较强;与对照组比较,模型组细胞中YAP蛋白荧光强度明显降低(P<0.001);与模型组比较,低、中、高剂量Dio处理组细胞中YAP蛋白随着Dio浓度增加而逐渐增多,且YAP蛋白荧光强度呈浓度依赖性增强(均为P<0.05)。
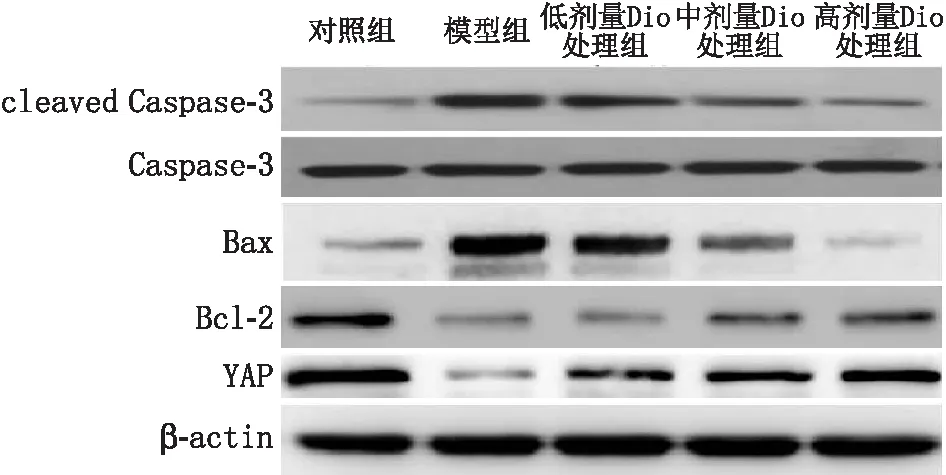
图3 Western blot检测各组细胞中cleaved Caspase-3、Caspase-3、Bax、Bcl-2和YAP蛋白表达情况
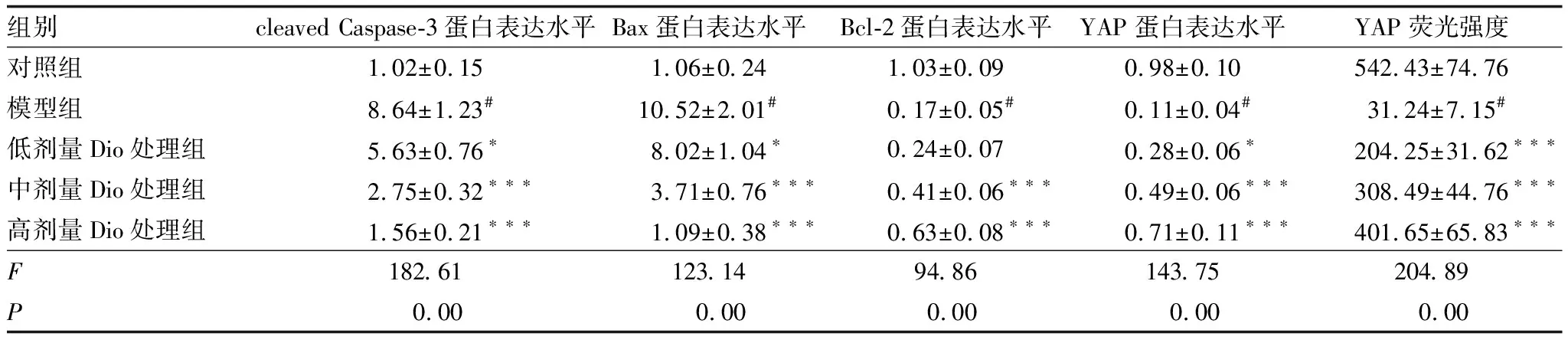
表3 各组细胞中cleaved Caspase-3、Bax、Bcl-2、YAP蛋白表达水平及YAP蛋白荧光强度的比较 (n=3)
3 讨论
糖尿病是一种慢性代谢性疾病,影响了全世界超过4.25亿人口,其中约有1/3的2型糖尿病患者合并有DR[1]。DR还是导致糖尿病患者失明的首要元凶[2],而目前对于DR的防治效果并不令人满意。因此,寻找安全有效的防治DR的药物具有重要的临床意义。在体动物模型中,Dio已被证明具有降糖和改善胰岛素抵抗的药理作用[8-13]。此外,众所周知,DR不仅与葡萄糖代谢异常有关,还与炎症和氧化应激密切相关[4,14]。而目前已有研究报道,Dio具有良好的抗炎和抗氧化作用[5,7]。以上研究提示,Dio可能具有改善DR的作用,但目前相关报道尚少。因此,本研究探讨了Dio是否具有治疗DR的潜力,发现无细胞毒性剂量范围内的Dio能有效缓解HG诱导的RPE细胞活性减弱和凋亡增加,提示Dio是潜在的抗DR药物。
DR患者处于长期高血糖状态,RPE细胞则极易发生活化、抗氧化物酶损伤等病理性改变,诱发氧化应激反应[15]。另外,众多研究[16-17]均已证明,在DR动物模型中给予抗氧化剂可减缓DR进展。本研究同样检测了Dio对HG诱导的RPE细胞氧化应激的影响,结果显示,Dio可逆转HG诱导的RPE细胞ROS和MDA水平增加以及CAT和GSH-Px活性的降低,说明Dio可缓解HG诱导的细胞氧化应激。氧化应激可激活凋亡基因Bax表达,破坏线粒体膜,进而激活线粒体凋亡途径;另一方面,抑制氧化应激可上调线粒体膜上抗凋亡蛋白Bcl-2,并进一步抑制Bax及Caspase蛋白激活,发挥保护线粒体和维持膜稳定性作用[18-19],故维持线粒体膜稳定性在缓解细胞损伤中发挥关键作用。本研究中,我们通过检测线粒体膜电位及cleaved Caspase-3、Bax、Bcl-2蛋白表达情况,发现Dio可抑制HG诱导的RPE细胞线粒体膜电位降低,并降低cleaved Caspase-3、Bax蛋白表达水平和增加Bcl-2蛋白表达水平,说明Dio具有维持线粒体膜稳定性和降低细胞凋亡的作用。
YAP分子是Hippo通路调控细胞存活和增殖的关键下游级联效应分子,可促进细胞增殖,抑制细胞凋亡[20-21]。近期有研究提示[22],在糖尿病肾病细胞和动物模型中敲除Ras同源基因家族成员A(RhoA)可促使凋亡基因Bax升高、Bcl-2和YAP表达降低,而过表达YAP可抑制RhoA敲除诱导的足细胞凋亡。本研究通过检测YAP蛋白表达和免疫荧光染色发现,Dio可上调HG刺激的RPE细胞中YAP蛋白的表达,说明Dio对HG诱导的RPE细胞损伤的保护作用至少部分与上调YAP信号相关。
综上所述,Dio对HG诱导的RPE细胞损伤具有细胞保护作用,且这一作用与激活YAP信号、降低氧化应激、维持线粒体膜电位和抑制线粒体介导的细胞凋亡途径有关。另外,本研究还提示Dio是潜在的抗DR药物。

