二苯乙烯苷通过调节GSK-3β/PP2A活性干预Aβ25-35致拟痴呆大鼠模型Tau蛋白磷酸化进程
刘超宇,蒙婉莹,李彦炳,夏小燕,李振中,朱晓莹,廖艳花,黄忠仕
(1. 右江民族医学院基础医学院,广西 百色 533000;2. 广西中医药大学药学院,广西 南宁 530200;3. 右江民族医学院药学院,广西 百色 533000;4. 右江民族医学院临床医学院,广西 百色 533000)
阿尔茨海默病(Alzheimer’s disease,AD)是一种神经系统退行性疾病,多发于70岁以上人群,具体表现为认知功能障碍,判断力下降,记忆减退,日常生活能力下降等。二苯乙烯苷(2,3,5,4’-tetrahydroxystilbene-2-O-β-D-glycoside,TSG)广泛存在于各类植物和藓类植物中,且为中药何首乌的有效成分[1-2]。二苯乙烯苷有较大的药用价值,其在抗动脉粥样硬化,舒展血管,保护血管内皮细胞,减缓细胞衰老损伤,改善认知功能障碍有一定的作用[3-4]。本课题组前期研究发现,TSG通过抑制Tau蛋白过度磷酸化过程,保护受损的神经细胞,从而改善APP/PS1/Tau三转基因痴呆小鼠的学习记忆能力[5]。但具体的作用机制目前尚未清楚。因此,本实验以Aβ25-35致拟痴呆大鼠模型为研究对象,探讨TSG通过调节GSK-3β、PP2A和PKA的表达干预Tau蛋白磷酸化的机制。
1 材料与方法
1.1 动物 SPF级雄性SD大鼠50只,24月龄,体质量(680~720) g,从长沙市天勤生物技术有限公司购入,合格证号SCXK(湘)2019-0014。饲养于右江民族医学院SPF级动物实验室。本实验由右江民族医学院实验动物伦理审查委员会批准开展,批准号:2020101501。
1.2 药物与试剂 二苯乙烯苷(成都克洛玛生物科技有限公司,批号:CHB180810);Aβ25-35(美国SIGMA公司,批号:118M4892V);BCA蛋白浓度测定试剂盒(碧云天生物技术公司,批号:070618181227);TRIZOL(美国ThermoScientific公司,批号:257401);极敏化学发光试剂(江苏亲科生物研究中心有限公司,批号:1927b02);10%聚丙烯酰胺凝胶快速制备试剂盒(上海雅酶生物技术有限公司,批号:03512300);12.5%聚丙烯酰胺凝胶快速制备试剂盒(上海雅酶生物技术有限公司,批号:03513300);山羊抗兔免疫球蛋白G(IgG)二抗(美国ProteintechGroup公司,批号:20000174);兔抗鼠β-actin多克隆抗体(美国Invitrogen公司,批号:UD277186);100×蛋白酶抑制剂(北京索莱宝科技有限公司,批号:20200724);兔抗鼠Tau多克隆抗体(江苏亲科生物研究中心有限公司,批号:18s9967);兔抗鼠PP2A多克隆抗体(江苏亲科生物研究中心有限公司,批号:72u4146);兔抗鼠PKA多克隆抗体(江苏亲科生物研究中心有限公司,批号:15j0929);兔抗鼠GSK-3β多克隆抗体(美国 Thermo Scientific公司,批号:WE3287929C)。
1.3 仪器 ZH-蓝星B/S型大小鼠脑立体定位仪(安徽正华生物仪器设备有限公司);ZH-KES型微量注射泵(安徽正华生物仪器设备有限公司);SpactraMax i3x型多功能酶标仪(美国Molecular Devices);Neofuge15R型高速冷冻离心机;Tanon-5200 multi型全自动化学发光图像分析仪;LightCycler96型实时荧光定量聚合酶链式反应系统(罗氏);PAT-8R被动逃避黑白箱(成都泰盟软件有限公司);CM1650 型冷冻切片机(德国徕卡公司);D1MI-3000B型荧光倒置显微镜(徕卡上海贸易有限公司)。
1.4 动物筛选、分组、造模及给药 采用Morris水迷宫定位航行实验对50只24月龄老年雄性SD大鼠逃避潜伏期进行测试,以青年大鼠逃避潜伏期为参照,剔除天生痴呆大鼠后,筛选出36只,随机分为正常组、假手术组、模型组、TSG低剂量组、TSG中剂量组和TSG高剂量组,每组6只。SD大鼠称重,盐酸二甲苯噻嗪(8 mg/kg)腹腔注射麻醉后,将其固定于脑立体定位仪。75%乙醇消毒大鼠头顶部,使用手术刀片将顶部纵向切开,剥开皮下筋膜暴露顶骨。将大鼠前卤定为原点,按大鼠脑立体定位图谱选择海马区域(前囟后3.5 mm,中线外侧2.0 mm)使用牙科钻在两侧钻出小孔,微量进样器垂直进入2.7 mm。将在37 ℃孵育1周的质量浓度为5 μg/μl的Aβ25-35溶液以0.2 μl/min的速度缓慢注入两侧脑室,注入体积1 μl,注射完成后留针5 min,避免拔针时药物溢出。手术后缝合头部皮肤,7 d内每日给予肌注青霉素G 10万单位预防感染。经Aβ25-35海马区造模14 d后开始灌胃给药,正常组、假手术组、模型组(生理盐水,30 ml/kg),TSG低、中、高剂量组(给药剂量分别为0.033 g/kg,0.1 g/kg,0.3 g/kg),每组每日灌胃给药1次,连续4周。
1.5 大鼠避暗箱行为学测试 给予给药干预4周后,对实验大鼠进行避暗箱测试。避暗箱又名被动回避实验,主要用于测试实验动物的短期记忆。首先,将实验大鼠放入箱体,让其适应环境10 min后,将大鼠放置于明室,记录大鼠由明室进入暗室的时间为潜伏期,进入暗室受到电击的次数为错误次数。24 h后再次进行实验,记录每只大鼠的潜伏期和5 min内的错误次数。
1.6 免疫荧光法(IF)检测大鼠脑组织中海马区和脑皮层GSK-3β蛋白的表达 行为学测试结束后,每组取3只大鼠,盐酸二甲苯噻嗪(8 mg/kg)腹腔注射麻醉后,置于冰上剖取出脑组织,冷冻包埋剂包埋后,置于液氮中快速固定,固定好的组织块,切片6 μm;将切片置入-20 ℃的甲醇中固定10 min后,PBS浸洗5 min×3次;1%BSA封闭40 min,PBS浸洗5 min×2次;加入GSK-3β抗体(稀释比例1∶1000),于4 ℃孵育过夜后,PBS浸洗5 min×2次;加入带有荧光标记的二抗和DAPI荧光染剂的混合液,室温孵育1 h,PBS浸洗5 min×2次;组织上滴加荧光猝灭剂,封片。于荧光倒置显微镜下观察海马CA1区蛋白表达情况,拍照;使用Image J软件测定目的蛋白及DIPA的光密度值,将目的蛋白与DIPA光密度值的比值作为平均光密度值。
1.7 实时荧光定量聚合酶链式反应法(qRT-PCR)检测大鼠脑组织中PP2A,PKA,GSK-3β mRNA的表达 使用骨科钳暴露脑组织,迅速取出脑组织,按Trizol试剂盒说明进行操作,提取大鼠脑组织内总RNA,使用微量紫外分光光度计检测RNA浓度、纯度。OD260/OD280比值在1.8~2.1范围内的RNA样本可进入逆转录实验。按cDNA逆转录试剂盒操作将总RNA逆转录cDNA。引物序列合成由武汉金开瑞生物工程有限公司完成,以GAPDH为内参,2-ΔΔCt法计算各目的mRNA的相对表达量。引物序列见表1。

表1 PCR引物序列
1.8 蛋白免疫印迹法(Western blot)检测脑组织PP2A、PKA、Tau蛋白的表达 将大鼠脑组织按比例加入配制好的蛋白裂解液置冰上裂解30 min;裂解完成后,高速冷冻离心机12 000 r/min,4 ℃,5 min,收集管内上清液;按BCA蛋白浓度测定试剂盒说明书测定总蛋白浓度,加入4×蛋白上样缓冲液稀释后,置100 ℃水浴变性10 min。对变性好的总蛋白进行凝胶电泳,SDS-PAGE凝胶电泳80 V,30 min;再120 V,60 min。转膜条件为300 mA,60 min,25 ℃。使用快速封闭液摇床室温封闭15 min。将相应NC膜分别置于PP2A、PKA、Tau(1∶1500)中4 ℃摇床孵育过夜。一抗孵育16 h后取出NC膜,置于TBST缓冲液中冲洗3次,每次5 min。二抗(1∶6000)孵育室温孵育2 h,置于TBST缓冲液中冲洗3次,每次5 min。显影按照ECL说明书进行操作;应用自动化学发光图像分析仪分析及进行条带密度扫描,将Tau、PKA、PP2A条带灰度值与内参条带灰度值的比值作为目的蛋白相对表达水平。

2 结果
2.1 TSG对大鼠学习记忆能力的影响 在大鼠避暗箱实验数据中可以观察到,与正常组比较,假手术组大鼠的潜伏期及错误次数与正常组相近;模型组大鼠的潜伏期显著低于正常组(P<0.01),错误次数显著高于正常组(P<0.01);TSG各剂量组潜伏期及错误次数与正常组无明显差异。与假手术组比较,模型组大鼠的潜伏期显著低于假手术组(P<0.01),错误次数显著高于假手术组(P<0.01);TSG各剂量组潜伏期及错误次数与假手术组均无明显差异。与模型组比较,TSG各剂量组大鼠潜伏期均有明显延长(P<0.05或P<0.01),错误次数均出现明显减少(P<0.01)。见表2。
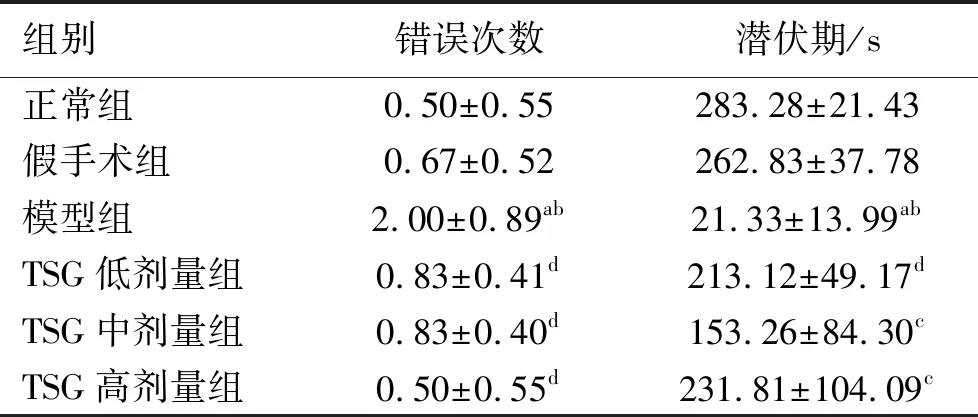
表2 各组大鼠错误次数、潜伏期对比
2.2 TSG对大鼠脑组织中海马区和皮层区GSK-3β蛋白表达的影响 与正常组比较,假手术组大鼠海马区和皮层区GSK-3β蛋白表达量无明显变化;模型组大鼠海马区和皮层区GSK-3β蛋白表达量显著增加(P<0.01);TSG各剂量组大鼠海马区和皮层区GSK-3β蛋白表达量均无明显变化。与假手术组比较,模型组大鼠海马区和皮层区GSK-3β蛋白表达量显著增加(P<0.05或P<0.01),TSG各剂量组大鼠海马区和皮层区GSK-3β蛋白表达量均无明显变化。与模型组比较,TSG中剂量组大鼠皮层区GSK-3β蛋白表达量显著降低(P<0.05);TSG中剂量组及高剂量组大鼠海马区GSK-3β蛋白表达量显著降低(P<0.01)。见表3、图1、图2。
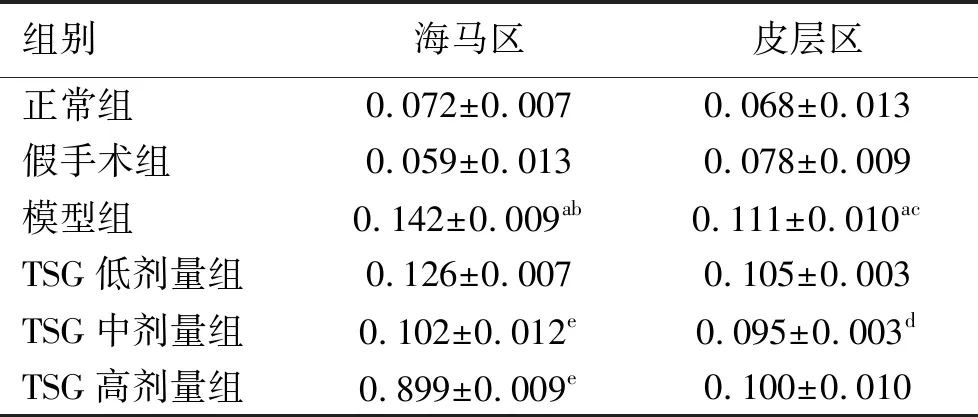
表3 各组大鼠海马区、皮层区的GSK-3β蛋白表达对比
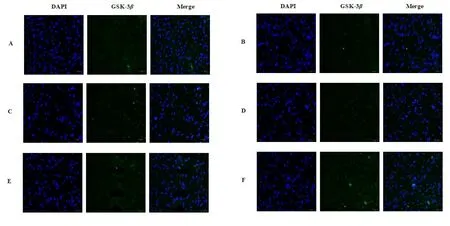
注:A.正常组;B.假手术组;C.模型组;D.TSG低剂量组;E.TSG中剂量组;F.TSG高剂量。
2.3 TSG对大鼠脑组织中PP2A、GSK-3β、PKA mRNA表达量的影响 与正常组比较,假手术组大鼠脑组织中PP2A、GSK-3β、PKA mRNA表达量无明显变化;模型组大鼠脑组织中PKA、GSK-3β mRNA表达量明显升高(P<0.05),PP2A mRNA表达量明显降低(P<0.05);TSG各剂量组大鼠脑组织中PP2A、GSK-3β、PKA mRNA表达量无明显变化。与假手术组比较,模型组大鼠脑组织中PKA、GSK-3β mRNA表达量明显升高(P<0.05),PP2A mRNA表达量明显降低(P<0.05);TSG各剂量组大鼠脑组织中PP2A、GSK-3β、PKA mRNA表达量无明显变化。与模型组比较,TSG各剂量组大鼠脑组织中GSK-3β、PKA mRNA表达量明显下降(P<0.05),TSG各剂量组大鼠脑组织中PP2A mRNA表达量均出现明显升高(P<0.05)。见图3。
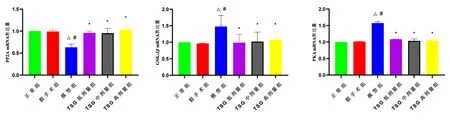
注:与正常组比较,△P<0.05;与假手术组比较,#P<0.05;与模型组比较,*P<0.05。正常组各指标mRNA表达量均为1。
2.4 TSG对大鼠脑组织中PP2A、PKA、Tau蛋白表达的影响 与正常组比较,假手术组大鼠脑组织中PP2A、PKA、Tau蛋白表达量无明显改变;模型组大鼠脑组织中PP2A蛋白表达量显著下降(P<0.01),PKA蛋白及Tau蛋白表达量显著升高(P<0.05);TSG各剂量组大鼠脑组织中PP2A、PKA、Tau蛋白表达量均无明显改变。与假手术组比较,模型组大鼠脑组织中PP2A蛋白表达量显著下降(P<0.01),PKA蛋白及Tau蛋白表达量显著升高(P<0.05或P<0.01);TSG各剂量组大鼠脑组织中PP2A、PKA、Tau蛋白表达量均无明显改变。与模型组比较,TSG各剂量组大鼠脑组织中PP2A蛋白表达量均出现显著升高(P<0.05或P<0.01);TSG中剂量组和高剂量大鼠脑组织中PKA蛋白表达量均出现显著升高(P<0.05),TSG各剂量组大鼠脑组织中Tau蛋白表达量均出现显著降低(P<0.05或P<0.01)。见表4、图4。
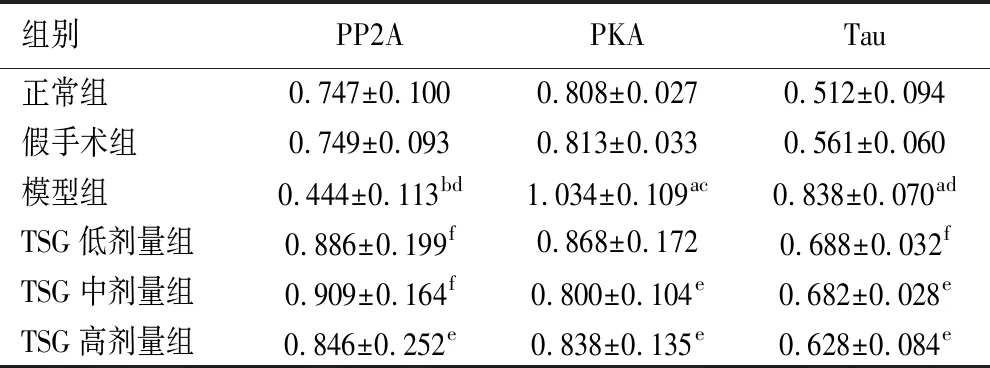
表4 各组大鼠PP2A、PKA、Tau蛋白表达对比
3 讨论
Tau蛋白过度磷酸化学说是目前阿尔茨海默症发生的重要学说之一。Tau蛋白是一种微管相关蛋白,主要与微管结合,使微管结构稳定,减少微管蛋白分子的解离。在痴呆模型及AD患者的脑内,可以观察到过度磷酸化的Tau蛋白相互缠绕形成神经元纤维缠结(NFTs)的现象,被磷酸化的Tau蛋白与微管结合的能力只有正常状态下的1/10,导致微管结构不稳定,大量神经元微管结构受到破坏,引起神经细胞凋亡、突触丢失、神经系统退行性改变[6]。目前研究较多的Tau蛋白激酶有糖原合成酶激酶 3β(GSK-3β)、周期蛋白依赖性激酶 5(CDK5)和环磷酸腺苷依赖的蛋白激酶(PKA),它们催化Tau蛋白磷酸化过程,加重神经系统的炎症反应,增加Aβ蛋白的生成,还会使患者脑内乙酰胆碱的合成下降,导致严重的神经损害[7]。另有研究表明,调节PP2A活性抑制Tau蛋白的过度磷酸化也可能是治疗AD的有效策略[8]。本实验旨在探讨TSG调节GSK-3β、PP2A、PKA等相关因子干预Tau蛋白磷酸化的作用机制。
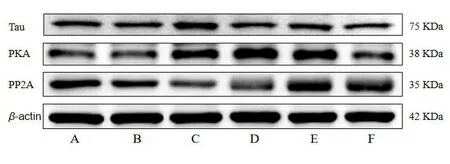
注:A.正常组;B.假手术组;C.模型组;D.TSG低剂量组;E.TSG中剂量组;F.TSG高剂量组。
在正常的生理状态下,Tau蛋白在蛋白激酶和蛋白磷酸酶的共同调节下处于磷酸化与去磷酸化的动态平衡状态,而AD患者中非正常Tau蛋白则打乱了这种平衡,主要表现为Tau蛋白和P-tau蛋白的增多[9-13]。本实验通过蛋白质免疫印迹法对Tau蛋白进行定量分析。从结果中发现,模型组中Tau蛋白相对表达量明显高于正常组,指示Tau蛋白和P-tau蛋白的相对平衡状态被打破,Tau蛋白在AD大鼠脑组织中出现过度磷酸化;TSG各剂量组Tau蛋白相对表达量均明显低于模型组,指示TSG可以降低Tau蛋白水平,抑制Tau蛋白过度磷酸化进程。
有研究表明[14],Tau蛋白的过度磷酸化过程是由多种激酶联合作用的结果,Tau 蛋白被一种激酶预磷酸化后可以促进或抑制其他激酶的进一步磷酸化作用。蛋白激酶在催化磷酸化反应时在不同的序列下催化特点各不相同,根据其这一特点将蛋白磷酸酶分为以下两大类:脯氨酸依赖性蛋白激酶;非脯氨酸依赖性蛋白激酶,环磷酸腺苷依赖的蛋白激酶(PKA)作为非脯氨酸依赖性蛋白激酶家族中一个具有代表性的激酶,其对Tau蛋白异常磷酸化的预磷酸化作用受到广泛关注[15]。本实验通过实时荧光定量聚合酶链式反应法和蛋白质免疫印迹法对PKA进行定性定量分析。结果表明,模型组中PKA的mRNA及蛋白质相对表达量明显高于正常组,指示PKA的激活在Tau的异常磷酸化进程中发挥促进作用;TSG各剂量组PKA的mRNA相对表达量均明显低于模型组;TSG中剂量组及高剂量组PKA蛋白相对表达量均明显低于模型组,指示TSG通过下调PKA的表达抑制了Tau蛋白过度磷酸化进程。
同为非脯氨酸依赖性蛋白激酶的糖原合成酶激酶 3β(GSK-3β)是AD的核心因素,它的功能紊乱与Tau蛋白的过度磷酸化有着密切联系,可以引起散发与家族性AD的多种病理标志物的形成[16-18]。研究显示,PKA与GSK-3β之间相互影响,经过PKA预磷酸化后的Tau蛋白,更易于被 GSK-3β磷酸化,这也是引起Tau蛋白处于过度磷酸化状态的原因之一[19-20]。本实验通过实时荧光定量聚合酶链式反应法和免疫荧光法对GSK-3β进行定性定量分析,结果表明模型组中GSK-3β的mRNA及蛋白质相对表达量明显高于正常组,TSG中剂量组及高剂量组中GSK-3β的mRNA及蛋白质相对表达量均明显低于模型组。从结果推测GSK-3β的上调推动了Tau蛋白过度磷酸化进程,进而诱发AD;TSG可以在一定程度上抑制GSK-3β的高表达,缓解Tau蛋白过度磷酸化进程。
蛋白磷酸酯酶-2A(PP2A)是一种去磷酸化的关键蛋白质磷酸酶,广泛表达于不同的组织和细胞中,其活性在AD患者的大脑中明显减少,PP2A的失活会导致多种蛋白的异常高磷酸化[21]。Tau蛋白的脱磷也受PP2A的监管,高活性的PP2A可以抑制Tau蛋白磷酸化的增加[22]。因此,重新激活AD中的PP2A在抗AD治疗中具有重大意义[23]。本实验通过实时荧光定量聚合酶链式反应法和蛋白质免疫印迹法对PP2A进行定性定量分析。结果表明,经TSG治疗后TSG各剂量组中PP2A较模型组均出现明显上调,提示TSG可以重新激活AD脑中PP2A的活性,抑制Tau过度磷酸化进程,发挥抗AD的作用。
综上所述,TSG对Aβ25-35致拟痴呆大鼠模型脑组织中的GSK-3β/PP2A具有调节作用,其机制可能是从两方面进行:一方面抑制PKA的活性,干预Tau蛋白的预磷酸化过程,使Tau蛋白处于不易过磷酸化的状态;同时,另一方面抑制GSK-3β的活性,激活PP2A的活性,最后阻碍Tau蛋白磷酸化进程,从而改善AD症状。但是,该机制所涉及的调控因子还不全面,各因子的作用位点尚未清楚,仍需进行更加深入的研究。

