血塞通注射液通过HIF-1α-VEGF通路调控NSCs的增殖和分化
林超群,李维纳,邱波,范学政
[1. 中国科学院大学深圳医院(光明)神经外科,广东 深圳 518106;2. 广西柳州爱尔眼科医院白内障与青光眼科,广西 柳州 545005]
随着老年化席卷全球,脑卒中在全球发病率进一步上升,其中缺血性脑卒中占其发病率的70%,且致死率极高,即使病后生存,其致残率也居高不下[1]。在20世纪90年代,各国科学家开始了神经干细胞(NSCs)的深入研究[2],研究表明[3]脑缺氧往往会导致NSCs的增殖能力和分化能力受到抑制,甚至发生凋亡,而且NSCs对缺氧比其他类型的细胞[4]更敏感,缺氧后NSCs可能发生延迟死亡[5]。在缺血性脑卒中动物模型中,内源性NSCs能促进大鼠神经功能的恢复,在缺血性脑卒中修复的机制中发挥着至关重要的作用[6]。星形胶质细胞可以分泌多种可溶性因子,能和NSCs发生一系列的神经网络功能,因此,星形胶质细胞在缺血缺氧性中枢神经系统疾病中的作用也不可忽视[7]。如果我们能找到一种药物,能促进NSCs分化为星形胶质细胞、少突胶质细胞、神经元,并且可以在缺氧环境下保护NSCs,避免NSCs的增殖能力和分化能力受到抑制,这种药物可能对缺血性脑卒中至关重要。
国内外使用中医中药治疗缺血性脑卒中成为了21世纪研究的新热点[8]。国内学者发现血塞通胶囊可明显增加梗死区脑组织神经干细胞的增殖能力及分化能力[9],但血塞通注射液对神经干细胞增殖能力及分化能力的影响少见报道。缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)为缺氧环境中非常重要的转录调节因子,对NSCs增殖、分化发挥着关键作用[10-11]。实验证明,在缺氧环境中,NSCs的增殖和分化与HIF-1的表达呈正相关[12]。HIF-1分为HIF-1α和HIF-1β两个亚基,HIF-1的活性主要由HIF-1α决定[13]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种能促进颅内新生血管形成的细胞因子,在缺氧环境中受到HIF-1的调控[14]。本文建立缺氧NSCs模型及无缺氧NSCs模型[15],拟探讨在缺氧环境中,血塞通注射液与星形胶质细胞等多种细胞的相互关系,并且研究血塞通注射液通过调控HIF-1α-VEGF通路促进NSCs增殖能力及分化能力,为进一步阐述血塞通注射液治疗缺血性脑卒中的机制奠定理论基础。
1 材料与方法
1.1 原代NSCs的提取培养(胎鼠海马来源) 雌性SD大鼠(8周龄,体重240~280 g)购于北京维通利华实验动物有限公司,动物实验根据国家《实验动物管理条例》、《广东省实验动物管理办法》以及中国科学院大学深圳医院实验动物中心规章制度执行,本动物实验经中国科学院大学深圳医院伦理委员会批准后进行。使用颈部脱臼的方法结束孕14 d SD大鼠的生命,在无菌操作台,0 ℃环境中腹部解剖实验大鼠,取出胎鼠,分离出胎鼠的大脑,显微镜下解剖出胎鼠海马组织,显微剪均匀剪碎海马组织,用0.25%的胰酶(美国Gibco公司)消化5 min,10%胎牛血清(北京索莱宝科技有限公司)终止消化,800 r/min、离心半径9.5 cm离心5 min,弃上清,加入NSCs完全培养(DMEM/F12+2%B27+20 ng/ml EGF+20 ng/ml bFGF+1%双抗)(DMEM/F12培养基、B27细胞补充添加剂、双抗均为美国Gibco公司;EGF、bFGF均为美国PeproTech公司)后,仔细吹打均匀重悬,过400目细胞筛网,细胞计数后,接种于细胞培养瓶中,把细胞密度调整为5×105/ml。在温度37 ℃,二氧化碳浓度为5%的恒温培养箱(美国Thermo公司)中培养,3 d换液,7 d传代,每天在显微镜下观察NSCs的状态,取第2代悬浮神经干细胞球进行下一步实验。
1.2 NSCs免疫荧光鉴定 使用浓度为100 μg/ml的多聚赖氨酸预先包被24孔板爬片,PBS 轻柔冲洗3次,取吹打均匀的第2代悬浮神经干细胞200 μl 悬于24孔板爬片上,放入恒温培养箱中继续培养2 h,细胞贴壁后,4%多聚甲醛固定30 min,PBS 轻柔冲洗3次;加入0.3%Triton X-100(美国Amresco公司)通透30 min,PBS轻柔冲洗3次;加入10%驴血清(美国Jackson 公司)37 ℃封闭1 h,不洗,加入一抗(小鼠抗兔多克隆抗体Nestin,美国Abcam公司),4 ℃孵育过夜;PBS轻柔冲洗3次;在避光环境下加入同源荧光二抗(ab150125,美国Abcam公司)室温孵育1 h,PBS轻柔冲洗3次;DAPI(北京雷根生物技术有限公司染核),PBS轻柔冲洗3次,取出爬片后置于防脱载玻片上(预先滴加抗荧光淬灭剂),封片,使用倒置荧光显微镜(日本Nikon 公司)观察染色结果。
1.3 细胞增殖/抑制CCK8 实验CCK8试剂盒购自南京凯基生物科技发展有限公司,用Accutase分离液(美国Sigma-Aldrich公司)消化第2代悬浮神经干细胞球,消化充分后细胞球消失,形成多个悬浮单细胞,调整细胞浓度,以1×104个/孔的细胞密度种于96孔板中,分组加入不同浓度血塞通注射液(分别为0 g/L、0.25 g/L、0.5 g/L、0.75 g/L、1 g/L、1.25 g/L;湖北清大康迪药业有限公司),培养3 d后,每孔加入10 μl CCK8试剂,37 ℃环境下孵育2 h,使用酶标仪检测450 nm波长各孔的吸光度值,记录数据并统计。建立缺氧NSCs模型及无缺氧模型,缺氧模型为37 ℃,5%空气,90%N2,5%CO2的细胞培养环境。无缺氧模型为37 ℃,5%CO2,95%空气的细胞培养环境。将NSCs分为无缺氧组、无缺氧联合血塞通注射液组、缺氧组、缺氧联合血塞通注射液组。4组不同细胞分别接种于96孔板,无缺氧组和无缺氧联合血塞通注射液组细胞在无缺氧环境中培养24 h。缺氧组和缺氧联合血塞通注射液组细胞在缺氧环境中培养24 h,然后每孔加入10 μl CCK8 试剂,37 ℃环境下孵育2 h,使用酶标仪检测450 nm波长各孔的吸光度值,记录数据并统计。
1.4 NSCs诱导分化及免疫荧光实验 为了研究缺氧状态下血塞通注射液对NSCs分化能力的影响,使用干细胞诱导分化培养基(含2%FBS 的DMEM培养基)对NSCs进行培养,培养3 d后进行细胞免疫荧光实验。实验分为对照组及血塞通注射液给药组,其中药物浓度为1 g/L。两组细胞在缺氧环境中培养1 d,然后在无缺氧患者中继续培养2 d。GFAP标记星形胶质细胞,Tuj-1标记神经元,MBP标记少突胶质细胞。细胞培养3 d后,4%多聚甲醛固定30 min,PBS轻柔冲洗3次;加入0.3%曲拉通Triton X-100通透30 min,PBS 轻柔冲洗3次;加入10%驴血清37 ℃封闭1 h,不洗,分别加入一抗(兔抗羊多克隆抗体GFAP、小鼠抗兔多克隆抗体Tuj1、羊抗兔多克隆抗体MBP;美国Abcam公司),4度孵育过夜;PBS轻柔冲洗3次;在避光环境下加入同源荧光二抗(ab150079、ab150181,美国Abcam公司)室温孵育1 h,PBS轻柔冲洗3次;DAPI染核,PBS轻柔冲洗3次,取出爬片后置于防脱载玻片上(预先滴加抗荧光淬灭剂),封片,使用荧光显微镜观察染色结果。
1.5 Western blot实验 检测实验中Nestin、Tuj1、GFAP、MBP、HIF-1α蛋白的表达。分别收集各实验细胞后,提取相应实验的细胞总蛋白(使用RAPI裂解),通过BCA法检测蛋白浓度,并且调整浓度使各组一致,加入5×SDS-PAGE蛋白上样缓冲液,95 ℃煮样5~10 min。配制10%分离胶和5%浓缩胶,待胶凝固后准备加样电泳;每孔上样量20 μg,蛋白电泳条件为120 V 90 min;准备与电泳凝胶合适大小的PVDF膜,用甲醇浸泡20 s使膜激活,准备转膜,转膜夹两面各放置1块海绵和3块滤纸,凝胶和膜的放置顺序为转膜夹黑面-凝胶-PVDF 膜-白面,转膜条件为300 mA 90 min;转膜结束后,不洗,用含5%脱脂牛奶的TBST封闭液摇床上室温封闭1 h;膜不洗,根据预染蛋白marker分子量大小分别裁剪不同位置的分子量抗体,孵一抗Nestin(1∶1 000)、Tuj1(1∶1 000)、GFAP(1∶1 000)、MBP(1∶1 000)、HIF-1α(1∶500),内参为GAPDH(1∶2 000),4 ℃过夜;第2天一抗室温摇床30 min,TBST洗膜3次,每次10 min,室温摇床孵育相应山羊抗小鼠标记二抗(1∶5 000)1 h,TBST再洗3次,每次10 min, 用ECL显色及化学发光成像仪进行曝光,保存图片数据并分析。
1.6 qRT-PCR实验 收集对照组及血塞通注射液给药组细胞后,使用Trizol法提取RNA。按照试剂盒说明书中的步骤提取RNA。分光光度法测定RNA浓度和纯度。然后按试剂盒说明书合成逆转20 μl cDNA。其样本cDNA稀释10倍为SYBR Green实时定量PCR反应的最佳模板浓度。25 μl PCR反应体系:2X Fermentas MaximaTM SYBR Green/ROX qPCRMaster Mix 12.5 μl,模板(cDNA 稀释10 倍)1 μl,引物F和R 5 pmol/μl mix 1 μl,dH2O 10.5 μl。反应条件为:95 ℃ 5 min,94 ℃ 15 s和60 ℃ 30 s,一共循环45次, 95 ℃ 15 s,60 ℃ 15 s,95 ℃ 15 s。从60 ℃~95 ℃,每上升0.5 ℃取一次荧光值,最后生成融解曲线。所有样本均重复检测3次,计算出Ct值,各基因mRNA相对表达量采用2-△△Ct法进行计算分析。PCR 引物合成VEGF 和及内参照β-actin 引物。各基因的上下游引物序列分别为: VEGF:5′-CACCCACCCACATACATACA-3′ ;5′-CTCAAGTCCACAGCAGTCAA-3′;β-actin:5′-GCAGAAGGAGATCACAGCCCT-3′ ;5′-GCTGATCCACATCTGCTGGAA-3′;引物由广州复能基因有限公司合成。
2 结果
2.1 原代胎鼠海马来源NSCs形态及鉴定 分离出胎鼠的大脑,显微镜下解剖出胎鼠海马组织,并提取NSCs。NSCs悬浮生长,随着增殖的NSCs逐渐融合,6~7 d后,肉眼就能辨认出含有数千个细胞的大神经球。原代NSCs在体外是神经球样的,通过显微镜可以看出NSCs悬浮球状生长,通过免疫荧光法证实表达NSCs的特异性标记蛋白Nestin(见图1)。
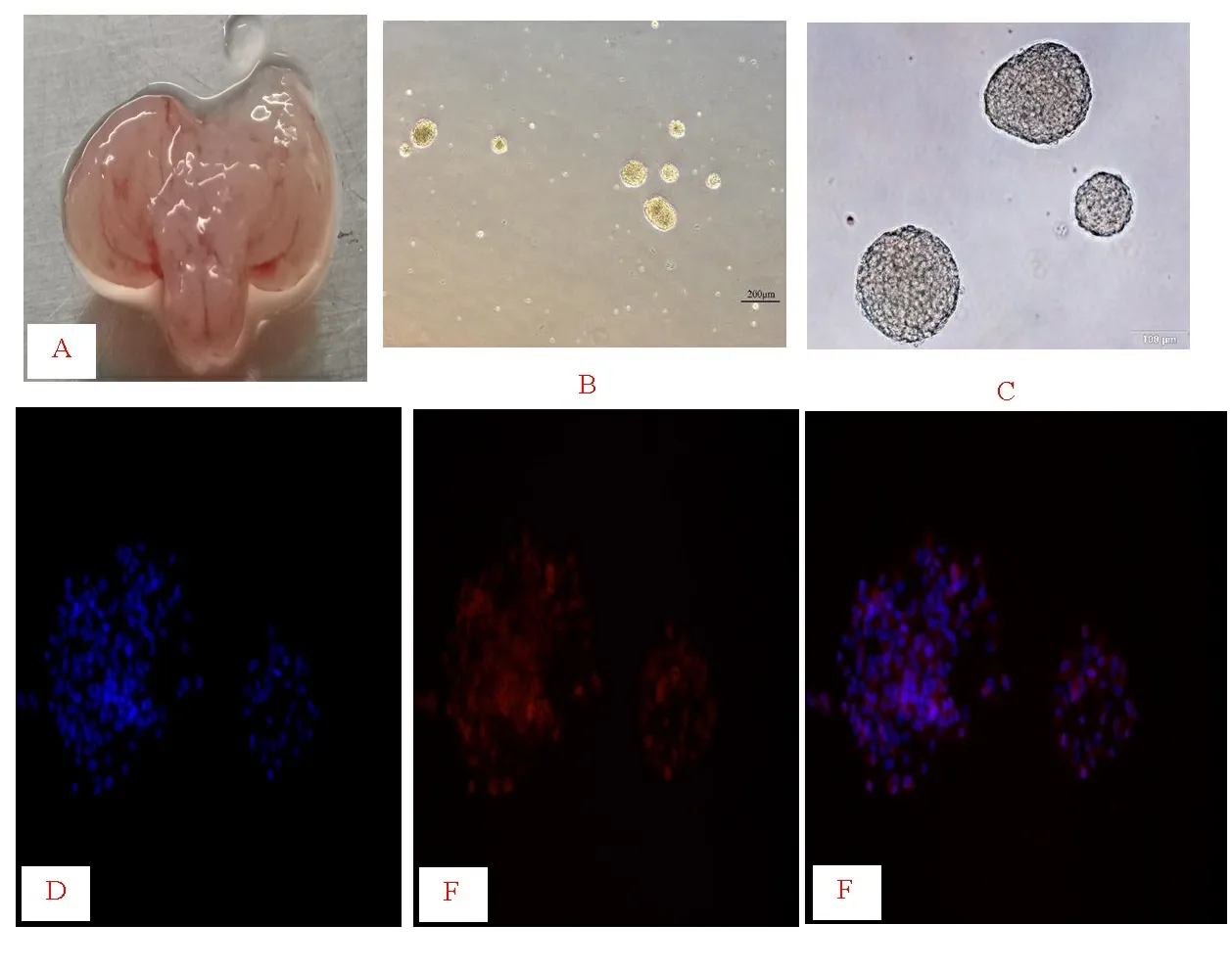
注:A:分离出胎鼠的大脑,可见胎鼠海马组织;B:在显微镜镜下观察神经球(200 μm);C:在显微镜镜下观察神经球(100 μm);D:NSCs免疫荧光鉴定(DAPI,×100);E:NSCs免疫荧光鉴定(Nestin,×100);F:NSCs免疫荧光鉴定(Merge,×100)。
2.2 不同浓度血塞通注射液对NSCs活力的影响 使用CCK8实验对血塞通注射液的浓度进行筛选,评估不同浓度血塞通注射液对NSCs活力的影响(见图2)。可见1 g/L浓度的血塞通注射液能明显增加NSCs的细胞活力,继续增大血塞通注射液的浓度后,NSCs的活力无明显变化。所有的实验数据均来自于至少3次独立重复实验。
2.3 缺氧状态下血塞通注射液对NSCs细胞活力的影响 将NSCs分为无缺氧组、无缺氧+血塞通注射液组、缺氧组、缺氧+血塞通注射液组,其中血塞通注射液浓度为:1 g/L。使用CCK8实验评估血塞通注射液对缺氧状态下NSCs的细胞活力的影响(见图3):①在无缺氧状态中,给药组的细胞活力升高;②在缺氧状态中,NSCs的细胞活力明显下降;③在缺氧状态中,给药组的细胞活力升高。所有的实验数据均来自于至少3次独立重复实验。

注:与0.25 g/L、0.5 g/L、0.75 g/L进行比较,**表示P<0.01。
2.4 缺氧状态下血塞通注射液对NSCs分化能力的影响 将NSCs分为缺氧组、缺氧联合血塞通注射液组,使用干细胞诱导分化培养基(含2%FBS的DMEM培养基)对NSCs进行培养,两组细胞在缺氧环境中培养1 d,然后在无缺氧状态中继续培养2 d。其中血塞通注射液浓度为1 g/L。使用免疫荧光实验评估血塞通注射液对缺氧状态下NSCs分化能力的影响。通过免疫荧光实验证实了缺氧联合血塞通组中神经元、星形胶质细胞、少突胶质细胞的特异性蛋白 Tuj1、GFAP、MBP的荧光强度明显高于缺氧组。在缺氧状态下,1 g/L浓度的血塞通注射液能显著提升NSCs的分化能力(见图4)。NSCs诱导分化及免疫荧光实验显示:在缺氧状态下,血塞通注射液能显著提升NSCs的分化能力。所有的实验数据均来自于至少3次独立重复实验。

注:*、#表示P<0.05,**表示P<0.01。
2.5 缺氧状态下血塞通注射液调控HIF-1α-VEGF通路促进NSCs增殖和分化 将NSCs分为缺氧组、缺氧联合血塞通注射液组,使用干细胞诱导分化培养基(含2%FBS 的DMEM培养基)对NSCs进行培养,两组细胞在缺氧环境中培养1 d。其中血塞通注射液浓度为1 g/L。我们使用Western blot analysis实验及Quantitative RT-PCR实验评估缺氧状态下血塞通注射液促进NSCs增殖和分化的能力是否与HIF-1α-VEGF通路相关(见图5)。所有的实验数据均来自于至少3次独立重复实验。

注:+-代表:单纯缺氧组,++代表:缺氧联合给药组;A:通过Western blot analysis实验发现:缺氧联合血塞通注射液组的HIF-1α蛋白表达水平明显升高(P<0.05),*表示P<0.05。B:通过Quantitative RT-PCR实验我们发现:缺氧联合血塞通注射液组的VEGF表达水平明显升高(P<0.05 ) ,***表示P<0.01。
3 讨论
本研究的目的是探讨血塞通注射液对缺氧状态下神经干细胞活性、增殖和分化的影响,同时探讨其作用机制。研究发现,血塞通注射液的参考治疗浓度为0.8~1 g/L[16-17],我们的研究结果表明,血塞通注射液与增殖培养基中的NSCs共同培养,可提高缺氧状态下NSCs的细胞活性,其最佳浓度为1 g/L。血塞通注射液与分化培养基中的NSCs共同培养,能显著提升NSCs的分化能力。进一步机制研究发现,缺氧状态下血塞通注射液可调控HIF-1α-VEGF通路促进NSCs增殖和分化。
近年来,祖国中医药治疗神经系统病变的药物越来越受重视,其中,主要成分为三七总皂苷的血塞通注射液已广泛应用于临床,血塞通注射液具有抑制血小板聚集,改善脑血供、促进脑功能恢复的作用[18]。虽然在许多神经系统疾病的动物和细胞模型中,血塞通注射液是一种潜在的保护因子,临床实践也证明了其药物安全性[19],但它药物作用的机制并没有得到足够的关注。
自从1992年Reynolds首次提出NSCs的概念后,通过NSCs治疗神经系统疾病,给脑损伤后神经功能的恢复带来了新希望[2]。实验表明[20-23],大脑缺氧发生后,内源性NSCs的增殖、分化以及迁徙过程均受到缺氧因素的影响,从而诱发细胞程序性凋亡,影响脑损伤后神经功能的恢复。HIF-1α是细胞内的一种转录因子,无缺氧状态下可被泛素化蛋白酶降解,但是缺氧状态下泛素化蛋白酶大部分被抑制,因此在缺氧状态下胞质内存在HIF-1α并可发挥作用。HIF-1α可以启动与细胞存活相关的多种基因的表达,从而发挥神经保护作用[24]。VEGF是一种细胞因子,可促进内皮细胞的生长,与神经损伤的修复密切相关[25],有文献证实在脑缺氧环境中,VEGF能够促进NSCs向脑损伤区域迁移[26],并且能促进神经元增殖和新血管的形成[27],有效地保护脑损伤区域的神经功能。Harms KM等[28]发现,NSCs通过激活HIF-1a-VEGF信号通路在缺氧缺血环境促进神经元存活,在中风后促进神经元的存活中的发挥重要作用。
在本研究中,我们发现血塞通注射液与NSCs共培养,在缺氧状态下Western blot analysis显示HIF-1α蛋白水平在NSC分化过程中显著升高,同时Quantitative RT-PCR显示VEGF表达量也升高。揭示缺氧状态下血塞通注射液可能调控HIF-1α-VEGF通路促进NSCs增殖和分化,本研究有一定的局限性,后续研究需要设置模拟剂、抑制剂等组别进行观察,以及补充敲除HIF-1α基因的实验结果。由于本研究是在体外进行的,因此在体内缺氧条件下进一步探讨血塞通注射液对NSCs的影响仍有必要。虽然在我们的研究中HIF-1α和VEGF的表达水平发生了显著的变化,但是目前尚不清楚血塞通注射液在NSCs中调控HIF-1α-VEGF通路的潜在机制,需要进一步研究来揭示这一具体机制。

