缺血再灌注导致急性肾损伤中的细胞死亡形式初探
吴军,覃俊凯,黄华武
(1. 右江民族医学院研究生学院,广西 百色 533000;2. 右江民族医学院附属医院泌尿外科,广西 百色 533000)
急性肾损伤(acute kidney injury,AKI)是一种常见的临床综合征,据统计,大约有3%~18%住院患者出现AKI,并导致住院死亡率的提升[1]。AKI的特点是肾功能急剧下降,体内液体和代谢废物的积累及电解质失衡,并可进展至慢性肾病和终末期肾病。研究显示,肾脏对缺血缺氧高度敏感,肾缺血-再灌注损伤(ischemia-reperfusion injury,IRI)是导致内源性AKI主要原因[2]。肾IRI的病理表现包括线粒体功能障碍、氧化应激和炎症等,但主要病理改变是发生在肾近端小管上皮细胞(tubular epithelial cells ,TECs),它对缺血非常敏感,主要表现为细胞极性丧失、刷状边界损伤、细胞-细胞黏附破坏,引发细胞死亡[3-4]。到目前为止,由于肾IRI引起AKI的机制未完全明确,且没有有效的药物来治疗AKI[5]。以往研究认为,在AKI病理微环境下,依赖半胱天冬酶(caspase)的细胞凋亡(apoptosis)是程序性细胞死亡的唯一形式,然而越来越多的证据表明调控细胞坏死已成为可能,其中坏死性凋亡(necroptosis)和铁坏死(ferroptosis)成为近年研究热点[6-7]。necroptosis结合了坏死与凋亡的特征,在AKI的发展中起着重要作用,ferroptosis,一种以铁依赖性脂质过氧化物积累为特征的调控性坏死,也是肾TECs细胞死亡的主要模式[8-9]。本研究通过建立肾IRI模型,探索参与肾IRI的细胞坏死形式,从而为改善AKI患者的治疗策略铺平道路。
1 材料和方法
1.1 动物和试剂 体重400~500 g的24只雄性Wistar大鼠,由长沙市天勤生物技术有限公司提供。实验大鼠饲养于右江民族医学院实验动物中心,温度25°、12 h光照/黑暗交替、45%湿度的环境中,自由饮水,进食标准普通饲料。实验方案经右江民族医学院动物实验伦理委员会批准。所有大鼠术前禁食8 h,自由饮水。标记荧光素抗体的HRP、MLKL 兔多克隆抗体购自Bioworld公司(Catalog:BS7639),GPX4兔多克隆抗体购自Bioworld公司(Catalog:BS7323),混合谱系激酶结构域样蛋白(MLKL)兔多克隆抗体购自Bioworld公司(Catalog:BS7639),谷胱甘肽过氧化物酶4(GPX4) 兔多克隆抗体购自Bioworld公司(Catalog:BS7323),总超氧化物歧化酶(SOD)活性检测试剂盒购自碧云天公司(货号S0107),脂质氧化丙二醛(MDA)检测试剂盒购自碧云天公司(货号S0131)。
1.2 肾IRI模型建立 将大鼠随机分为4个组,包括正常组(NC组,n=6)、假手术组(Sham组,n=6)、肾缺血组(RI组,n=6)和肾缺血再灌注组(RIR组,n=6),NC组不做处理,用10%水合氯醛300 mg/kg腹腔注射麻醉,将大鼠仰卧位固定于鼠台上,纵行切开皮肤,分离脂肪暴露双肾及肾蒂,Sham组开腹后游离双肾,RI组分离肾动脉并用动脉夹钳夹,观察肾脏由鲜红色变为暗紫色,计时30 min后松开动脉夹,同时收集以上3组血清和肾组织。RIR肾脏恢复为鲜红色表明再灌注成功(180 min),再灌注180 min后收集血清和肾组织。
1.3 血清生化指标检测 各组分别经腹主动脉抽取5 ml血液,低速4 ℃离心取上清,根据总SOD活性检测试剂盒和MDA检测试剂盒操作指示检测血清中SOD、MDA。
1.4 免疫组化病理切片 肾脏纵行切开,福尔马林固定石蜡包埋的组织,切片厚3~4 μm,经过脱蜡、抗原修复、阻断、滴加抗体、显色、衬染、封片等操作,在显微镜下观察MLKL/GPX4蛋白表达情况。
1.5 TUNEL法检测肾细胞死亡 采用脱氧核糖核苷酸末端转移酶介导的末端标记法(TUNEL法)检测每组肾细胞凋亡情况,具体步骤按TUNEL检测试剂盒说明书操作。在显微镜下观察每张切片约200个细胞死亡情况并拍照。
1.6 肾组织MLKL/GPX4蛋白 采用Western blot检测,取肾组织进行总蛋白抽提,将提取的蛋白溶液与5×上样buffer按5∶1比例混合均匀,煮沸5 min,待冷却,配置电泳胶,胶凝后用1×电泳缓冲液清洗胶孔上样,80 V恒压电泳50 min,120 V恒压电泳,至溴酚蓝刚出胶底部时停止电泳等,最后将膜放至暗盒显影。

2 结果
2.1 血清抗氧化指标 与NC组比较,RI、RIR两组中的SOD活力均明显下降(P<0.05),且RIR下降更为明显,见图1A;RIR组的MAD含量明显上升(P<0.05),见图1B。
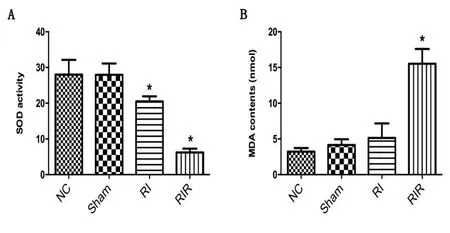
A:血液中SOD活力;B:血液中MDA含量。NC代表正常组;Sham代表假手术组;RI代表缺血组;RIR代表缺血再灌注损伤组。与NC组相比,*表示P<0.05。
2.2 TUNEL法检测肾细胞坏死结果 RI组、RIR组的肾细胞死亡数明显增多,TUNEL法显示RIR组中可以观察到部分细胞发生肿胀、变圆甚至出现凋亡小体,见图2A;RIR组中细胞死亡数量明显上升(P<0.05),柱状图细胞死亡比率与之相符合,见图2B。

A:TUNEL法检测各组大鼠肾脏细胞在光学显微镜下形态,标尺为50 μm;B:对应柱状图显示各组小鼠细胞死亡比率。NC代表正常组;Sham代表假手术组;RI代表缺血组;RIR代表缺血再灌注组。与NC组相比,*表示P<0.05。
2.3 Western blot检测肾脏组织中MLKL、GPX4蛋白的表达结果 RIR组肾脏组织中MLKL蛋白的表达较其他3组显著升高,见图3A、图3B;RI组、RIR组GPX4蛋白的表达显著降低,与NC组及sham组相比,差异有统计学意义(P<0.05),见图3C、图3D,RIR下降更明显。
2.4 免疫组化
2.4.1 MLKL蛋白免疫组化结果 免疫组化病理切片显示MLKL蛋白在RIR中棕黄色阳性细胞数量明显增加(尤其是箭头所指的肾小管上皮细胞,见图4A),说明MLKL蛋白表达在RI/RIR中显著上升(P<0.05),见图4B。

A、C为MLKL、GPX4蛋白与各自内参GAPDH的Western blot检测代表性蛋白条带图片;B、D为定量分析的MLKL、GPX4蛋白表达水平。与NC组相比,*表示P<0.05。

A:免疫组化病理切片显示各组大鼠肾细胞中MLKL蛋白的表达,箭头所指为肾小管上皮细胞,与其他各组相比,RIR组中含MLKL蛋白的阳性棕黄色细胞数显增加,标尺为50 μm。B:显示各组小鼠肾脏切片MLKL蛋白占比的数据柱状统计图,结果与A一致。NC代表正常组;Sham代表假手术组;RI代表缺血组;RIR代表缺血再灌注组。与NC组相比,*表示P<0.05。
2.4.2 GPX4蛋白免疫组化结果 GPX4免疫组化病理切片显示,与其他各组相比,RIR组GPX4蛋白表达区域占比明显减少,差异有统计学意义(P<0.05),见图5。
3 讨论
AKI是一种以短期肾功能突然下降,引起血肌酐上升和水电解质、酸碱平衡紊乱,导致全身各个系统发生障碍的临床综合征。非重症住院患者患AKI的死亡率甚至高达10%~20%[10]。导致AKI的原因有多种,包括肾灌注不足、休克或败血症引起的肾缺血再灌注损伤,而肾缺血-再灌注损伤是导致内源性AKI主要原因[2]。线粒体功能障碍、氧化应激和炎症也可促成AKI的发生,但主要病理改变是发生在TECs,它对缺血非常敏感,主要表现为细胞极性丧失、刷状边界损伤、细胞-细胞黏附破坏,引发细胞死亡[3-4]。necroptosis的发现使调控细胞坏死成为可能,从而对AKI的未来治疗产生潜在的影响[11-12]。有相当多的证据表明,necroptosis是一种与坏死形态相似的程序性细胞死亡,在AKI和肾纤维化的发展中起着重要作用[13]。此外,最近的证据表明,ferroptosis,一种以铁依赖的脂质过氧化物积累为特征的调控性坏死,可能是肾TECs细胞死亡的主要模式[7,9]。随着对细胞死亡形式的研究,多种细胞死亡途径被发现,但对AKI中所发生的细胞坏死形式的研究尚不全面,本文旨在通过建立肾IRI模型,研究参与由肾IRI导致AKI的细胞坏死形式。

A:免疫组化病理切片显示各组大鼠肾细胞中GPX4蛋白的表达,与其他各组相比,RIR组含GPX4蛋白细胞数明显减少,标尺为50 μm。B:显示各组小鼠肾脏切片GPX4蛋白表达区域占比,结果与A一致。NC代表正常组;Sham代表假手术组;RI代表缺血组;RIR代表缺血再灌注组。与NC组相比,*表示P<0.05。
本研究中通过TUNEL检测,观察到在NC组和Sham组中基本未出现肾细胞死亡而在RI组及RIR组中细胞死亡数量明显上升,肿胀、变圆细胞数增多,而在RIR组中细胞死亡更为明显,有些细胞已经发生染色质浓缩、边缘化、核膜裂解等明显细胞死亡形态。TUNEL阳性细胞数的增多表明RIR模型建立成功。
Necroptosis是一种不同于细胞程序性死亡的细胞死亡方式,最早由Degterev A等[14]通过对大脑缺血性损伤研究中所注意到的。当发生necroptosis时,配体与死亡受体结合,各种下游分子被有序招募[15]。所启动的下游通路作用于受体反应蛋白激酶1(receptor-interacting protein kinase 1,RIPK1)和3(RIP-K3),其磷酸化后形成坏死小体(necrosome)[15-16]。坏死小体磷酸化MLKL,磷酸化的MLKL随之经历寡聚反应与质膜中的磷脂酰肌醇磷酸盐结合导致膜穿孔,继而发生necroptosis[17-20]。此外激活的MLKL也被招募到线粒体膜上,导致线粒体功能障碍[21]。所以可以把磷酸化的MLKL看作为necroptosis的执行者,通过检测MLKL的水平可以反映出是否发生了necroptosis,免疫组化结果显示MLKL蛋白在NC组、Sham组、RI组中未见明显的棕黄色阳性的细胞,而在RIR组中棕黄色阳性细胞数量显著上升,这说明在RIR模型中有necroptosis的参与。在大多数细胞发生necroptosis的同时也伴随着活性氧(ROS)的生成,ROS大量产生超过机体的清除能力使体内抗氧化活性被消耗,ROS激增合并线粒体过氧化,导致线粒体膜通透性增加,释放毒性蛋白到胞质中,引起DNA链损伤,对于necroptosis就产生了一个前馈效应,ROS已被证明在包括肾I/R损伤等多种情况下会触发坏死性凋亡[22-24]。血液SOD活力的高低反应了细胞的抗氧化能力,MDA的含量则反应出细胞膜过氧化程度,他们都可以作为氧化损伤程度的标志,下一步,随着研究的进行,我们将进一步增加对ROS及其他指标的检测。在图1中,与其他各组相比,RIR组中的SOD活力明显降低,MDA的含量明显升高。除necroptosis发生了氧化应激,ferroptosis的发生也依赖于ROS,由于I/R损伤也诱导了大量ROS的产生[25],因此铁死亡可能也参与了肾I/R损伤的发病机制[26-27],此外,在指部死亡组织研究中,有明显的ROS上升及GPX4水平的下降,也暗示存在ferroptosis的激活[28]。RIR模型中总抗氧化能力SOD的下降以及氧化指标MDA的上升都为上述两种细胞死亡形式的发生提供了依据。
Ferroptosis是一种新型调控细胞死亡途径,最早是由Dixon SJ等[29]发现的,其特征是依赖铁反应的脂质过氧化物的积累。谷胱甘肽(GSH)是一种天然抗氧化剂,可以保护细胞免受氧化应激影响,GSH和谷胱甘肽过氧化物酶(GPX)一起,通过催化过氧化氢生成氧和水来消除过氧化氢[30]。在哺乳动物中,存在8种GPX,而在这之中只有GPX4具有催化过氧化氢脂质的功能,使其成为GSH抗氧化作用的核心调控酶[31]。在正常情况下,GPX4可以通过还原磷脂氢过氧化物来阻止脂质的氧化,若表达减少或降低都可发生ferroptosis,它充当了铁死亡守门人的角色,可以作为判断铁死亡的主要指标[32]。因此,我们通过Western blot检测了各组大鼠中的GPX4,发现在RIR中GPX4蛋白表达对比NC、Sham、RI 3组中的GPX4蛋白表达明显下降,差异有显著性;免疫组化的结果也与Western blot检测结果相符。这反映出在RIR中有ferroptosis参与。
综上所述,本研究通过建立大鼠RIR模型,通过对细胞凋亡、氧化应激及RIPK3、GPX4的研究,确定了IR引起的细胞死亡不仅是凋亡,还有necroptosis和ferroptosis。两种细胞死亡伴随着ROS的产生,而ROS也可进一步推动两种细胞死亡的进程,同时钙离子参与了necroptosis和ferroptosis发生过程也有报道,尽管necroptosis和ferroptosis的下游调控方式存在相通之处,但对于这两种死亡方式的机制并未研究透彻,一个疾病的发生发展,往往是多种通路共同调控的,进一步探究AKI中细胞死亡机制将为AKI的治疗奠定扎实基础。

